ポイント
- 正常な状態の成体の大脳皮質では神経細胞が新たに生まれてこないと考えられていた。
- 薬の投与によって、正常な大脳皮質でも神経細胞を増やすことに成功。
- 大脳皮質の保護・再生、うつ病などの精神疾患の新しい予防・治療法の開発に期待。
JST 課題達成型基礎研究の一環として、藤田保健衛生大学 総合医科学研究所の宮川 剛 教授と大平 耕司 講師らは、抗うつ薬の投与によって正常な成体マウスの大脳皮質注1)の神経細胞を増やすことに成功しました。
これまでに本研究グループは、成体大脳皮質には神経細胞を産生できる神経前駆細胞(L1-INP細胞)注2)が存在し、虚血注3)などにより脳が損傷されると神経細胞を増やす効果があることを発見していました。もし、そのL1-INP細胞を薬などによって人為的に増殖・分化させることができれば、大脳皮質が損傷しても保護したり再生したりすることができると期待されるため、L1-INP細胞の増殖・分化の制御法の開発が望まれていました。
今回本研究グループは、抗うつ薬の1つであるフルオキセチン注4)を成体マウスに投与することにより、L1-INP細胞の増殖・分化を促進させ、抑制性神経細胞注5)を産生させることに世界で初めて成功しました。さらに、あらかじめ薬により抑制性神経細胞を増やしておくと、その後マウスに脳虚血を起こした場合に、新しい神経細胞の周辺で神経細胞死が抑えられることも発見しました。
本研究の成果は、L1-INP細胞を活性化することによって、大脳皮質の損傷から神経細胞を保護し再生させるための新しい治療法の開発に貢献することが期待されます。さらに、統合失調症やうつ病などの精神疾患では大脳皮質の抑制性神経細胞や抑制性神経伝達物質が減少することが知られていることから、L1-INP細胞の増殖や分化をターゲットにした新しい精神疾患の予防・治療法の開発に結びつく可能性もあります。
なお、本研究成果の一部は、最先端・次世代研究開発支援プログラムの一環として 行われました。
本研究成果は、2013年1月4日(米国東部時間)に米国科学誌「Neuropsychopharmacology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出」
(研究総括:樋口 輝彦 国立精神・神経医療研究センター 総長)
|
| 研究課題名 |
「マウスを活用した精神疾患の中間表現型の解明」 |
| 研究代表者 |
宮川 剛(藤田保健衛生大学 総合医科学研究所 教授) |
| 研究期間 |
平成19年10月~平成25年3月 |
JSTはこの領域で、少子化・高齢化・ストレス社会を迎えた日本において社会的要請の強い認知・情動などをはじめとする高次脳機能の障害による精神・神経疾患に対して、脳科学の基礎的な知見を活用し、予防・診断・治療法などで新技術の創出を目標にしています。上記研究課題では、精神疾患モデルマウスの脳について各種先端技術を活用した網羅的・多角的な解析を行い、生理学的、生化学的、形態学的特徴の抽出を進め、さらに、これらのデータを人間の解析に応用することによって、精神疾患における本質的な脳内中間表現型の解明を目指します。
<研究の背景と経緯>
成熟した哺乳類の脳は、いったん損傷を受けるとほとんど再生せず、機能的に障害が残ったままになってしまうことが知られています。現在、脳を再生し機能的に回復へと導く手法として、主に2つの方策が考えられています。1つは、ES(Embryonic stem)細胞やiPS(inducible Pluripotent stem)細胞を利用して、体外で神経細胞を増殖・分化させた後、脳へ移植する方法です。しかし、この方法は、それらの未分化な細胞を大脳皮質に存在する多様な神経細胞に分化させる必要があり、現状では技術的に困難です。また、移植した細胞ががん化する可能性もあり、体外から細胞移植することによって脳損傷による疾患を治療する方法は未解決の問題も多く、いまだ開発途上にあります。
もう1つは、もともと脳内にある神経幹細胞や神経前駆細胞(L1-INP細胞)を活性化させ、損傷された神経細胞に分化させる方法です。この治療法では、対象となる脳の領域に存在する神経幹細胞や神経前駆細胞の増殖や分化を制御できることが必須となります。本研究グループは、これまでに成体ラットの大脳皮質で神経前駆細胞(L1-INP細胞)が存在することを世界に先駆けて発見しました。また、成体の大脳皮質では通常新たに神経細胞を産生することはありませんが、L1-INP細胞は脳虚血により脳が障害を受けると、新たに抑制性神経細胞を産出することも発見しました。従って、薬物などの人為的な方法により、L1-INP細胞の増殖や分化を制御できれば、1)脳卒中時の神経活動が過度に興奮することによる神経細胞死の抑制、2)大脳皮質の抑制性神経細胞が関与する精神・神経疾患の予防・治療法の開発――に応用できる可能性があります。しかし、大脳皮質が正常な状態で、L1-INP細胞の神経新生を制御できる方法は全く明らかにされていませんでした。
<研究の内容>
本研究グループは、成体マウスに世界で最もよく使われている抗うつ薬の1つであるフルオキセチンを投与し、組織学的手法を用いて大脳皮質に存在する神経前駆細胞であるL1-INP細胞の増殖や分化について解析を行いました。
まず、L1-INP細胞の増殖について検討したところ、L1-INP細胞の増加は、大脳皮質のほとんど全ての領域(前頭皮質、運動皮質、体性感覚皮質、視覚皮質)で生じていました(図1)。さらに、L1-INP細胞による新しい神経細胞の産生について調べたところ、新生した神経細胞の約80%は、抑制性神経伝達物質であるGABAに陽性の抑制性神経細胞であることが明らかとなりました(図2)。従って、フルオキセチンの投与によって、成体の大脳皮質ではL1-INP細胞が増殖するだけではなく、L1-INP細胞によって新しい抑制性神経細胞の産生が促進されることが分かりました。この結果は、健常な成体の大脳皮質で薬により神経細胞を増やすことができることを示した世界で初めての研究です。
次に、新しく産生された神経細胞の機能について解析しました。新しい神経細胞が抑制性であることから、脳虚血の時に引き起こされる神経細胞死が、新しい神経細胞によって抑制されるのではないかと予想しました。そこで、フルオキセチンを投与する期間中、大脳皮質の片側の半球には、細胞分裂を抑える薬物を投与してL1-INP細胞が細胞分裂を起こさないようにし、もう片側の半球には、対照として生理的食塩水を投与しました。その後、マウスに脳虚血を起こすと、L1-INP細胞の細胞分裂を抑えた半球と比較して、L1-INP細胞から新しい神経細胞が増加した半球では、神経細胞死が抑制されることを見いだしました(図3)。さらに、個々の神経細胞に注目すると、新しく産生された抑制性神経細胞の細胞体から20~110マイクロメートル(マイクロは100万分の1)以内に存在する神経細胞の細胞死も抑制されていることを発見しました(図4)。この結果は、成体の大脳皮質で新しく産生された細胞が神経細胞としての機能を持っていることを世界で初めて実験的に証明したものであり、学術的に大きな進歩といえます。
<今後の展開>
本研究によって、健常な成体マウスの大脳皮質において薬で神経細胞を増やすことが可能であることを示しました。さらに、新しい神経細胞によって脳虚血時の神経細胞死が抑制されることも分かりました。
近年統合失調症やうつ病などの一部の精神疾患について、患者の死後脳やMRIなどを用いた研究により、大脳皮質の抑制性神経細胞数や抑制性神経伝達物質であるGABAが減少していることが徐々に明らかになっています。以上のことより、今後、L1-INP細胞の増殖・分化の制御の仕組みをさらに解明することで、大脳皮質の損傷からの神経細胞の保護・再生や大脳皮質の抑制性神経細胞が関係する精神・神経疾患に対する新しい予防・治療法の開発や創薬が期待できます。
<参考図>
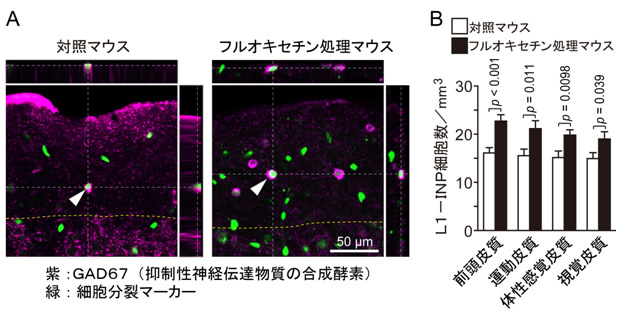
図1 フルオキセチンの投与によってL1-INP細胞が増加する
- A:対照マウスとフルオキセチン処理マウスの大脳皮質におけるL1-INP細胞の顕微鏡写真。L1-INP細胞は、抑制性神経伝達物質であるGABAの合成酵素であるGAD67と細胞分裂マーカーの二重で染色されます。
- B:L1-INP細胞は、今回解析した全ての脳領域で、フルオキセチン処理によって増加していました。
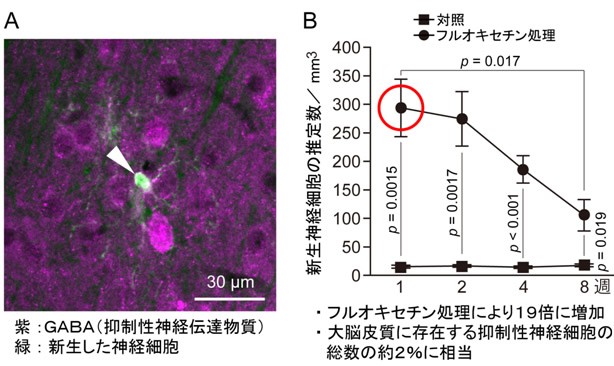
図2 L1-INP細胞から生まれた細胞は抑制性神経細胞であった
- A:新しい神経細胞の約80%は、抑制性神経伝達物質であるGABAを発現していました。
- B:新しい神経細胞の数は、フルオキセチン処理後1週間で、対照の約19倍に増加していました。また、新しい神経細胞の推定値は、大脳皮質の全抑制性神経細胞の約2%に相当します。
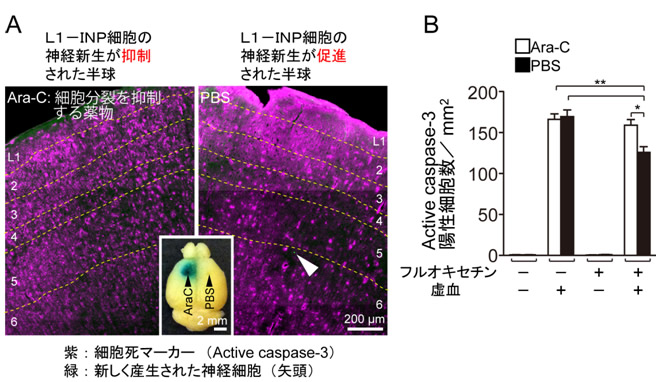
図3 新しい神経細胞は脳虚血での神経細胞死を抑制する
- A:細胞死のマーカーであるActive caspase-3(紫)と新しい神経細胞(緑:右の写真中の矢頭。新しい神経細胞はあらかじめ蛍光たんぱく質で標識)の二重染色を行った大脳皮質の写真。左の大脳皮質の半球には、細胞分裂を抑制する薬物であるAra-C(投与部位が可視化できるように色素を同時に投与)、右の大脳皮質の半球には、対照としてPBS(生理食塩水)が投与されています。従って、マウスはフルオキセチン処理されても、Ara-C投与半球では、L1-INP細胞の神経新生が抑えられ、PBS投与半球では、L1-INP細胞の神経新生は促進されています。
- B:細胞死のマーカーであるActive caspase-3(紫)を定量化した結果、Ara-Cの投与によりL1-INP細胞の神経新生が抑えられると神経細胞死が抑えられませんでしたが、L1-INP細胞の神経新生が促進された半球では、神経細胞死が有意に抑制されたことが明らかとなりました。
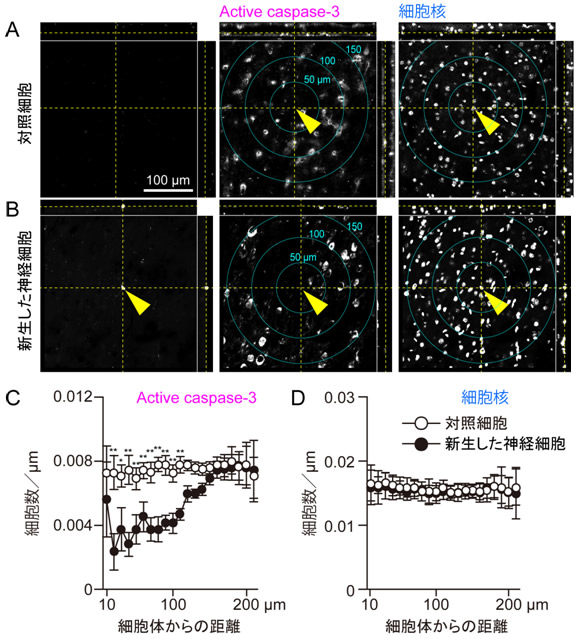
図4 新しい神経細胞の周辺では神経細胞死が抑制される
- AとB:新しい神経細胞(B)と対照細胞(A)における細胞死のマーカーActive caspase-3と細胞核の三重染色の写真。新しい神経細胞はあらかじめ蛍光たんぱく質で標識しています。
- C:新しい神経細胞と対照細胞の細胞体を中心に同心円を描いて、同じ円上に存在するActive caspase-3陽性細胞数を定量しました。新しい神経細胞の周辺20~110マイクロメートル内で神経細胞死が、対照細胞と比較して、有意に減少していました。
- D:Cの定量で用いた同じ細胞の細胞体を中心にして、細胞の核の分布を定量すると、新しい神経細胞と対照細胞の両方で、ほぼ同じように均一に分布していることが明らかとなり、Cの解析で見られた、新しい神経細胞の周辺でのActive caspase-3陽性細胞の減少は、新しい神経細胞が脳虚血から神経細胞を保護していることを示唆しています。
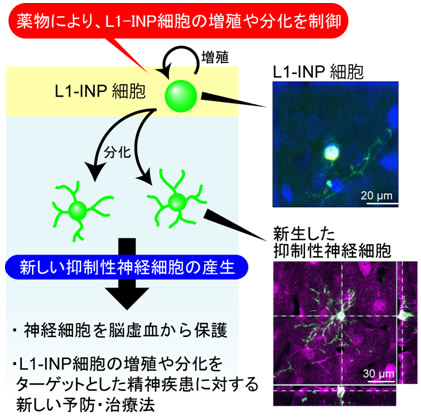
図5 本研究のまとめ
本研究により、健常な大脳皮質でも、薬物により、L1-INP細胞の増殖や分化を促進することができました。また、新しく産み出された神経細胞のほとんどが抑制性神経細胞であり、脳虚血による神経細胞死を抑える働きを持っていることが明らかとなりました。
今後、脳卒中などの脳の損傷からの神経細胞の保護・再生や抑制性神経細胞の減少が関係する一部の精神疾患に対して、L1-INP細胞の増殖や分化をターゲットとした新しい予防・治療法の開発や創薬につながることが期待されます。
<用語解説>
- 注1) 大脳皮質
- 大脳皮質は、認識、運動、思考、記憶、意識などの脳高次機能と密接に関連しており、ほ乳類になってから非常に発達した薄いシート状の構造で、脳の表面に位置しています。
- 注2) 神経前駆細胞(L1-INP細胞)
- 神経幹細胞は、未分化な性状を保ったまま増殖できる自己複製能と、神経細胞、アストロサイト、オリゴデンドロサイトに分化することができる多分化能の両方を持っています。神経前駆細胞は、神経幹細胞から産み出され、自己複製能を持ち神経細胞を産生することのできる少し分化した細胞です。L1-INP細胞は神経前駆細胞の1つで、脳虚血時や今回の研究で明らかになったように抗うつ薬の投与によって抑制性神経細胞を産生します。
- 注3) 虚血
- 脳卒中(脳梗塞、脳出血、くも膜下出血)や脳の外傷、一過性心肺機能停止後の蘇生により、脳の一部または全体が、一過性にあるいは永久的に血液が脳に行き渡らない状態のことを虚血といいます。虚血状態になると、脳のエネルギー源であるグルコースや酸素の供給が絶たれてしまうために、その領域の神経細胞の生存が維持できなくなり死滅します。
- 注4) フルオキセチン
- 抗うつ薬の1つで、セロトニン神経終末から放出されたセロトニンが神経末端に再取込されるのを防ぎ、細胞外のセロトニン濃度を上昇させます。
- 注5) 抑制性神経細胞
- 相手となる神経細胞の活動電位の発生を抑制する神経細胞のことです。大脳皮質を構成する神経細胞の約20~30%を占めます。
<論文タイトル>
“Fluoxetine-induced cortical adult neurogenesis”
(抗うつ薬フルオキセチンによる成体大脳皮質の神経新生)
doi: 10.1038/npp.2013.2
<お問い合わせ先>
<研究内容に関すること>
宮川 剛(ミヤカワ ツヨシ)
藤田保健衛生大学 総合医科学研究所 システム医科学研究部門 教授
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1-98
Tel:0562-93-9375 Fax:0562-92-5382
E-mail:
<JSTの事業に関すること>
石正 茂(イシマサ シゲル)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: