<概要>
 ナノ-ランタンの分子構造図と自由行動下の
ナノ-ランタンの分子構造図と自由行動下の
小動物個体体内にある癌組織の検出
大阪大学 産業科学研究所 生体分子機能科学研究分野の永井 健治 教授、国立遺伝学研究所の堀川 一樹 准教授、北海道大学 大学院医学研究科の初谷 紀幸 特任助教、京都大学 大学院薬学研究科の樋口 ゆり子 特定助教らの共同研究グループは、化学発光タンパク質と蛍光タンパク質をハイブリッド化することで、従来よりも10倍以上明るく光る超高輝度化学発光タンパク質Nano-lantern(ナノ-ランタン)を開発しました。ナノ-ランタンでマーキングすることにより自由行動下におけるマウス体内の癌組織を実時間検出することに世界で初めて成功しました。また、ナノ-ランタンを改変してCa2+やcAMP、ATPを検出できる発光プローブの開発にも成功しました。注)これらの発光プローブは励起光を必要としないため、蛍光タンパク質ではできなかった観察による新たな発見が期待されます。また、光で細胞の活動やタンパク質の機能を制御する「光遺伝学的技術(オプトジェネティクス)」と組み合わせることが容易です。例えば、神経活動の操作と計測を同時に行うことができるため、複雑で実験が困難であった高次神経活動(行動、思考、記憶)のメカニズムに迫ることが可能となります。
<研究の背景>
下村 脩 博士らのノーベル化学賞受賞で知られる蛍光タンパク質の開発・実用化に伴い、生きた細胞や組織、個体内で繰り広げられる生理現象を観察するいわゆる“ライブイメージング”技術が普及し、本年度のノーベル生理学医学賞を受賞した山中 伸弥 博士のiPS細胞研究にも大いに利用されています。しかしながら、蛍光観察に不可欠な紫外線などの励起光照射は細胞に対して毒性を示す上に、観察対象によっては強い自家蛍光や光応答性を有するため、励起光の照射を必要としない“生物発光”の利用が注目されつつありました。生物発光とはホタルなどが出す光のことで、ルシフェラーゼと呼ばれる酵素タンパク質の触媒反応により、化学エネルギーを用いて発光物質ルシフェリンが発光する現象です。励起光の照射を必要としない点で優れているものの、蛍光に比べて暗いためライブイメージングへの応用は進んでいませんでした。
<本研究成果が社会に与える影響(本研究成果の意義)>
ナノ-ランタンおよびそこから生み出された発光プローブは遺伝子にコードされているため、任意の生物の多様な組織における計測を可能にし、多くの疾病の原因究明や効果的な創薬スクリーニングの開発が期待されます。
注)ナノ-ランタンを発現する腺癌の細胞をICRマウスの体内に移植して撮影
背景
蛍光タンパク質を中心とした蛍光プローブの普及に伴い、生物個体を生きたまま可視化するライブイメージング技術が著しい発展を遂げています。観察対象が様々な動植物種に広がる一方で、蛍光観察が有するサンプルへの光毒性や自家蛍光といった問題が浮上してきました。これらの問題を回避するために、永井研究者らはホタルに代表される「生物発光」を用いたライブイメージングに取り組んできました。生物発光は発光タンパク質が発光基質の酸化を触媒することで光が発生する現象です。有名なホタルも発光タンパク質と発光基質(それぞれルシフェラーゼとルシフェリン)によって発光することがわかっています。生物発光は蛍光と違い外部からの励起光を必要としないため、自家蛍光や光毒性といった問題を回避することができます。このような利点があるにも関わらず生物発光は蛍光に比べて明るさが足りないという弱点があったためライブイメージングの道具として有用ではありませんでした。
1.研究手法と成果
永井研究者らは生物発光を用いてライブイメージングをするために、従来用いられてきた発光タンパク質(改変型ウミシイタケルシフェラーゼ;RLuc)の明るさを改善することを考えました。そのためにまずRLucのタンパク質安定性を向上させることが知られているアミノ酸変異を導入後、エラー誘発PCR法(塩基配列に変異が入った様々なDNA断片を大量に得る方法)を用いてランダムに変異を導入し様々な変異体を作成しました。その中からより明く発光する能力を得たものをそれぞれのスペクトルを測定して選択しました。さらに、永井研究者らは発光するクラゲ等の刺胞動物がその発光器官内で行なっている「生物発光共鳴エネルギー移動(BRET)」というユニークな現象を利用して発光の効率を飛躍的に上昇させることを着想しました。BRETは発光基質が光を放出するために使うエネルギーを非常に近傍にある蛍光タンパク質に移動する現象です。BRETが起こると結果として発光タンパク質ではなく蛍光タンパク質が光を放出します。発光タンパク質よりも蛍光タンパク質が光を放出する効率が高い場合、発光量が増えることになります。そこで、発光タンパク質と蛍光タンパク質が隣接するような状況を強制的に作るために、両者の融合タンパク質を作成しました(図1)。大腸菌に発現させ精製したこの融合タンパク質の発光能を測定した結果、既存のRLucに比べて10倍以上明るく発光することがわかりました(図1)。自発的に発光するナノスケールの光源という意味を込めて「Nano-lantern(ナノ-ランタン)」と名付けました。
生体内で実際に明るく発光するということを示すためにまず培養細胞での検証を行いました。細胞内オルガネラに局在するNano-lanternを作成したところ、蛍光に遜色ない画像が得られました(図2)。次にNano-lanternを発現させた癌細胞をマウスの皮下に移植して、生物発光で癌細胞を検出する実験を行うことにしました。これは癌細胞の成長・転移を調べるためにこれまでも蛍光や生物発光を用いて行われきた実験です。これまでは蛍光で検出する場合は励起光を当てるためにマウスの毛を剃って光の透過性を上げる必要がありました。生物発光で検出する場合は、マウスが動かないように麻酔をし、暗い環境において長時間露光撮影する必要がありました。これらの処置をすること無く、永井研究者らはNano-lanternを用いることで、自由に動き回るマウスの背中で光る癌細胞の様子をビデオレートで撮影することに成功しました(図2)。これはNano-lanternを用いることで抗癌剤の評価や癌の転移について、マウスを手術することなく、しかも簡便に評価できることを意味します。
さらに永井研究者らはこれまで蛍光ではできなかったイメージングを行うために、細胞内で重要な働きを持つCa2+、cAMP、ATPを検出する機能性プローブを作成しました。これはNano-lanternの発光タンパク質部分に、Ca2+、cAMP、ATPそれぞれに結合して構造が変わるタンパク質配列を挿入することで達成できました(図3)。それぞれを検出する小分子の名前をとって、Nano-lantern(Ca2+)、Nano-lantern(cAMP)、Nano-lantern(ATP)と名づけました。
従来のCa2+プローブでは不可能だった高速度でのイメージングを試みるために、Nano-lantern(Ca2+)をHeLa細胞(培養されたヒト由来の癌細胞)に発現させたところ、これまでの発光性Ca2+プローブでは不可能だったビデオレートでのイメージングに成功しました(図4)。
また、蛍光性cAMPプローブよりも大きな変化量を持つNano-lantern(cAMP)を用いることで、従来の蛍光性プローブでは変化が小さすぎて検出できなかった多数のアメーバ細胞間で起こるcAMPを介したシグナル伝播のイメージングに成功しました(図5)。
さらにこれまで自家蛍光や光応答の問題があり蛍光での観察が困難であった植物葉のイメージングに取り組みました。葉緑体に局在発現させたNano-lantern(ATP1)を作成し、光合成でATP産生が起こる様子を世界で初めて観察することに成功しました(図6)。
2.今後への期待
Nano-lanternおよびそこから生み出されたプローブは遺伝子にコードされているため、任意の生物の多様な組織における計測を可能にします。Nano-lanternを用いることで、特別な処置すること無くマウスを生物発光で観察できるので多くの疾病の原因究明やより効果的な創薬スクリーニングが期待されます。
また、励起光を必要としないNano-lanternは、光照射により細胞の活動やタンパク質の機能を制御する「光遺伝学的技術」と組み合わせることが容易です。例えば、神経ネットワークのコントロールと神経活動のモニタリングを同時に行うことができるため、複雑で実験が困難であった高次神経活動(行動、思考、記憶)のメカニズムに迫ることが可能となります。
<参考図>
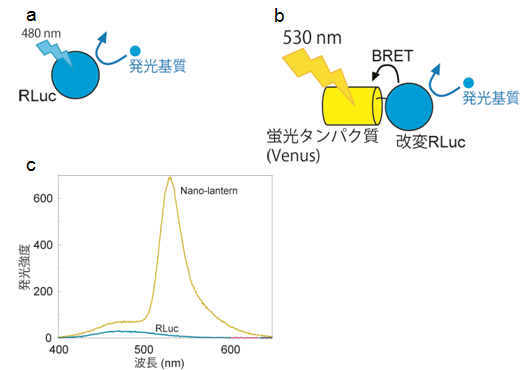
図1 今回開発したナノスケールの光源(Nano-lantern)
- (a)従来はRLucに酸化された発光基質は発光効率が低く、480nm(青色)の光を微弱ながら放出します。
- (b)Nano-lanternでは、改変RLucに酸化された発光基質のエネルギーは隣接する蛍光タンパク質(Venus)に移動します。蛍光タンパク質は発光効率が高いため、530nm(黄色)の光を強力に放出します。
- (c)精製したタンパク質でスペクトルを測定するとNano-lanternは従来のRLucよりも10倍以上明るく光ることがわかりました。
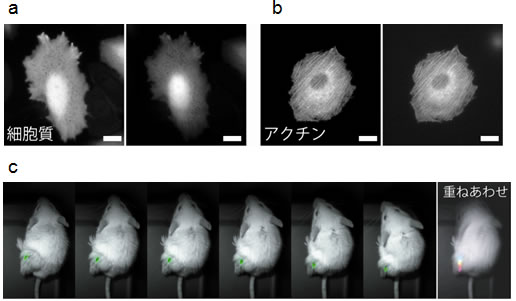
図2 今回開発したナノスケールの光源(Nano-lantern)のライフサイエンスへの応用
(a)HeLa細胞の細胞質に局在させたNano-lanternと(b)アクチンに局在させたNano-lanternの画像。一見ではどちらが生物発光像(左)か蛍光像(右)か見分けがつきません。スケールバーは20マイクロメートル。(c)癌細胞に発現させたNano-lantern(緑色で表示)を移植したマウスのビデオレート撮影と、癌細胞の色を変えて重ねあわせた画像。
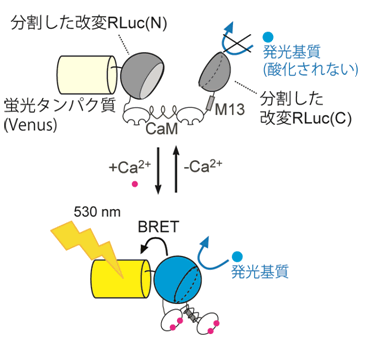
図3 Nano-lanternから機能性プローブの作成の模式図
ここではNano-lantern(Ca2+)を例にとって説明します。Ca2+に依存して相互作用するカルモジュリン(CaM)とM13ペプチドを改変RLucの内部に挿入することで改変RLucをN末端側とC末端側に分割しました(それぞれ(N)、(C)と表記しました)。周りにCa2+が無い時は発光基質を酸化することができないため光を放出できません。Ca2+がある時はCaMとM13ペプチドが相互作用してコンパクトな構造をとります。これに伴い分割改変RLucが元の構造に戻り、基質を酸化する能力を取り戻します。結果的にはNano-lanternと同じく530nm(黄色)の光を放出します。同様にNano-lantern(cAMP)、Nano-lantern(ATP1)も作成しました。
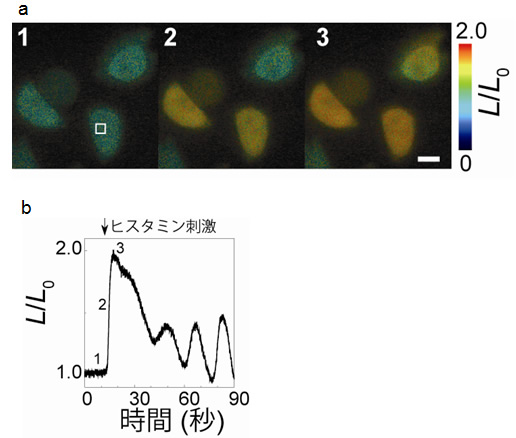
図4 機能性プローブNano-lantern(Ca2+)を使ったビデオレートCa2+イメージング
Nano-lantern(Ca2+)を発現させたHeLa細胞に対し、ヒスタミン刺激を与えて強制的に細胞内Ca2+濃度を上昇させました。
- (a)ヒスタミン刺激後のHeLa細胞の連続画像。ヒスタミンは1と2の間で加えています。細胞内Ca2+濃度上昇の様子が色(緑→赤)でわかります。
- (b)スケールバーは10マイクロメートル。細胞内の領域((a)の白い四角内)のCa2+濃度の様子。細胞内Ca2+濃度は一度上昇し、その後、上昇と減少を繰り返す典型的なパターンを示しました。
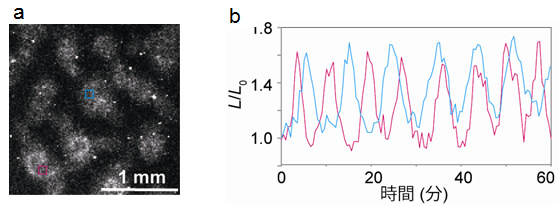
図5 機能性プローブNano-lantern(cAMP)を使った多細胞間シグナルのイメージング
- (a)10万のアメーバ細胞が集合する際に発するcAMPの波。
- (b)水色とマゼンタ色で囲まれた領域のcAMP濃度の時間変化。振動して見えるのはcAMPの波が繰り返し発生されるため。
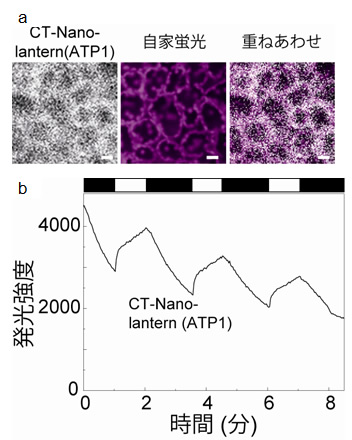
図6 機能性プローブNano-lantern(ATP1)を使った光合成によるATP産生のイメージング
- (a)植物用の葉緑体に局在するCT-Nano-lantern(ATP1)の生物発光像、植物葉の自家蛍光像とそれらの重ね合わせ像。重ね合わせ像を観ると、植物葉の自家蛍光は葉緑体に由来することがわかります。よって励起光が必要な蛍光プローブは葉緑体のイメージングに使用することは困難でした。
- (b)植物葉に間欠的に光照射する実験を行ったところ(グラフの白い帯の時に光照射を行いました)、光照射時にATP濃度の上昇が確認されました。これは葉緑体で光合成により産生されたATPであることがわかりました。
特記事項
研究成果は2012年12月11日(英国時間、日本時間12月12日)にネイチャー・パブリッシング・グループ(NPG)「Nature Communications」のオンライン速報版で公開されます。本研究はJST 戦略的創造研究推進事業・個人型研究(さきがけ)「光の利用と物質材料・生命機能」研究領域における研究課題「ナノサイズ高輝度バイオ光源の開発と生命機能計測への応用」などの助成によりなされたものです。
補足
ナノ-ランタンを発現する腺癌の細胞をICRマウスの体内に移植して撮影
<本件に関する問い合わせ先>
<研究内容に関すること>
永井 健治(ナガイ タケハル)
大阪大学 産業科学研究所 生体分子機能科学研究分野 教授
Tel:06-6879-8480 Fax:06-6875-5724
E-mail:
URL:https://www.sanken.osaka-u.ac.jp/labs/bse/
<JSTの事業に関すること>
木村 文治(キムラ フミハル)、古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3525 Fax:03-3222-2067