ポイント
- がんバイオマーカーには組織採取の困難さや前処理時間などの問題点がある
- 組織採取なしで簡便な、がんバイオマーカーのマウス生体内検出に成功
- 診断法への応用でがんの新たな治療法が期待される
JST 課題達成型基礎研究の一環として、慶應義塾大学 理工学部の栄長 泰明 教授は、慶應義塾大学 医学部の佐谷 秀行 教授らと共同で、針状に加工した導電性のダイヤモンドを電極(ダイヤモンド電極注1))として用いることで、がんのバイオマーカー注2)の1つである還元型グルタチオン(GSH)注3) の濃度をマウスの生体内で直接測定することに成功しました。
GSHは、がん細胞の治療抵抗性注4)に関わる重要なバイオマーカーであり、がん組織内における濃度や増減を知ることは治療の効果を判定する上で非常に有用であると期待されています。また、がん組織の中のGSH濃度が低ければ、薬剤や放射線治療の治療効果が上がることが動物実験で明らかになっています。そのため、人でもがん組織中のGSHが低下しているかどうかを見ることで、治療の効果を事前に推定できる可能性もあります。しかし、従来の方法では、がん組織を体内から採取する必要があるため、組織採取の困難さや前処理に時間がかかるなどの問題点があり、医療現場では使われていません。がん治療における有効性の検証や診断技術の開発に向け、生体内でGSH濃度を計測できる簡便な方法が期待されていました。
本研究グループは、ダイヤモンド電極を針状に加工し、直接がん組織に挿入することで、生体内のGSH濃度の変化を簡便に検出できる方法の開発に成功しました。
今後、放射線や化学療法などのがん治療においてGSH濃度をリアルタイムでモニタリングが可能となり治療効果の迅速な判定方法の開発が実現すれば、新しい「簡易かつ高感度な病態診断法」としての利用が期待されます。
本研究成果は、平成24年11月29日(英国時間)に英国オンライン科学誌「Scientific Reports」で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「元素戦略を基軸とする物質・材料の革新的機能の創出」
(研究総括:玉尾 皓平 理化学研究所 基幹研究所 所長/同研究所 グリーン未来物質創成研究領域 領域長)
|
| 研究課題名 |
「革新的環境改善材料としての導電性ダイヤモンドの機能開発」 |
| 研究代表者 |
栄長 泰明(慶應義塾大学 理工学部 教授) |
| 研究期間 |
平成23年4月~平成28年3月 |
JSTはこの領域で、持続可能な社会の構築のために解決すべき資源・エネルギー・環境問題に元素戦略を共通概念とする物質科学・物性科学の観点から取り組み、既存の延長線上にない物質・材料の革新的機能の創出を目指します。上記研究課題では、レアメタルフリーである炭素材料「導電性ダイヤモンド」に着目し、環境問題を解決する次世代の革新的環境改善材料としての機能開発、機能解明からデバイス創製までを目指します。
<研究の背景と経緯>
放射線や化学療法といった従来のがん治療の多くは、がん細胞内に活性酸素種を発生させることでがん細胞を死滅させ、治療効果をもたらすと考えられています。還元型グルタチオン(GSH)は、細胞傷害性のある活性酸素種を除去して細胞を保護する働きを持つ抗酸化物質として知られています。これまでの研究から、がん細胞は正常組織と比較して高濃度のGSHを持ち、がん治療によって発生した活性酸素種を速やかに除去してしまうため、がん治療に対して抵抗性を示すことが分かってきました。このことから、がん組織のGSH濃度変化を測定できる方法が開発されれば、放射線や化学療法などの治療の効果判定に役立てることができると考えられます。
しかしながら、従来の動物実験で行われてきたGSHの測定では、生体から組織を採取した後に前処理を行うため、測定までに時間がかかるという問題があります。さらに、専用の光学測定機器を使用する必要があるため、簡便にGSHの変化をモニターできる方法を開発することが期待されています。一方、これまでに研究グループは、ホウ素を含んだダイヤモンド(ダイヤモンド電極)を化学電極として用いたときに優れた特性を持つことを発見し、次世代の電気化学センサーとして期待できることを報告してきています。
<研究の内容>
本研究では、マイクロサイズに加工したダイヤモンド電極を作製し(図1)、これを用いて生体内で直接GSH濃度を測定する方法の確立を目指しました。
GSH、および酸化型グルタチオンの測定
酸化電位の高いGSHを電気化学的に酸化しようとすると、カーボン電極、白金電極などの通常の電極材料では酸素発生が優勢となり、GSH自身の酸化は観測されません。しかし、ダイヤモンド電極は、水が電気分解しにくい特徴を持つため、酸素発生が起こりにくく、2.0V以上の高い電位においてもGSHの酸化に起因する酸化電流を観測することができました。通常の電極材料では、このような高い電位では、酸素発生による電流値と重なってしまい、測定が不可能でありましたが、本研究では、2.3Vにおける電流値の濃度変化をモニターすると比例関係が得られ、GSH測定が可能であることが分かりました(図2)。
グルタチオンは、細胞内に還元型(GSH)と酸化型の2つの姿で存在し、酸化還元反応で互いに変換されています。このため、潜在的なGSH量の評価のためには、酸化型グルタチオン(GSSG)の量も測定する必要があります。GSSGをGSHと同様に測定したところ、GSHに比べて酸化電流の立ち上がりが、より高電位側に観測されましたが、やはり2.3Vにおける電流値の濃度変化をモニターすると比例関係が得られ、酸化型グルタチオンも測定が可能であることが分かりました。
さらに、GSHとGSSGの酸化電位が異なることを利用して、それらの分離検出ができることが分かりました。すなわち、酸化電位を1.3Vに固定すると、GSHでは酸化電流値が観測されるのに対し、GSSGでは酸化電流値が観測されない、ということが示されました(図3)。
生体内(in vivo)測定
マウスの皮下に作製したがん組織について、ダイヤモンドマイクロ電極を挿入し、1.3Vをかけたクロノアンペロメトリー注5)により酸化電流を測定しました。
具体的には、ヒト口扁平上皮のがん細胞(HSC-2細胞)をマウスの皮下に移植して作製したがん組織と、マウスの正常な皮下組織のそれぞれに電極を挿入し、両者を比較しました。マウスのがん組織における電流値は、健康なマウスに比べて、3体とも高い値を示し、がん組織が高いグルタチオン濃度を示すことが分かりました(図4)。
さらに、3体のうち2体には、これらがん組織に活性酸素種を発生する放射線を照射し、GSH濃度を測定しました。その結果、放射線照射を行わなかった1体については、グルタチオン濃度は変化せず、放射線照射を行ったマウスについては、その照射量に応じてGSH濃度の減少が観測されました(図5)。このことから、放射線照射後に発生する活性酸素種によりがん組織内のGSHが消費され減少したことが、ダイヤモンドマイクロ電極を用いたGSHの直接測定によって分かりました。
<今後の展開>
がん治療の効果判定に有用と期待される「GSH」濃度、並びに「GSH-GSSG比」が、がん組織中にて簡便に測定できることから、将来的には実際に患者におけるがん治療後の濃度動態がどのように変化するかを直接モニタリングし、治療効果判定や治療計画の立案に有用な診断法の1つとなることが期待されます。また、最近注目されている「がん幹細胞」と呼ばれるがん組織の大本になる細胞は、GSHを多く産生しているために、治療に抵抗性が高いことが分かっており、がんの再発や転移の起源となります。これらがん幹細胞の機能や存在や治療に対する効果を評価する意味でも、この測定法は極めて有用であると考えられます。
これまでの研究成果から、ダイヤモンドマイクロ電極は、材料としての安定性に優れ、炭素材料であることから生体適合性に優れています。さらにダイヤモンド構造により、電極表面で物質の吸着も抑えられるという特徴などもあり、次世代の生体計測に欠かせない材料となりえることが従来から期待されてきましたが、今回、このような生体における物質の直接測定に応用できる可能性を示すことができました。今後は、グルタチオンのみならず、医学生物学的に物質動態の測定が求められるその他の物質においても、ダイヤモンドマイクロ電極を用いた測定の可能性を探ることや、超高感度化を目指した電極設計を行っていくことで、さらに「簡易かつ高感度な病態診断法」の開発につながる可能性が期待されます。
<付記>
本研究は、佐谷 秀行 慶應義塾大学 医学部 教授(JST 戦略的創造研究推進事業 チーム型研究(CREST)「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」研究領域(研究総括:須田 年生 慶應義塾大学 医学部 教授)における研究課題「人工癌幹細胞を用いた分化制御異常解析と癌創薬研究」)との共同研究で行われました。
<参考図>

図1 ダイヤモンドマイクロ電極
電極の先端の直径は、約20マイクロメートル(μm:100万分の1m)。
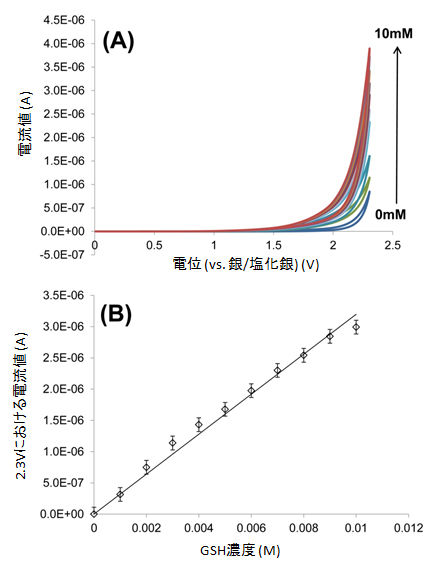
図2 GSH濃度測定
GSH濃度を変化させた際のサイクリックボルタモグラム(A)と、それぞれの濃度における電流値の検量線。2.3Vにおける電流値をプロットしたもの(B)。0~10mMの範囲で良好な検量線が得られている。
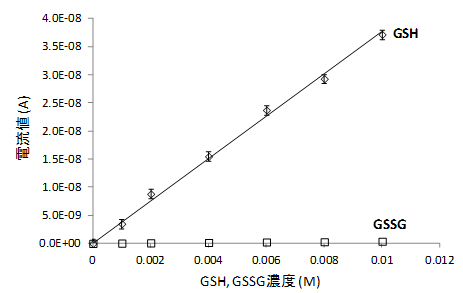
図3 GSHの選択的な測定
1.3Vをかけた場合のそれぞれの電流値のプロット。酸化型グルタチオン(GSSG)は電流値が観測されないが、還元型グルタチオン(GSH)では良好な検量線が得られている。この電位ではGSHを選択的に測定できていることが分かる。
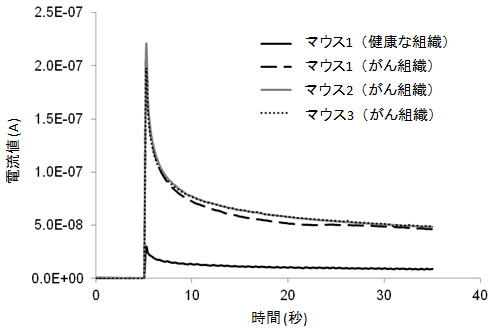
図4 生体内におけるクロノアンペロメトリー測定
1.3Vをかけた後の電流値をモニターしたもの。がん組織では、健康な組織に比べ、GSH濃度が高いことが分かる。
ヌードマウスの皮下にヒト口腔内がん細胞を100万個移植し、2週間後に増殖した腫瘍組織と、周辺の健康な組織の中のGSH濃度を腫瘍内あるいは正常組織内に針を刺入することで測定した。
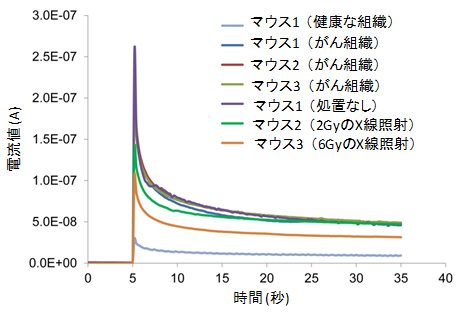
図5 マウスのがんに放射線を照射した際のがん組織内GSH濃度の変化
放射線の線量依存的にがん組織のGSH濃度の減少が認められた。
ヌードマウスの皮下にヒト口腔内がん細胞を100万個移植し、2週間後に増殖した腫瘍を持つマウスに放射線(2Gyあるいは6Gy)を照射し、3時間後に照射した腫瘍組織、照射しなかった腫瘍組織、および周辺の健康な組織の中のGSH濃度を組織内に針を刺入することで測定した。放射線の照射線量依存性に腫瘍組織内のGSH濃度の減少が認められ、放射線照射によって組織内の酸化ストレスが上昇し、GSHが消費されたことを測定することができた。
<用語解説>
- 注1) ダイヤモンド電極
- 本来絶縁体であるダイヤモンドに、不純物としてホウ素を添加することで導電性を付与し、これを電極として利用したもの。電極材料として従来利用されている炭素電極、白金電極などに比較して、水溶液中での電位窓が広い、バックグラウンド電流が小さいなどの優れた電気化学特性を持つため、センサー、水処理をはじめとした応用が期待されている。耐久性など、ダイヤモンド本来の物理化学特性も兼ね備えるため、次世代の新しい電極材料として期待されている。
- 注2) がんバイオマーカー
- がん細胞の存在や治療に対する抵抗性などを評価することのできる客観的指標のこと。バイオマーカーによって、治療法の選択や効果の判定を迅速かつ正確に知ることができ、そのような有用なバイオマーカーを見いだすことは新たな薬剤の開発と同様に極めて重要である。
- 注3) グルタチオン(GSH)
- グルタミン酸、システイン、グリシンの3つのアミノ酸が結合したトリペプチドであり、生体内で抗酸化作用を担う主たる分子である。
- 注4) 治療抵抗性
- がんに対して抗がん剤や放射線を用いて治療を行ったときに、これらの治療に対して反応しない、つまり殺すことのできないがん細胞が存在することがある。この性質を治療抵抗性と呼ぶ。
- 注5) クロノアンペロメトリー
- 測定対象物質が酸化する一定電位を加え、その際に流れる電流値の時間変化をモニターする方法。ここでは、一定電流を示すときの電流値がグルタチオン濃度を反映している。
<論文タイトル>
“In vivo assessment of cancerous tumors using boron doped diamond microelectrode”
(ダイヤモンドマイクロ電極を用いた生体内におけるがん評価の方法)
doi: 10.1038/srep00901
<お問い合わせ先>
<研究に関すること>
栄長 泰明(エイナガ ヤスアキ)
慶應義塾大学 理工学部 教授
〒223-8522 神奈川県横浜市港北区日吉3-14-1
Tel:045-566-1704 Fax:045-566-1697
E-mail:
渡辺 剛志(ワタナベ タケシ)
慶應義塾大学 理工学部 助教
〒223-8522 神奈川県横浜市港北区日吉3-14-1
Tel:045-563-1151(+内線42935) Fax:045-566-1697
E-mail:
<JSTの事業に関すること>
古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail: