ポイント
- くすり開発の重要な標的分子であるGタンパク質共役型受容体に関して、新しい活性化検出法を開発
- 既存の手法を大幅に上回る検出効率であることを実証
- 3種類のGタンパク質共役型受容体について、活性化分子を初めて同定
- 新しいくすり開発の効率化へ期待
くすりの大半は
Gタンパク質共役型受容体(GPCR)注1)に作用して効果を発揮します。そのため、GPCRの活性化を効率的に測定することは、新たなくすりの開発への近道となります。今回、東北大学 大学院薬学研究科の青木 淳賢 教授、井上 飛鳥 助手、巻出 久美子 助教、東京大学 大学院薬学系研究科の新井 洋由 教授、大和田 智彦 教授、愛媛大学 プロテオ医学研究センターの東山 繁樹 教授は、GPCRの活性化を検出する新規手法を共同で開発しました。本手法を用いると116種のリガンド既知のGPCRのうち104種類(約90%、検出率として世界最高値)の活性化を測定可能でした。さらに、開発した手法を用いて、生理活性脂質リゾホスファチジルセリン注2)に対する3つの受容体P2Y10、GPR174、A630033H20の発見に成功しました。本研究成果は、創薬開発の効率化に貢献するとともに、生理活性脂質リゾホスファチジルセリンの機能に関する研究の発展を確約するものとして注目されます。本研究成果は、米国の学術雑誌「Nature Methods」の10月号に掲載されます。
本研究は、独立行政法人 科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究領域(研究総括:宮坂 昌之 大阪大学 未来戦略機構 特任教授)における研究課題「慢性炎症による疾患発症機構の構造基盤」(研究代表者:濡木 理 東京大学 大学院理学系研究科 教授、研究期間:2011年度~2015年度)、医薬基盤研究所「保健医療分野における基礎研究推進事業」、科学研究費補助金の外部資金支援を受けて行われたものです。
<背景>
細胞は外界との情報の受け渡しをさまざまな分子を介して行います。細胞外からの情報を受け取るタンパク質は受容体と呼ばれ、その中でもGPCRと呼ばれる一群の受容体が最も重要な役割を担うことがわかっています。GPCRは全タンパク質の中で最大の遺伝子ファミリーを形成しており、ヒトゲノム中には800種類以上ものGPCRが存在しています。GPCRは細胞膜上に存在し、細胞外から運ばれてくるホルモンや成長因子などと結合し、細胞内へ信号(シグナル)を伝えています。また、GPCRの機能の異常は多くの疾患を引き起こすことがわかっています。病態時のGPCRの機能異常を正すことは、病気の治療につながります。実際、GPCRを標的としたくすりは数多く開発が成功しており、現在市販されているくすりの半数近くにものぼります。従って、GPCRの機能を理解することは、創薬開発の近道であると言えます。
GPCRの役割は細胞外の結合分子(リガンド)の量を感知して、細胞内へシグナルを伝えることです。GPCRはリガンドと結合すると構造変化(活性化)を起こし、三量体Gタンパク質注3)と呼ばれる細胞内タンパク質を呼び寄せ、さまざまな下流のシグナルを誘導します。三量体Gタンパク質はGs、Gi、Gq、G12/13の4種類に大別され、それぞれの下流では、サイクリックAMP濃度の変動(Gs、Gi)、細胞内カルシウム濃度の変動(Gq)、低分子量Gタンパク質RhoへのGTP結合(G12/13)が起こります。このような細胞内イベントを検出することで、GPCRの活性化を測定することができます。しかし、GPCRは通常1種類か2種類の三量体Gタンパク質としか結合(共役とも呼ばれます)しないことから、特定の細胞内イベントを観察するだけでは、多くても半数程度のGPCRの活性化しか検出することができません。そこで、多くのGPCRの活性化を同一の方法で検出できるような新規GPCR活性化測定法が期待されていました。特に、G12/13の下流での細胞内シグナルを定量的に検出する手法の開発は遅れており、G12/13と結合するGPCRの機能を解明する上で大きな障害となっていました。
青木 淳賢 教授と井上 飛鳥 助手は以前の研究成果(EMBO J. 30, 4248-4260(2011))において、毛の成長に生理活性脂質リゾホスファチジン酸とその受容体(LPA6、GPCRの1種)が必須の役割を果たしていることを見出しました。LPA6の下流の分子機構を詳細に調べたところ、毛根の上皮細胞においてTACE注4)と呼ばれる膜型タンパク質分解酵素が活性化し、トランスフォーミンング増殖因子α(TGFα)注5)の膜結合前駆体を切断し、細胞外へ放出するという現象がわかりました。そして、このLPA6-TACE-TGFαの経路が、正常な毛根の成長に必須であることを発見しました。この研究過程から、TACEによるTGFαの切断という現象を培養細胞中で再現することで、ある種のGPCRの活性化が検出可能になるのではないかと想定しました。
<今回の発見>
青木 淳賢 教授と井上 飛鳥 助手は上述の背景を受け、TACEによるTGFαの切断がGPCRの下流で普遍的に起こる現象かどうか検討しました。まず、リガンドが既に知られている116種類のGPCRとそのリガンドの組み合せで調べました。ヒト腎臓由来の細胞株であるHEK293細胞にGPCRをコードする遺伝子とアルカリホスファターゼ融合TGFα(AP-TGFα、愛媛大学 東山 繁樹 教授が確立)をコードする遺伝子をリポフェクション法注6)で導入し、この細胞をそれぞれのGPCRのリガンドで刺激した後に、細胞外へのAP-TGFαの放出量を評価しました。その結果、実に7割ものGPCRの活性化が本法(TGFα切断アッセイ、TGFα shedding assay(図1)と命名)で検出できることがわかりました。また、TGFα切断を引き起こしたGPCRの特徴を調べると、GqまたはG12/13と共役するGPCRであることがわかりました。そこで、GsやGiのシグナルをそれぞれGqやG12/13のシグナルに変換することのできるキメラGタンパク質注7)を導入したところ、116種類のGPCRのうち104種類のGPCRの活性化を検出することに成功しました。このようにTGFα切断アッセイは90%以上のGPCRについて活性化を検出し、この割合は既存の手法を大きく超えることから本法の有用性が示されました。また、本法は作動薬や遮断薬注8)の反応を検出できるだけでなく、創薬に最も有効であると考えられている逆作動薬注8)の検出にも有効でした。
また、本手法を用いリガンド未知のオーファンGPCR注9)のリガンド探索を行いました。その結果、3つのGPCR(P2Y10、GPR174、A630033H20)が生理活性脂質のリゾホスファチジルセリンに応答することを発見しました(図2)。これらの受容体はいずれもG12/13に共役すること、リゾホスファチジルセリンの構造類似体(東京大学の大和田 智彦 教授、新井 洋由 教授により有機合成)の反応性からリゾホスファチジルセリンの構造を厳密に認識する受容体であることが判明しました。リゾホスファチジルセリンは、リンパ球の増殖抑制やマスト細胞の活性化などの作用が知られており、これら3つのGPCRの研究を通じて生体内の新たな生理活性物質の解明が進むことが期待されます。
<意義>
これまで、G12/13と共役するGPCRは活性化の検出が困難であり、作動薬、遮断薬の開発が遅れていました。本研究で開発されたTGFα切断アッセイを用いることで、これまで困難であったG12/13と共役するGPCRに対する創薬が一気に加速化されるものと期待されます。また、本手法はオーファンGPCRのリガンド同定や、リガンドの作用様式の評価に極めて有効であり、新規創薬への貢献が大いに期待されます。今回、リゾホスファチジルセリンに反応するGPCRを複数発見したことで、未解明な点が多く残るこの生理活性脂質の研究が加速することが期待されます。
<参考図>
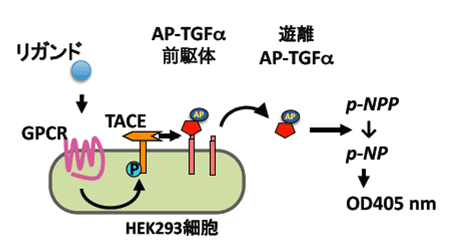
図1 新規GPCR活性化検出法
TGFαshedding assayの原理
本法ではHEK293細胞にGPCR、アルカリホスファターゼ(AP)標識TGFα前駆体、(+キメラGタンパク質)を発現させ、リガント刺激後1時間中に細胞外に遊離したTGFα量をAP活性を指標に検出する。
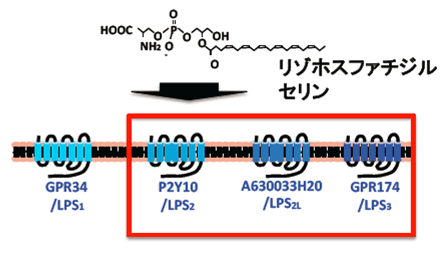
図2 同定された新規リゾホスファチジルセリン受容体
TGFα shedding assayを用い、リゾホスファチジルセリン応答性GPCRを探索し、P2Y10,A630033H20,GPR174の3つの新規GPCRを同定し、それぞれ、LPS2,LPS2L,LPS3と命名した。
<用語解説>
- 注1) GPCR:Gタンパク質共役型受容体(G protein-coupled receptor)
- 細胞膜上に存在する受容体で、細胞膜を7回貫通する特徴的な構造を有しており、7回膜貫通型受容体とも呼ばれています。これまでに開発されたくすりの大半がGPCRと結合して作用を発揮することから、現在も創薬の重要標的分子として盛んに研究されています。ヒトにおいては800種類以上存在し、そのうち構造や発現部位から約280種類が創薬標的の候補と考えられています。
- 注2) リゾホスファチジルセリン:生理活性脂質の一種
- リンパ球の増殖抑制、マスト細胞の活性化などの作用を持つ生理活性脂質です。いつどこで産生されて、どの受容体を介して機能しているかなど、未解明な点が多く残されていました。今回の3つの受容体の発見から、特に免疫系での機能が着目されます。
- 注3) 三量体Gタンパク質:Gα、Gβ、Gγの3つのサブユニットタンパク質の複合体
- 三量体Gタンパク質は活性化GPCR(リガンド結合による構造変化)と結合し、GDP結合型からGTP結合型に変化する。GTP結合型の三量体Gタンパク質は活性化型と呼ばれ、各種の細胞内シグナルを誘導します。複合体のうち、Gαが最も重要でGPCRとの結合や下流に伝えるシグナルの種類を決めます。伝えるシグナルの種類とアミノ酸配列の相同性から、三量体Gタンパク質はGs、Gi、Gq、G12/13の4種類に分類され、それぞれGαs、Gαi、Gαq、Gα12/13サブユニットを含みます。
- 注4) TACE:腫瘍壊死因子変換酵素(Tumor necrosis factor-α-converting enzyme)
- 膜結合型のタンパク質分解酵素で、膜タンパク質の細胞外部分を切断します。さまざまなタンパク質がTACEにより切断されることが知られていますが、そのうちの1つがTGFαです。
- 注5) TGFα:トラスフォーミンング増殖因子α(Transforming growth factor-α)
- 上皮成長因子受容体(EGFR)のリガンドの1つです。1回膜貫通型の前駆体タンパク質として産生されます。TACEにより切断され、細胞外部分が放出されます。今回使用したAP-TGFαは細胞外領域にアルカリホスファターゼ(Alkaline Phosphatase)を融合するように設計した改変型TGFαで、放出されたTGFαはアルカリホスファターゼの活性を指標に簡便に測定することができます。
- 注6) リポフェクション法:遺伝子導入の一手法
- リポソームと呼ばれる脂質と遺伝子の入ったプラスミドベクターとの混合液を細
胞にかけると、目的の遺伝子を細胞に導入することができます。細胞内で遺伝子からタンパク質が作られます。今回のTGFα切断アッセイでは、複数種類のプラスミドベクター(AP-TGFα、GPCR、キメラGタンパク質)を同時に細胞に導入します。
- 注7) キメラGタンパク質:Gαサブユニットを改変した三量体Gタンパク質
- Gαタンパク質のカルボキシル末端(C末)側部分がGPCRとの結合を担います。Gαタンパク質のC末側の6アミノ酸残基を他のGαタンパク質と交換することで、下流に伝えるシグナルは変えずに、GPCRとの結合を変化させることができます。例えば、Gαqの骨格とGαsのC末を持つキメラGタンパク質を用いると、通常はGsに共役しているGPCRのシグナルをGqに変換することができます。
- 注8) 作動薬、遮断薬、逆作動薬:リガンドの作用形式の分類
- 作動薬(アゴニスト)はGPCRに対して活性化する薬剤です。遮断薬(アンタゴニスト)と逆作動薬(インバースアゴニスト)はGPCRの活性化を抑えます。逆作動薬はGPCRを不活性型に構造変化させることができ、市販されている薬剤の多くは遮断薬ではなく逆作動薬であることが知られています。
- 注9) オーファンGPCR:孤児Gタンパク質共役型受容体
- リガンドが不明なGPCRの総称で、現在約80種類存在します。リガンドを同定することが、生体内の役割を解明する第一歩となります。しかし、多くの場合どの三量体Gタンパク質と共役するか不明なため、GPCR検出系を複数用意する必要があります。今回確立したTGFα切断アッセイを用いることで、効率的にオーファンGPCRのリガンド同定を行うことができると期待されます。
<論文目録>
論文タイトル:TGFα shedding assay: an accurate and versatile method for detecting GPCR activation
(TGFα切断を用いた正確かつ汎用性の高いGPCR活性化測定法の確立)
雑誌名:Nature Methods
電子版2012年9月16日(現地時間)、冊子版2012年10月号
doi: 10.1038/NMETH.2172
<お問い合わせ先>
<研究に関すること>
青木 淳賢(アオキ ジュンケン)
東北大学 大学院薬学研究科 分子細胞生化学分野 教授
Tel:022-795-6860
E-mail:
井上 飛鳥(イノウエ アスカ)
東北大学 大学院薬学研究科 分子細胞生化学分野 助手
Tel:022-795-6861
E-mail:
<JSTの事業に関すること>
石井 哲也(イシイ テツヤ)
科学技術振興機構 戦略研究推進部
Tel:03-3512-3524
E-mail: