ポイント
- 疾病や感染の超早期診断や低負担検査には、従来のELISA法の高感度化が必要
- 超微小水滴中で反応させる「1分子デジタルELISA法」で検出感度が従来法の100万倍向上
- 高感度で、手のひらサイズのポータブル診断デバイスの開発に期待
JST 課題達成型基礎研究の一環として、東京大学 大学院工学系研究科 応用化学専攻の野地 博行 教授らは、疾病・感染バイオマーカーの検出感度を従来法の100万倍向上する方法を開発しました。
がんや神経疾病などの現代病やウイルス、細菌の感染に対する超早期診断や低負担検査を実現するためには、迅速かつ定量的な超高感度バイオセンシング技術を確立する必要があります。疾病や感染のバイオマーカー検出で汎用されている手法は酵素結合免疫吸着法(ELISA法)注1)ですが、その検出感度は数10pg/mL(ピコグラムは1012分の1g)程度であり不十分でした。
本研究グループは検出感度向上のため、1cm2に100万個の微小水滴を同時形成する超高密度微小水滴アレイデバイス(1分子デジタル計数デバイス)を開発し、これを用いた「1分子デジタルELISA法」を確立しました。具体的には、マイクロビーズ(微粒子)の表面に捕捉抗体をつけて、そこに検出するたんぱく質などのバイオマーカーと蛍光用の抗体の3つの複合体を形成させます。その後、この複合体をマイクロビーズの100万個の超微小水滴に閉じ込めて酵素(蛍光)反応を行うことで、反応生成物が濃縮され高感度で検出できます。その結果、バイオマーカーを1分子レベルで迅速に検出することが可能になりました。感度評価によく使われる前立腺腫瘍マーカーで、「1分子デジタルELISA法」を用いたところ検出下限値は、60ag/mL(アトグラムは1018分の1g)であり、従来のELISA法と比較して検出下限値が100万倍向上しました。さらに、今回開発したデバイスはコンパクトで使用方法も簡便であり、手のひらサイズのポータブル診断デバイスの開発につながると考えられます。
本研究は、東京大学 大学院工学系研究科 応用化学専攻の金 秀炫 研究員、飯野 亮太 講師と共同で行ったものです。本研究成果は、近日中に英国王立化学会の科学誌「Lab on a chip」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「プロセスインテグレーションによる機能発現ナノシステムの創製」
(研究総括:曽根 純一 物質・材料研究機構 理事) |
| 研究課題名 |
「生体分子1分子デジタル計数デバイスの開発」 |
| 研究代表者 |
野地 博行(東京大学 大学院工学系研究科 教授) |
| 研究期間 |
平成22年10月~平成28年3月 |
JSTはこの領域で、革新的な機能を発現する次世代ナノシステムの創製を目指すものです。上記研究課題では、「生体分子1分子デジタル計数法」を確立します。
<研究の背景と経緯>
がん、神経疾病などの現代病、およびウイルス、細菌の感染に対する超早期診断を実現するためには、迅速かつ定量的な超高感度バイオセンシング技術を確立する必要があります。現在、疾病や感染などのバイオマーカー検出で汎用されている手法は、酵素結合免疫吸着法(ELISA法)です。しかし、従来のELISA法の反応体積は数100μL(マイクロリットルは106分の1L)で酵素反応の生成物が希釈されるため、検出感度は数10pg/mL(ピコグラムは1012分の1g)程度でしかなく、超早期診断には不十分でした。また、尿や唾液など患者にとって摂取負担の低い検体を用いた検査も求められていますが、血液に比べバイオマーカーの濃度が非常に低いため、さらに高い検出感度が必要でした。
<研究の内容>
疾病や感染の超早期診断や低負担検査を可能にするため、研究チームは今回、ELISA法の超高感度化に取り組みました。具体的には、ELISA反応を微小な体積の液体中で行うことで酵素反応生成物の濃度を大幅に増加させて、1分子のバイオマーカーからの信号を2値化して検出可能にすることで、劇的な検出感度の向上に成功しました。
まず、1cm2に100万個の微小水滴を同時に形成する超高密度微小水滴アレイデバイス(1分子デジタル計数デバイス、図1)を開発しました。このデバイス表面には疎水性・親水性のマイクロパターン加工がなされており、水、油の順番で液体を流すだけで、フェムトリットル(1015分の1リットル)の微小な水滴を100万個同時に形成することができます。さらに、水中にマイクロビーズを懸濁させておくと、水滴形成と同時にマイクロビーズを閉じ込めることもできます。
次にこのデバイスを用い、「1分子デジタルELISA法」を確立しました(図2)。まず、捕捉抗体で表面修飾したマイクロビーズにバイオマーカーおよび酵素標識検出抗体を結合させ、捕捉抗体-バイオマーカー-酵素標識検出抗体の3つの複合体を形成させます。バイオマーカーの濃度が非常に低い場合、個々のマイクロビーズは3つの複合体を1分子のみ結合しているか、全く結合していないかのどちらかになります。その後、マイクロビーズを微小水滴に閉じ込めることで、3つの複合体に含まれる酵素1分子の触媒反応によって生成する蛍光色素を蛍光顕微鏡で観察可能にしました(図3)。3つの複合体を結合したマイクロビーズを含む水滴のみが蛍光を発するので、蛍光信号を発する水滴の数としてバイオマーカー分子の数をカウントすることで、超高感度な検出を可能にしました。さらに、信号を0か1に2値化してカウントするので、測定誤差の影響を低減でき再現性の良い結果が得られます。ELISA法の感度評価によく使われる前立腺腫瘍マーカーの1分子デジタルELISA法における検出下限値は、60ag/mL(アトグラムは1018分の1g)に達しました。これは、1mLの検体中にわずか1200分子のマーカーが存在することに相当し、従来のELISA法と比較して検出下限値を100万倍向上させることに成功しました(図4)。
「1分子デジタルELISA法」は、前立腺腫瘍マーカーのみならず他のバイオマーカーへの応用も可能であり、疾病や感染の超早期診断に使用されることが期待されます。例えば、がん摘出後の再発や転移の超早期検出が可能になると考えられます。また、従来のELISA法では検出が困難であったアルツハイマー病のバイオマーカーが脳脊髄液や血液中から検出可能になり、超早期診断が可能になると期待されます。さらに超高感度であるため、ウイルス性肝炎などは、従来の血液を用いた検査ではなく、患者にとってより摂取負担の少ない尿や唾液などの検体を用いた検査が可能になると期待されます。
<今後の展開>
今回開発したデバイスは、コンパクトで使用方法も簡便です。最近「患者の身近での検査」が注目されていますが、大きな総合病院や検査機関だけでなく街中の医院でも導入可能な、手のひらサイズのポータブル診断デバイスとして期待されます。本成果は特許出願済みであり、今後は実用化を希望する企業との研究開発を進めていく予定です。
<付記>
本研究成果の一部は、野地 博行 教授が大阪大学在籍時に、大阪大学 大学院生命機能研究科 修士課程(当時)の岩井 信乃 氏、新木 卓 氏と共同で行ったものです。
<参考図>
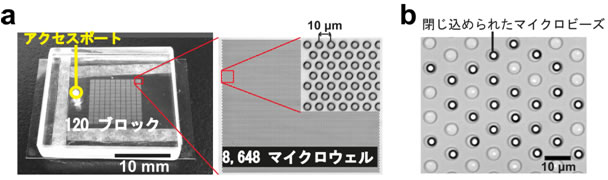
図1 1分子デジタル計数デバイスの写真
100万個の超微小水滴を同時に形成させ(a)、マイクロビーズを閉じ込める(b)。
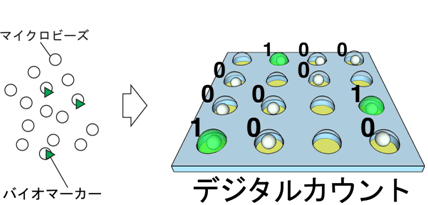
図2 1分子デジタルELISA法
バイオマーカーを結合したマイクロビーズの数をカウントする。

図3 1分子デジタル計数デバイスによる前立腺腫瘍マーカーの検出例
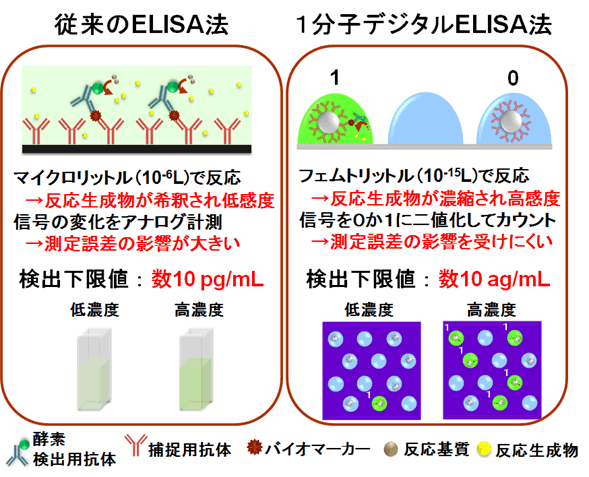
図4 従来のELISA法と1分子デジタルELISA法の比較
従来のELISA法ではマイクロリットルの液体中で酵素反応を行い、信号変化をアナログに測定しバイオマーカーの濃度を決定します。一方、1分子デジタルELISA法ではフェムトリットルの液体中で反応を行い、2値化した信号を1分子ごとにカウントしバイオマーカーの濃度を決定します。これらにより、高感度かつ測定誤差の影響を受けにくい測定が可能になります。
<用語解説>
- 注1) 酵素結合免疫吸着法(ELISA法)
- 特異性の高い抗原抗体反応でバイオマーカーなどのターゲット分子を捕捉し、抗体に結合させた酵素の触媒反応による発色・発光を用いて検出する方法。
<論文タイトル>
“Large-scale femtoliter droplet array for digital counting of single biomolecules”
(大規模なフェムトリッター水滴アレイを用いた生体分子1分子デジタル計数法)
doi: 10.1039/C2LC40632B
<お問い合わせ先>
<研究に関すること>
飯野 亮太(イイノ リョウタ)
東京大学 大学院工学系研究科 応用化学専攻 講師
〒113-8656 東京都文京区本郷7-3-1
Tel:03-5841-7252 Fax:03-5841-1872
E-mail:
<JSTの事業に関すること>
古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail: