慶應義塾大学 医学部 の家田 真樹 特任講師、稲川 浩平 助教、福田 恵一 教授らの研究グループは、心筋梗塞モデルマウスの心臓に3つの心筋誘導遺伝子注1)を導入し、梗塞巣の心臓線維芽細胞注2)を直接心筋細胞に転換することに成功しました。本方法は心臓内の心筋以外の細胞“心臓線維芽細胞”に心筋誘導遺伝子を導入し、iPS細胞注3)のような多能性幹細胞を経ず、生体内で直接心筋細胞を作製する新しい心臓再生法注4)です。将来、心筋梗塞注5)をはじめとするさまざまな心臓疾患に対する新しい再生医療の方法として期待されます。
本研究過程で同様の心筋誘導因子を用いて生体内で心筋細胞を直接作製できたという結果が、本年4月と5月に欧米の2つの研究グループから報告されました。本研究グループは、それらの報告とは異なる新しいシステムで3つの遺伝子を同時に導入できる方法を構築し、成熟した心筋細胞の作製効率を2倍に改善することに成功しました。
この方法は(1)線維芽細胞から直接心筋細胞のみを作製できる、(2)細胞移植の必要がない、(3)癌化のリスクがない、など大きな利点があり、これまでの再生医療の課題を解決することが期待されます。この研究結果は心臓再生医療の方法として有望なだけでなく、他臓器の再生にも応用が期待できる結果であり、再生医療の実現化という臨床目標に向け大きな成果であるといえます。
本研究は、JST 戦略的創造研究推進事業 チーム型研究(CREST)の一環として行われ、2012年8月29日(水)午前5時(日本時間)に米国科学雑誌「Circulation Research」 オンライン版に公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究総括:須田 年生 慶應義塾大学 医学部 教授) |
| 研究課題名 |
「直接リプログラミングによる心筋細胞誘導の確立と臨床への応用」 |
| 研究代表者 |
家田 真樹(慶應義塾大学 医学部 特任講師) |
| 研究期間 |
平成22年10月~28年3月 |
JSTはこの領域で、iPS細胞を基軸とした細胞リプログラミング技術の開発に基づき、その技術の高度化・簡便化をはじめとした研究によって、革新的医療に資する基盤技術の構築を目指している。上記研究課題では、心臓線維芽細胞から心筋細胞への直接分化転換の効率改善、分子機構解明をすすめ、最終的には臨床応用を目指している。
1.研究の要旨
心筋梗塞などの心臓病では心筋細胞が失われますが、ヒトを含む哺乳類では失われた心筋細胞を元に戻す自己再生能力を持っていません。梗塞部位など心筋が消失した部分は心臓内にある線維芽細胞が増殖し線維化により置き換えられますが、この細胞は拍動できないため心臓ポンプ機能が低下します。そのため従来の心臓再生の方法としては、ES細胞やiPS細胞のように成体を形成するすべての細胞へと分化できる幹細胞をまず培養皿上で作製し、次に心筋細胞を誘導し、患部へと移植する方法が期待されています。一方で、倫理的な問題、幹細胞による癌化の危険性、拍動している心臓へ移植した細胞の長期生着の困難さなどが指摘されています。
こうした問題点は、患者さんの心筋梗塞部位の心臓線維芽細胞を、幹細胞を経ず直接心筋細胞に転換出来れば回避できる可能性があります。2010年に家田特任講師らは心筋細胞を直接誘導できる遺伝子として3つの遺伝子(Gata4、Mef2c、Tbx5)を同定し、この3つの心筋誘導遺伝子を培養皿上のマウスの線維芽細胞に同時に導入することでiPS細胞を経ることなく心筋細胞を直接作製することに成功しました注6)。しかし生体内に直接心筋誘導遺伝子を導入するだけで心筋梗塞部位の線維芽細胞を心筋細胞へ転換できるかは不明でした。
今回の研究で家田特任講師らは、3つの心筋誘導遺伝子(Gata4、Mef2c、Tbx5)をレトロウイルスベクター注7)という遺伝子の運び屋を用いて、心筋梗塞モデルマウスの梗塞部位の線維芽細胞に導入し、マウス生体内で線維芽細胞から心筋細胞を直接作製することに成功しました。また新生心筋細胞の成熟度を上げるため、3つの心筋誘導遺伝子を1つにまとめた新しいウイルスベクターを作製し、遺伝子をそれぞれ別のウイルスベクターで導入した場合と比較して、成熟心筋細胞の誘導効率を2倍改善することに成功しました。
今回の研究により、培養皿上ではなくマウスの生体内において、心筋誘導因子を導入するだけで心臓内線維芽細胞から直接心筋細胞を作製できることが示されました。本方法は、従来の多能性幹細胞を用いた心筋細胞を移植する方法と比較して、手技がシンプルで細胞移植の必要がなく癌化のリスクもないなどの利点があります。心臓の中の心筋以外の細胞“心臓線維芽細胞”から心筋細胞を直接体内で作製するという本方法は心臓再生研究におけるパラダイムシフトであり、再生医療の実現化という目標に向け大きな成果であるといえます。
2.研究の背景
再生能力がない心臓では心筋梗塞、拡張型心筋症で心筋細胞が失われると、その部分は心臓内にある線維芽細胞の増殖、線維化により置き換えられ心臓ポンプ機能が低下します。ES細胞やiPS細胞のような多能性幹細胞は高い増殖能とさまざまな細胞に分化できる多能性を持ち、幹細胞を用いた細胞移植治療が臓器再生の方法として期待されています。しかし幹細胞を用いた心臓病への細胞移植治療の課題として、幹細胞の心筋細胞への分化誘導効率が低いこと、分化誘導後に得られる細胞の中に目的外の細胞や未分化な細胞が残存している可能性、このような細胞群を体内に移植した場合の癌化の危険性などがあります。また心臓へ移植後の細胞の長期生着は困難であり、臨床応用にはまだいくつかのハードルがあるとされています。
そこで家田特任講師らは幹細胞を使うこれまでの心臓再生法とは異なるアプローチとして、心臓の中に存在する心筋以外の細胞“心臓線維芽細胞”を心筋再生の細胞源として使えないかと考えました。細胞数では心臓を構成する細胞のうち心筋細胞は全体の30%程度で、残り70%近くはポンプ機能を持たない心臓線維芽細胞で占められています。また心筋梗塞、心不全などの病気では心筋細胞が減少し、この心臓線維芽細胞がさらに増殖し、線維化、心不全を悪化させます。心臓内に多数存在するこうした線維芽細胞を心筋細胞へと直接転換することができれば、幹細胞使用による上記の問題点を回避できる可能性があります。本研究に先駆け、2010年に家田特任講師らは心筋細胞を作り出すために必要な「心筋誘導遺伝子」(iPS細胞を樹立するときの「山中ファクター」にあたる)として、3つの遺伝子(Gata4、Mef2c、Tbx5)を同定しました。この3つの遺伝子を培養皿上のマウス線維芽細胞に導入すると、線維芽細胞はiPS細胞を経ることなく直接心筋細胞に転換できることを見出しました(図1)。しかし生体内に心筋誘導遺伝子を導入するだけで、心臓内の線維芽細胞をその場で心筋細胞へと転換できるかは不明でした。
3.研究の概要と成果
本研究で稲川助教、家田特任講師らはマウスを用い、心臓に心筋誘導遺伝子を導入して、心臓線維芽細胞から直接心筋細胞を作製できるか検討しました。方法としてまず心臓の栄養血管である冠動脈を結紮(けっさつ:糸で冠動脈を結び血流を遮断)し、マウス心筋梗塞モデルを作製しました。冠動脈結紮当日(心筋梗塞発症日)に、開胸下で注射器を用いレトロウイルスベクターにより遺伝子導入を行いました。最初に陰性対照のウイルス液を導入したところ、線維芽細胞から心筋細胞の誘導は見られませんでした。次に3つの心筋誘導遺伝子(Gata4、Mef2c、Tbx5)のウイルス液をそれぞれ100倍に濃縮し組み合わせて、計30μl(0.03ml)を心筋梗塞患部に直接注射しました。その結果、梗塞部の線維芽細胞のうち1週後に約3%の細胞で心筋遺伝子が誘導され、2週後に1%の細胞で心筋タンパク質の発現が見られました。心筋の成熟を表す横紋構造は、心筋タンパク質を発現した細胞の15%に見られました。本研究過程で、同様の方法で心筋誘導因子を用いて生体内で心筋細胞を直接作製できたという結果が、本年4月と5月に欧米2つの研究グループから報告されました注8)。そこで家田特任講師らは、さらに新生心筋細胞の成熟度を改善するため、3つの遺伝子を同時に導入できるポリシストロニックウイルスベクター注9)を開発しました。このウイルス液30μlをマウス心筋梗塞患部に注射したところ、心筋タンパク質を発現した新生心筋細胞のうち30%で横紋構造を確認でき、3つの遺伝子を別々のウイルスベクターで導入した場合と比較し成熟心筋の誘導効率を2倍に改善することに成功しました。
本研究結果より、Gata4、Mef2c、Tbx5という3つの遺伝子を効率よく導入することで、生体内でも心筋梗塞部位の線維芽細胞から心筋細胞を直接作製できることがわかりました。生体内で心筋を直接再生するという本技術はこれまでにない新しい心臓再生法であり、他臓器の再生でも応用できる可能性があります。以上より本研究結果は臨床上、再生医療実現化の端緒となる重要な知見を示すものと考えます。
4.今後の展開
今回の発見により心臓患部に直接遺伝子を導入するだけで生体内の心臓線維芽細胞から直接心筋細胞を作製できることがわかりました。この技術は従来の線維芽細胞からiPS細胞を作製し、それから心筋を誘導し、さらに心筋を分離精製したのち患部に移植するというこれまでの心臓再生の工程を短縮単純化しました。また幹細胞使用に関わる特有の問題点も解決することが期待されます。遺伝子導入や心筋誘導効率の改善、ヒトでの安全性など課題もありますが、本研究結果は心臓再生医療実現を前進させる大きな一歩であると考えられます(図2)。
5.論文名
“Induction of Cardiomyocyte-like Cells in Infarct Hearts by Gene Transfer of Gata4, Mef2c, and Tbx5”
「心筋梗塞部位に心筋誘導因子を導入し、心臓内の線維芽細胞から直接心筋様細胞を作製することに成功」
Kohei Inagawa, Kazutaka Miyamoto, Hiroyuki Yamakawa, Naoto Muraoka, Taketaro Sadahiro, Tomohiko Umei, Rie Wada, Yoshinori Katsumata, Ruri Kaneda, Koji Nakade, Chitose Kurihara, Yuichi Obata, Koichi Miyake, Keiichi Fukuda, Masaki Ieda
doi: 10.1161/CIRCRESAHA.112.271148
6.本研究への支援
本研究は、下記機関より資金的支援を受け実施されました。
JST CREST
日本学術振興会 科学研究費補助金(挑戦的萌芽研究)
公益財団法人 万有生命科学振興国際交流財団
公益財団法人 上原記念生命科学財団
公益財団法人 先進医薬研究振興財団
<参考図>
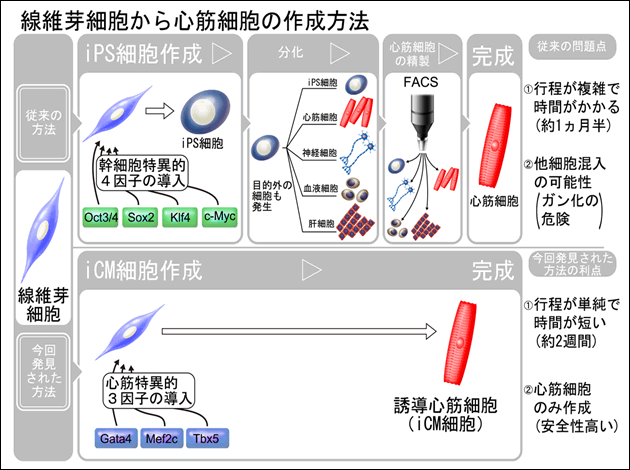
図1 線維芽細胞から心筋細胞の作製方法
従来の方法(上)と今回用いた心筋直接誘導法(下)の比較
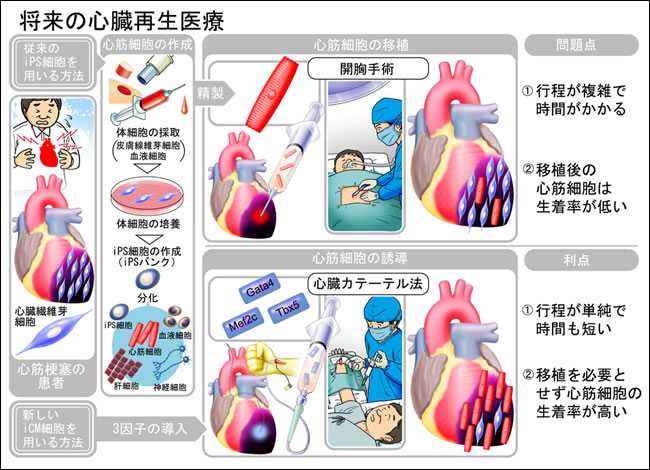
図2 将来の心臓再生医療
従来の方法の問題点(上)と今回の研究成果により得られた心筋細胞直接誘導法の利点(下)の比較。将来的に、心臓カテーテル法を用いて、心臓患部に直接遺伝子を導入して心筋細胞を作製し、心臓再生医療を行うことが期待される。
<用語解説>
- 注1) 心筋誘導遺伝子
- 2010年に家田特任講師らが発見した心筋細胞を作り出すために必要な3つの遺伝子群(Gata4、Mef2c、Tbx5)で、iPS細胞を樹立するときの「山中ファクター」にあたる。この3つの遺伝子を培養皿上の線維芽細胞に導入すると、iPS細胞を経ることなく心筋細胞を直接作製できる。
- 注2) 心臓線維芽細胞
- 心臓線維芽細胞は心臓内結合組織を構成するポンプ機能を持たない細胞で細胞外基質、液性因子を分泌する。細胞数は心臓内で、70%を占める最も数の多い細胞種である。心臓肥大、心筋梗塞などの病態ではさらに細胞が増殖し、心筋肥大、心不全を引き起こすことが知られている。
- 注3) 人工多能性幹細胞(iPS細胞:induced pluripotent stem cell)
- 体細胞に特定因子を導入することにより樹立される、ES細胞に類似した多能性幹細胞。2006年に山中教授の研究グループにより世界で初めてマウス体細胞を用いて樹立された。
- 注4) 新しい心臓再生法
- これまでの心臓再生法では、体外で幹細胞から心筋を作製し心臓患部へ細胞移植するという方法が取られてきた。今回の発見は心臓内で心筋以外の細胞を直接心筋に転換し心臓を再生するという新しい方法である。
- 注5) 心筋梗塞
- 心臓の栄養血管である冠動脈が閉塞し、心臓の筋肉が壊死する病気。心臓のポンプ機能が低下し心不全死などにつながる。
- 注6) 体細胞に3因子(Gata4,Mef2c,Tbx5)を導入することにより、世界で初めて家田特任講師らにより心筋細胞の直接誘導が示された (Ieda M et al. 2010, Cell)。
- 注7) レトロウイルスベクター
- ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。目的遺伝子をウイルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、ウイルスベクターの1種類で、心臓線維芽細胞に特異的に遺伝子導入できる。
- 注8) 本研究過程で同様の心筋誘導因子を用いて生体内で心筋細胞を直接作製できたという結果が本年4月と5月に、欧米2つの研究グループより報告された(Qian L et al. 2012, Nature) (Song K et al. 2012, Nature)。3つの心筋誘導遺伝子を同時に発現できるポリシストロニックベクターを構築し効率よく3遺伝子を導入することで、新生心筋細胞の成熟度が改善することを示したのは本研究が初めてである。
- 注9) ポリシストロニックウイルスベクター
- ポリシストロニックベクターとは、複数の遺伝子を単一遺伝子上に並列に並べて、複数の遺伝子を同時に発現できるシステム。3つの遺伝子を同時に同量、細胞内に導入できることで成熟した心筋細胞の誘導効率が改善した。

本研究で開発したポリシストロニックベクター
<お問い合わせ先>
慶應義塾大学 医学部 循環器内科教室
家田 真樹
TEL:03-5843-6702 FAX:03-5363-3875
E-mail:
<本リリースの発信元>
慶應義塾大学 信濃町キャンパス(冨田)
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:
URL:https://www.med.keio.ac.jp/
科学技術振興機構 総務部 広報課
〒102-8666 東京都千代田区四番町5番地3
TEL:03-5214-8404 FAX:03-5214-8432
E-mail: