楠見 明弘 京都大学 物質-細胞統合システム拠点(iCeMS=アイセムス)・同 再生医科学研究所 教授、鈴木 健一 iCeMS 准教授らの研究グループは、細胞のはたらきを制御するのに重要な役割を果たすとされる、細胞膜上のラフト注1)領域の構造とシグナル伝達の仕組みを、世界で初めて解明しました。
本研究では、ラフト経由でのシグナル伝達をおこなうGPIアンカー型受容体注2)、注3)に注目しました。その結果、GPIアンカー型受容体は同じ分子同士で2量体注4)を作ること、それらがコレステロールと結合して安定化され、寿命が0.2秒のラフトを作ることが分かりました。つまり、ラフトは数個から数十個の分子が集まっただけの直径数ナノメートルの小さい構造で、しかも、常にできたり壊れたりしていることが分かりました。
さらに、GPIアンカー型受容体に細胞外からのシグナル分子(リガンド注5))が結合すると、2量体をもとに安定な4量体を形成します。この2量体を結合させる糊として、コレステロールを含むラフトが働きます。このラフトの働きが、GPIアンカー型受容体のシグナル伝達に必要であることが分かりました。
ラフトを介したシグナル機構の解明は、アルツハイマー病、HIV、BSE(牛海綿状脳症)など、ラフト経由で発症や感染する疾病の研究に貢献することが期待されます。
今回の研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ(研究領域:生命システムの動作原理と基盤技術、研究総括:中西 重忠)の一環として行われました。本成果は米国東部時間2012年7月22日13時(日本時間23日午前2時)に米科学誌「Nature Chemical Biology(ネイチャー・ケミカル・バイオロジー)」オンライン速報版で公開される予定です。
<1.背景>
細胞膜上の受容体に、細胞外からやってきたシグナル分子(リガンド)が結合すると、それが細胞内に伝わって、細胞は増殖したり移動したりします。このように、細胞機能を変化させるシグナル伝達は、細胞膜の最も重要な働きの1つです。
細胞膜は2次元的な構造をもつ膜ですが、液体であることが分かっています。その中に、直径0.1~数ミクロンのイカダのようなラフト領域が浮かんでいると考えられてきました(図1)。ちょうど、フライパンに液体のオリーブオイルを敷き、そこにコレステロール含量が多いバター(ラフト)を浮かべたような構造です。イカダに多くのシグナル分子が集合しており、シグナル伝達経路の1/3程度は、ラフトが担っているとする「ラフト仮説」が15年くらい前から提案されていました(Simons&Ikonen,Nature 387;1997)。しかし、世界中で研究が行われてきたにもかかわらず、ラフトの大きさも、寿命も、シグナルを伝達する仕組みも不明なままでした。
<2.研究内容と成果>
本研究チームは、まず、生きている細胞の細胞膜中で、ラフト経由でシグナル伝達を行うと考えられてきたGPIアンカー型受容体を、1分子精度で、多数同時に追跡する方法を開発しました。また、2種類の違う分子を同時に1分子追跡する(2色で同時に追跡する)方法を開発しました。
これによって、GPIアンカー型受容体は同じ分子同士で2量体を作ること、それらがコレステロールと結合して安定化され、寿命が0.2秒のラフトを作ることが分かりました。つまり、バターはオリーブオイル薄膜中では大きな塊を作っているのではなく、数個から数十個の分子が集まっただけの直径数ナノメートルの小さい構造で、しかも、常にできたり壊れたりしていることが分かりました。
さらに、GPIアンカー型受容体に細胞外からのシグナル分子が結合すると、2量体をもとに安定な4量体を形成します。この2量体を結合させる糊として、コレステロールを含むラフトが働きます。このラフトの働きが、GPIアンカー型受容体のシグナル伝達に必要であることが分かりました。
具体的には、
-
(1) GPIアンカー型受容体は、同種の分子同士で0.2秒ほどの短寿命2量体を形成している。同種タンパク質同士には親和性があり結合するが、コレステロールなどのラフト脂質がそこにやってきて、ラフト構造を作ることで2量体は安定化される。しかし、安定化されても、寿命は0.2秒程度である(安定化されないときは、その1/3~1/2の寿命)(図2)。
-
(2) GPIアンカー型受容体の2量体形成は、同種分子同士に限られ、異種分子間では、起こらない。つまり、ラフトに2個のGPIアンカー型受容体が集まるのではなく(それなら、異種分子でも集まるはず)、タンパク質同士での結合があるときに、小さなラフトがそこで誘導されて安定化される(図2)。
-
(3) 2量体同士が結合して4量体ができる。さらに大きな会合体もできる。4量体以上は、異種のGPIアンカー型受容体も集まれる。これは、2量体を基本単位としての集合は、ラフトが糊となって起こるからである(図3)。
-
(4) 細胞外からのシグナル分子(リガンド)がGPIアンカー型タンパク質(CD59注6))に結合すると、非常に安定な(寿命が6秒以上の)4量体を形成した(図4)。
-
(5) リガンドが結合した4量体には、さらに細胞内のシグナル分子が誘導され、細胞内シグナルが発生する(図4)。
まとめると、細胞外からシグナルが来る前の細胞膜には安定で大きなラフトはなく、シグナル分子が受容体に結合して、オンデマンドで安定なラフトが形成される(図5)ことがわかりました。
今回の発見は、通常の生物学や基礎医学の方法と全く違うナノ・メゾテクノロジーを用いて可能になったものです。生きている細胞中で、1個ずつの分子を見て、それらがどのように組み立てられてラフトができるかをつぶさに観察することで注7)、ラフトの実体と、それがはたらく仕組みが、一気に明らかになったのです。
<3.今後の期待>
今後は、安定化4量体がどのようにして細胞内のシグナル分子に信号を伝えているのかを解明することが課題です。有力な仮説は、膜の表裏をつなぐ貫通型タンパク質“X”がGPIアンカー型タンパク質の4量体形成依存的に誘導されることです。また、アルツハイマー病の発症、エイズウィルスやBSEなどの感染でも、細胞膜上でタンパク質の会合が重要であることがわかってきています。このような会合とラフト誘導との関係の理解、タンパク質集合の阻害法などの開発が、今後の重要な課題です。
<参考図>
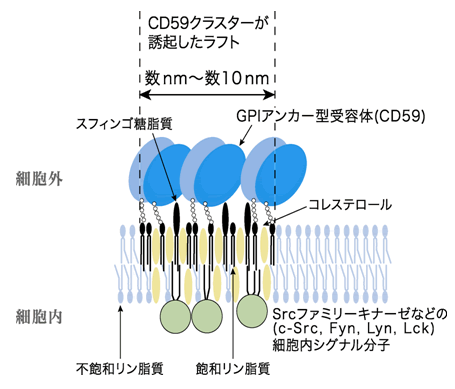
図1
従来、一般に広がっていた「ラフト」の概念を示した図
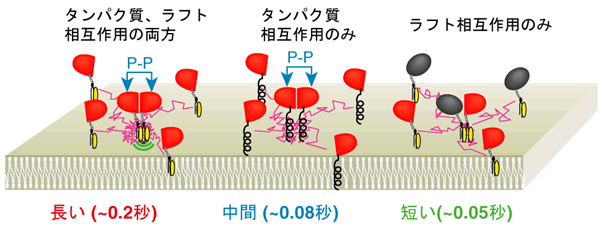
図2
タンパク質相互作用とラフト相互作用によるGPIアンカー型タンパク質のホモ2量体ラフト形成。刺激前の細胞の細胞膜では、GPIアンカー型受容体は、同種分子同士の2量体を形成するが、それにはタンパク質相互作用が必要で、ラフト相互作用は2量体を安定化している。
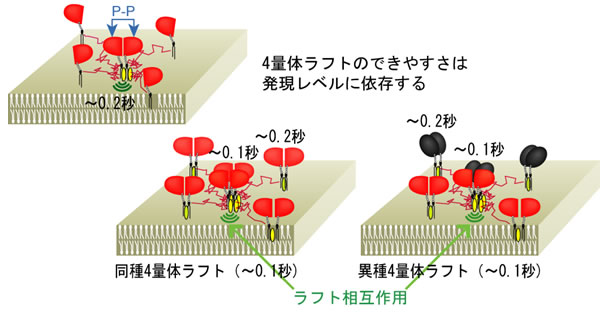
図3
GPIアンカー型タンパク質の2量体ラフトが、ラフト相互作用によって集まり、ホモとヘテロの4量体ラフトを形成。寿命は、ホモ2量体ラフトの~0.2秒よりも短く~0.1秒。
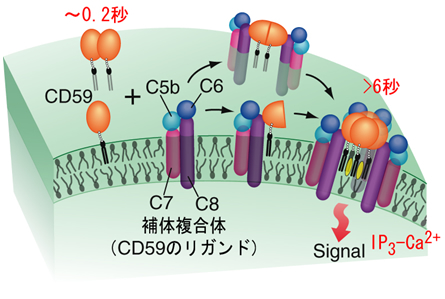
図4
リガンド添加後、GPIアンカー型受容体の1つであるCD59は、短寿命2量体ラフトを基に、安定な4量体ラフトを形成する。
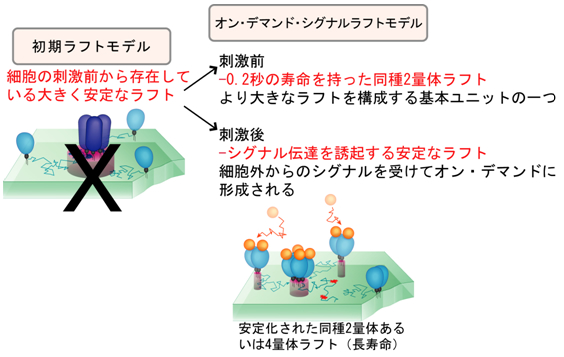
図5 オン・デマンド・シグナルラフトモデル
<論文タイトルと著者>
“Transient GPI-anchored protein homodimers are units for raft organization and function”
Kenichi G. N. SUZUKI, Rinshi S. KASAI, Koichiro M. HIROSAWA, Yuri L. NEMOTO, Munenori ISHIBASHI, Yoshihiro MIWA, Takahiro K. FUJIWARA, Akihiro KUSUMI
Nature Chemical Biology
doi: 10.1038/nchembio.1028
<関連リンク>
京都大学 物質-細胞統合システム拠点
https://www.icems.kyoto-u.ac.jp/j/pr/2012/07/23-nr.html
<用語解説>
- 注1) ラフト
- 細胞膜は2次元状の液体である。それで、細胞膜を海面に例えると、そこにぷかぷか浮いているイカダ、というイメージからラフトという名前が使われるようになった。細胞膜は一様ではなく、氷山のようなものができていたり、シャーベット状の塊(正しくは、秩序液晶相という領域)があったりという議論は、この40年間ほど続いている。人工膜では、このような膜領域を作り出すことができている。しかし、実際の細胞膜がどうなっているかは、ほとんどわかっていなかった。人工膜では、大抵、2~3種類の脂質分子で膜を構成するので、そこで、シャーベット状の塊を作るために必要な代表的な脂質分子は、コレステロールと糖脂質であることがわかっている。しかし、細胞膜中には、1万種程度の分子が存在し、それらがどのように混ざり合って、液体中に不均一な構造を作るのかは、ほとんどわかっていなかった。したがって本研究で、GPIアンカー型受容体の会合が誘導されると、そこに、コレステロールと糖脂質が集まって直径数nm~数10nmのラフトが誘導されることがわかったことは、細胞膜の構造と機能の理解を大きく前進させるものである。
- 注2) 受容体(receptor)
- 細胞膜上にあり、光・ホルモン・抗原などの刺激を選択的に受け取って細胞機能に変化を生じさせる物質。
- 注3) GPIアンカー型受容体
- GPIは、glycosylphosphatidylinositol=グリコシル・ホスファチ
ジルイノシトールと呼ばれるリン脂質の一般的略称。受容体タンパク質の15%程度は、GPIに共有結合することによって、細胞膜に結合(アンカー)されている。このような受容体をGPIアンカー型受容体と呼ぶ。GPIアンカー型受容体は細胞内に露出していないため、この分子だけでは細胞内にシグナルが伝わらない。
- 注4) 2量体(dimer)
- 分子2個が結合して生成する2分子結合体のこと。3つ・4つの分子がまとまっ
た場合は3量体・4量体と呼ぶ。
- 注5) リガンド
- 細胞外分子で、受容体に結合する分子。広義には、タンパク質分子に結合して、新たな機能を与えたり、構造変化を誘導したりする分子を、リガンドと呼ぶ。
- 注6) CD59
- GPIアンカー型受容体の一種。免疫系の補体複合体をリガンドとし、補体系に
よる自己攻撃を阻止するためのシグナルを、細胞内に発する。
- 注7) 細胞膜上の1分子観察
- 生細胞中で観察したい目的分子に、蛍光を発する分子を結合させ、蛍光を目印に1分子分解能でその分子を観察する方法。このためには、特殊な蛍光顕微鏡(本研究では、研究室で開発し組み立てた顕微鏡)を用いる。多数の分子の挙動を1個ずつ見て、それらの動きや分布変化が追跡できる。本研究グループでは1986年以来、特殊な顕微鏡の開発だけでなく、細胞がよい状態のまま1分子観察をするための自動化技術、画像取得後にノイズの中からシグナルを拾って1分子を追跡するためのソフトウェアの開発などの技術開発を実施してきており、この分野での世界のリーダーとなっている。
<お問い合わせ先>
<研究内容について>
鈴木 健一(スズキ ケンイチ)
京都大学 物質-細胞統合システム拠点(iCeMS) 准教授
元 JST 戦略的創造研究推進事業 さきがけ「生命システムの動作原理と基盤技術」 研究員
(このプロジェクト自体は終了しています)
Tel:075-751-4112
E-mail:
楠見 明弘(クスミ アキヒロ)
京都大学 物質-細胞統合システム拠点(iCeMS) 教授
京都大学 再生医科学研究所 教授
Tel:075-751-4112
E-mail:
<京都大学 物質-細胞統合システム拠点(iCeMS)について>
今羽右左 デイヴィッド 甫(コンハウザ デイヴィッド ハジメ)、飯島 由多加(イイジマ ユタカ)
京都大学 物質-細胞統合システム拠点(iCeMS) 国際広報セクション
Tel:075-753-9755
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)、木村 文治(キムラ フミハル)
科学技術振興機構 戦略研究推進部
Tel:03-3512-3525
E-mail: