JST 課題達成型基礎研究の一環として、千葉大学 大学院理学研究科の村田 武士 特任准教授と京都大学 大学院医学研究科の岩田 想 教授、日野 智也 研究員(現 鳥取大学 大学院工学研究科 講師)、小林 拓也 講師、東京大学の浜窪 隆雄 教授、岩成 宏子 特任助教らは、抗体を用いることで、最も重要な医薬品標的分子ファミリーである「Gたんぱく質共役型受容体(GPCR)」の結晶化を促進する方法(立体構造を認識するモノクローナル抗体注1)の作製法)を開発し、GPCRと抗体の複合体の立体構造をX線結晶構造解析注2)によって解明しました。またこの複合体の構造を原子レベルで明らかにすることで、新たなGPCRの阻害機構を明らかすることにも成功しました。
近年、新規医薬品開発においては、薬剤の標的となるたんぱく質の立体構造に基づいた合理的な薬剤設計が有効であることが示されています。しかし、細胞膜に埋まった構造を持つGPCRでは、結晶化における糊代となる親水性表面が少ないため、質の良い結晶作製が困難であり、ヒトのGPCRの立体構造もこれまでに数個しか解析されていません。
本研究グループは、GPCRを効率よく結晶化するために、標的分子と特異的に結合する抗体を結晶化における糊代とすることに着目し、まず抗体の高効率作製法を開発しました。その結果、パーキンソン病の薬剤標的であるアデノシンA2a受容体注3)に対する抗体を多数取得し、この抗体を用いることでアデノシンA2a受容体と抗体の複合体の結晶化に成功し、その立体構造をX線結晶構造解析により決定しました。
この複合体の立体構造解析からは、抗体分子がアデノシンA2a受容体の細胞内側表面の「くぼみ」に深く突き刺さることにより、受容体の活性化に伴う構造変化を抑制し、機能を完全に阻害していることが明らかになりました。この「くぼみ」はGPCRの活性を制御することができる新規の薬剤結合部位であり、全く新しい阻害機構を持った薬剤の設計が可能になると期待されます。
本研究は、文部科学省 ターゲットタンパク研究プログラムの支援を受けて行われ、本研究成果は、2012年1月29日(英国時間)に英国科学雑誌「Nature」のオンライン速報版で公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
「岩田ヒト膜受容体構造プロジェクト」 |
| 研究総括 |
岩田 想(京都大学 大学院医学研究科 教授) |
| 研究期間 |
平成17~23年度 |
JSTはこのプロジェクトで、構造解析の極めて困難な疎水的な膜たんぱく質であるヒト膜受容体の構造解析において、膜受容体の精製・結晶化の普遍的な技術を確立し、ヒト膜受容体構造解析を系統的に行う技術の確立を目指します。
<研究の背景と経緯>
Gたんぱく質共役型受容体(GPCR)は、ホルモンや神経伝達物質などのセンサーとして細胞外からのシグナルを受容し細胞内へ情報を伝達する、7回も細胞膜を貫通する構造(7回膜貫通構造)を持ったたんぱく質です。現在使われている薬の約50%が、このGPCRをターゲットとしていることが知られています。
副作用が少なく、効果の高い薬剤の設計・改良には、医薬標的となるたんぱく質の立体構造情報に基づいた薬剤設計(Structure-Based Drug Design)が有効であることが示されています。しかし現在のところ、800種類ほどあるGPCRのうち10種類程度の立体構造が明らかになっているに過ぎません。これは、GPCRが構造的に揺らぎを持った不安定な分子であるのに加え、結晶化に必須な親水性表面が著しく少ないことが原因と考えられています。GPCRの立体構造を体系的かつ網羅的に決定してゆくためには、GPCRと特異的に結合する抗体を用いて、GPCRと抗体の複合体を形成させて親水性表面を拡張し、かつ構造的揺らぎを抑えることによって結晶性を向上させるという戦略が有効です(図1)。
本研究グループは比較的安定なアデノシンA2a受容体をモデルに、結晶性を向上させるモノクローナル抗体作製法を開発し、アデノシンA2a受容体と抗体の複合体の立体構造の解明を試みました。
<研究の内容>
ヒト由来のアデノシンA2a受容体の生産は、メタノール資化性酵母のピキア・パストリス( Pichia pastoris )注4)を用いて行いました。酵母にアデノシンA2a受容体をより多く作成させるために、いくつかの遺伝子操作を行った結果、アデノシンA2a受容体の端を一部削除し、糖鎖修飾部位に変異を加えたものが最も発現量が高く、結晶化するために十分な量の試料を精製することができました。
次に、立体構造を認識する抗体を得るために、精製したたんぱく質をリポソームへ再構成し、立体構造を保持した状態でマウス体内において免疫反応を起こしました。この反応により、変性したたんぱく質には結合しない24種類のモノクローナル抗体を抽出しました。これらのうち、8種類がアゴニスト(作動薬)注5)の結合活性を阻害する機能を持った抗体で、そのうち1種類はアンタゴニスト(拮抗薬)注6)の結合は何も阻害しないのに、アゴニストの結合を完全に阻害していました。
この抗体のアゴニスト(作動薬)Fabフラグメント注7)と、精製したアデノシンA2a受容体の1:1複合体を調製し、アンタゴニスト(ZM241385)の存在下で良質の複合体の結晶を得ることに成功しました。英国にある放射光施設「ダイアモンド」のマイクロフォーカスビームを用いて結晶の回折データを収集し、立体構造を決定しました(図2A)。
Fab抗体はアデノシンA2a受容体の細胞内側の表面を幅広く認識し、結合していました(図2A)。特に、抗体の超可変領域注8)の1つ(H3)は長く伸びたヘアピン構造を形成し、アデノシンA2a受容体の細胞膜を貫通しているらせん構造の部位から形成される「くぼみ」に深く突き刺さり、水素結合や疎水結合により強く相互作用していました(図2B)。
GPCRは活性化に伴い、らせん構造の一部が大きく動くことがすでに分かっています。従って、今回のアデノシンA2a受容体と抗体の複合体では、抗体の超可変領域(H3)がらせん構造の相対配置を固定するように結合しているために、アデノシンA2a受容体は活性型構造に変化することができず、これにより作動薬が結合できなくなっていると考えられます(図3)。以上の結果から、本抗体はアロステリック逆作動薬活性を持つ機能性抗体注9)であることが明らかになりました。また、X線結晶構造解析による立体構造を得ることが難しいGPCRに対して、本研究で開発した抗体作製技術が有効であることを示すこともできました。
<今後の展開>
本研究により、GPCRの細胞内側の「くぼみ」に結合してらせん構造の一部(ヘリックス6)の動きを固定すれば、GPCRの機能を完全に不活性化できることが明らかになりました。つまり、この「くぼみ」は全く新しい阻害機構を持った薬剤結合部位になると考えられます。本研究で得られた超可変領域の構造をもとに、低分子化合物のデザインを行うことで、パーキンソン病の新規治療薬の開発が可能になると期待されます。また、アデノシン受容体以外のGPCRに関しても、同様の「くぼみ」が新しい薬剤結合部位になる可能性が示唆されます。
今後、本研究で開発した結晶化促進抗体作製技術により、結晶構造を得ることが難しかった多くの膜たんぱく質の結晶構造が解明されることが期待されます。
<参考図>
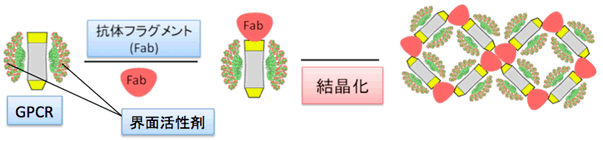
図1 抗体フラグメントによるGPCR結晶化の促進法
精製したGPCRは親水性領域が小さいため界面活性剤に覆われてしまい、結晶の格子が形成されにくい。GPCRの立体構造を認識する抗体フラグメントを用いて、親水性領域を拡張させて結晶性を向上させる手法。
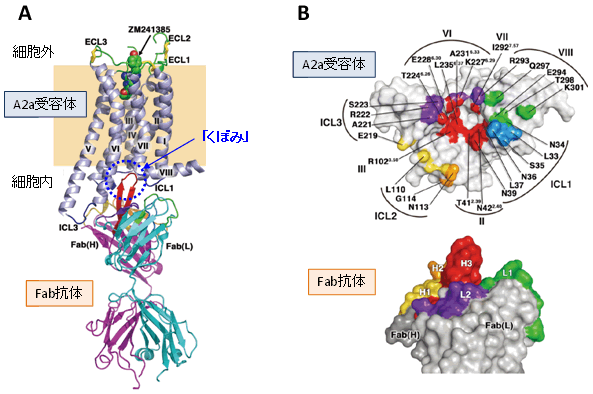
図2 アデノシンA2a受容体と抗体の立体構造
アデノシンA2a受容体は細胞膜を貫通する7本のらせん構造(Ⅰ~Ⅶ)とそれをつなぐループ構造(ICL1~3、ECL1~3)から、抗体フラグメント(Fab)は重鎖((Fab(H))と軽鎖(Fab(L))から形成されています。
-
A)全体構造。細胞外側のリガンド結合サイトにアンタゴニスト(ZM241385:緑色)が結合し、細胞内側の「くぼみ」にFab抗体が結合していました。
-
B)抗体の結合サイト(Fab抗体の結合面の表面表示)。抗体の超可変領域(CDR-H1(黄色)、H2(オレンジ色)、H3(赤色)、L1(緑色)、L2(紫色))がアデノシンA2a受容体に結合している表面を示しています。
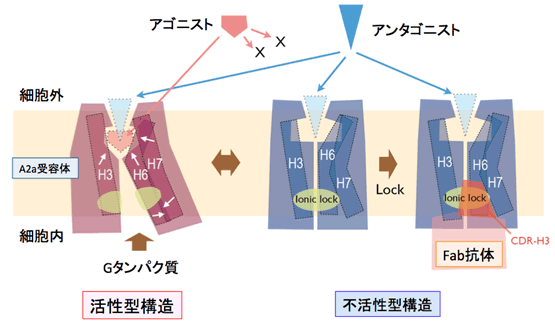
図3 機能性抗体によるGPCRの不活性化の分子メカニズム
GPCRは主に細胞膜を貫通しているらせん構造(ヘリックス6:H6)が構造変化することで活性型構造と不活性型構造の平衡状態として存在していると一般的に考えられています。作動薬は細胞外から活性型構造に結合し、細胞内のGたんぱく質結合を促進することにより、シグナル伝達が起ります。本抗体は不活性型構造の細胞内の「くぼみ」に強く結合し、H6の構造変化を止めてしまうことにより、不活性型に固定し、作動薬およびGたんぱく質の結合を完全に阻害します。
<用語解説>
- 注1) モノクローナル抗体
- 単一の抗体を産生する細胞が作る抗体のクローンで、一種類の抗原とだけ反応する。
- 注2) X線結晶構造解析
- 解析対象のたんぱく質を結晶化し、X線照射によって得られる回折データから、結晶内部で原子がどのように配列しているかを決定する手法。
- 注3) アデノシンA2a受容体
- アデノシンA2a受容体はアデニル酸シクラーゼ促進性のGたんぱく質(Gs)と共役するGPCRで、線条体や大脳皮質、海馬、冠血管、肺、血小板など生体内の幅広い部位に分布している。その生理機能は、神経活動の制御、血管拡張、内蔵平滑筋の弛緩など多岐に渡る。コーヒーに含まれるカフェインはアデノシンA2a受容体の拮抗剤であり、アデノシンの結合を阻害することにより睡眠覚醒作用を示す。コーヒー愛飲者はパーキンソン病にかかりにくいと言われていたが、近年アデノシンA2a受容体の拮抗剤がパーキンソン病などの神経変性疾患に対する効果が正式に認められ、その特異的医薬品創成が盛んに行われている。
- 注4) ピキア・パストリス( Pichia pastoris )
- 酵母の一種。高密度培養が可能であるため、組換えたんぱく質の発現系としてよく使われている。
- 注5) アゴニスト(作動薬)
- 受容体に結合し、神経伝達物質やホルモンなどの生体内物質(リガンド)と同様の機能を示す物質のこと。
- 注6) アンタゴニスト(拮抗薬)
- 受容体には結合するが、受容体の作用自体は起こさない物質で、本来結合すべき生体内物質が受容体に結合することを阻害する。
- 注7) Fabフラグメント(右図参照)
- 抗原との結合領域を含む抗体の一部。抗体はパパイヤに含まれるたんぱく分解酵素パパインによって、2分子のFabフラグメントと1分子のFcフラグメントに分解されます。抗体フラグメント(Fab)は重鎖((Fab(H))と軽鎖(Fab(L))から形成されている。
- 注8) 超可変領域(右図参照)
- Fabフラグメントの先端半分にある抗原の結合領域(可変領域)のうち、直接抗原と接触するため変化が大きい領域で、CDR(complementarity-determining region)と呼ぶ。
- 注9) アロステリック逆作動薬活性を持つ機能性抗体
- 生体内物質(リガンド)が結合する部位とは異なる部位に結合し、完全にたんぱく質を不活性化する機能を持った抗体。
<論文名>
“ G-protein-coupled receptor inactivation by an allosteric inverse-agonist antibody ”
(アロステリック逆作動薬活性を持つ機能性抗体によるGたんぱく質共役型受容体の不活性化メカニズム)
doi: 10.1038/nature10750
<お問い合わせ先>
<研究に関すること>
村田 武士(ムラタ タケシ)
千葉大学 大学院理学研究科 特任准教授
〒263-8522 千葉県千葉市稲毛区弥生町1-33
Tel:043-290-2794 Fax:043-290-2794
E-mail:
岩田 想(イワタ ソウ)
京都大学 大学院医学研究科 教授
〒606-8501 京都府京都市左京区吉田近衛町
Tel:075-753-4389 Fax:075-753-4660
E-mail:
金子 博之(カネコ ヒロユキ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: