JST 課題達成型基礎研究の一環として、東京医科歯科大学 大学院医歯学総合研究科の高柳 広 教授と根岸 貴子 客員助教らの研究グループは、Semaphorin 4D(セマフォリン フォー ディー:Sema4D)注1)と呼ばれるたんぱく質の働きを抑えることで、骨を再生することにマウスの実験で成功しました。
骨は、古くなった骨を吸収して新しい骨を形成する「骨リモデリング」を繰り返すことによって、健康な状態が維持されています。いわば骨の新陳代謝であり、骨折が治るのもこの再生力があるからです。この骨吸収と骨形成のバランスが崩れ、骨吸収が骨形成を上回ると、骨粗しょう症などの骨減少性疾患が引き起こされます。これまで、骨粗しょう症の治療では骨の吸収を抑える薬剤が主に使われてきましたが、骨形成を促進させる薬剤はほとんどなく、壊れた骨を再生させる薬の開発が望まれています。
これまでの研究では、新しい骨の形成は古い骨の吸収がきっかけとなって始まることが知られています。一方で、骨を健常な状態に維持するためには、古くなった骨が確実に除去されるまで、新しい骨の形成は待機して始まらない仕組みが必要だと考えられますが、そのような仕組みがあるかどうか分かっていませんでした。
本研究グループは今回、神経細胞が回路を作る過程や免疫反応に関わることで知られる、Sema4Dというたんぱく質が、骨を吸収する細胞(破骨細胞注2))から多量に産生され、骨を形成する細胞(骨芽細胞注3))に働きかけることにより骨形成を抑制する仕組みを、マウスにおいて明らかにしました。さらに、Sema4Dやその下流で働く遺伝子を破壊したマウスでは、骨形成が促進して骨量が増加します。また、骨粗しょう症モデルマウスにSema4Dの働きを阻害する「抗Sema4D抗体」を投与すると、減ってしまった骨を再生させることができました。従って、Sema4Dの働きを抑える物質は、骨粗しょう症や関節リウマチ、がんの転移による骨の破壊といった骨量減少性疾患に対する新薬の候補になることが分かりました。
本研究成果は、東京大学 大学院医学系研究科、東京大学 先端科学技術研究センター 、米国マウントサイナイ医科大学などの研究グループとの共同研究で得られ、2011年10月23日(英国時間)に英国科学誌「Nature Medicine」のオンライン速報版で公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業課 ERATO型研究
| 研究プロジェクト |
「高柳オステオネットワークプロジェクト」 |
| 研究総括 |
高柳 広(東京医科歯科大学 大学院医歯学総合研究科 教授) |
| 研究期間 |
平成21~26年度 |
JSTはこのプロジェクトで、脊椎動物の生体系を「骨による外界からの刺激感受と骨による全身の生体系制御システム=オステオネットワーク」として捉え直し、このオステオネットワークの解明を進め、基礎生物学から臨床医学に貢献する研究を行っています。
<研究の背景と経緯>
骨粗しょう症は、日本では高齢女性を中心に推計1100万人[骨粗しょう症の予防と治療GL作成委員会/編(2006年)/ガイドラインより]が罹患(りかん)している疾患で、骨質の低下と低骨密度により骨が弱くなり、容易に骨折を引き起こします。脊椎や大腿骨頸部(だいたいこつけいぶ)の骨折は寝たきり状態や慢性腰痛の原因となり、QOL(生活の質)を著しく低下させます。また関節リウマチも罹患率の高い関節疾患[日本では推計70万人 厚生労働省2011年4月12日 第2回リウマチ対策作業班議事録より]で、重篤な場合には骨・関節の破壊により患者の運動機能は著しく損なわれます。超高齢化社会を前にして、骨粗しょう症・関節リウマチ・がんによる骨の破壊に対する治療法の開発は急務の課題となっています。これまで、骨粗しょう症治療としては、ビスフォスフォネート剤注4)などの骨吸収を抑えて骨の減少を防ぐ薬剤が開発されてきましたが、骨粗しょう症の病態は骨吸収が増加するだけでなく骨形成が低下することに起因するため、骨を形成する細胞に直接的に作用して骨形成を高進させる方法がより効果的な治療法だと考えられます。しかし、現在骨粗しょう症に対して使われている骨形成促進剤は副甲状腺ホルモン製剤のみと極めて限られており、病状に応じて薬剤を選択することができません。また、関節リウマチやがんにみられる骨病変に対して、骨を再生させる効果を持つ薬剤はありません。
骨組織は、古くなった骨を破骨細胞が吸収し、その後吸収部位を骨芽細胞が新しい骨で完全に埋めることによって再構築されます。この過程は骨リモデリングと呼ばれ、生涯にわたって繰り返されて、骨組織は健全な骨量と骨質を維持しています。骨リモデリングは破骨細胞や骨芽細胞といったさまざまな細胞の相互作用により厳密に制御されており、特に、吸収した骨と同量の骨を新生するために、骨吸収が引き金となって骨形成が開始される仕組みが存在します。これを骨吸収と骨形成の共役(カップリング)機構と呼び、これまでその制御メカニズムの研究は世界中で盛んに行われてきました。
しかし、骨を健常な状態で維持するためには、骨吸収と骨形成の量的バランスを保つだけでは不十分であり、新しい骨の形成は古い骨が確実に除去されるまで待機して始まらないようになっていることが必要だと考えられます。つまり、破骨細胞が骨吸収を行っている間、骨芽細胞による骨形成が何らかの仕組みで抑えられている可能性が考えられますが、これまでの研究では、そのようなメカニズムが存在するか否かさえ不明でした。そこで本研究グループは、骨形成抑制に関わる因子とその分子メカニズムの解明を試みました。
<研究の内容>
本研究グループは、Sema4Dと呼ばれるたんぱく質が破骨細胞によって多量に産生されることを、マウスにおいて発見しました。Sema4Dはこれまで、神経細胞が軸索を伸ばし回路を作る過程や免疫反応に関わることで知られていたたんぱく質です。Sema4Dは、骨芽細胞上に発現するたんぱく質(受容体)「Plexin-B1(プレキシン ビー ワン)」に作用し、骨芽細胞による骨形成を抑制します(図1)。具体的には、Sema4Dにより活性化したPlexin-B1は、骨芽細胞内で細胞内のシグナル伝達に関わるたんぱく質の1つ「RhoA(ロー エー)」を活性化します。活性化したRhoAは、骨芽細胞が成熟(分化)するために必須である「インシュリン様成長因子IGF経路」を阻害することで、骨芽細胞の成熟を抑制し、骨形成を抑えることが分かりました。また、骨形成を行うにあたっては、骨芽細胞が骨形成を必要としている部位へ移動してくることが重要だと言われています。本研究ではさらに、活性化したRhoAが、骨芽細胞の運動能注5)を制御して破骨細胞から離れた場所に骨芽細胞をとどまらせることによって、骨形成を抑制していることも明らかになりました (図2)。これらの結果から、破骨細胞は骨吸収を行っている間、Sema4Dを産生することによって、骨形成の開始を待機させることが明らかになりました。
Sema4DやPlexin-B1遺伝子を破壊したマウスや、RhoAの機能を抑制したマウスを調べたところ、骨芽細胞の数と骨形成率が増えて骨量も増加していることが分かりました。これは、Sema4Dによって骨芽細胞の成熟(分化)が阻害されず、骨芽細胞が過剰に分化したためだと考えられます。正常な生体内では、Sema4D-Plexin-B1-RhoA経路が生体内の骨形成抑制に必須の役割を果たしていることが分かります。
さらに、卵巣を摘出する手術(卵巣摘出術)を行って骨粗しょう症を発症させたマウスに、Sema4D経路を阻害する抗Sema4D抗体を投与すると、骨形成が促進して骨量が回復することが分かりました。従って、抗Sema4D抗体は骨を再生させる効果を持つことを証明しました(図3)。
<今後の展開>
本研究成果により、抗Sema4D抗体を始めとして、Sema4D-Plexin-B1-RhoA経路を抑制する治療法が、骨粗しょう症といった骨減少性疾患に対して強い治療効果を発揮すると期待されます。また、Sema4Dは破骨細胞だけでなく、免疫系細胞や一部のがん細胞にも発現することが知られています。このような細胞が関与し、骨リモデリングに異常が生じる疾患として、例えば、関節リウマチやがんの骨転移にみられる骨病変があります。Sema4Dの抑制は、このような疾患の治療に対しても効果があることが期待されます。さらに、骨リモデリングにおいて、いかに骨吸収と骨形成を共役させるかといったこれまでの研究とは違った視点、すなわち、どのようにして骨形成の開始を抑制して骨吸収を遂行させるかといった新たな視点で研究を進めることの必要性と、その分子メカニズムを明らかにしたという点で、国内外の骨代謝学分野の発展の上で先導的な意義を持つと考えられ、日本における骨疾患研究が一層進展することが期待されます。
<参考図>
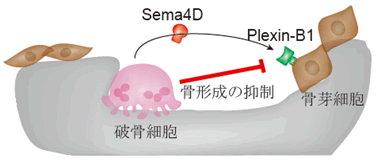
図1 破骨細胞が産生するSema4Dは骨芽細胞上のPlexin-B1を介して
骨形成を抑制する
破骨細胞が産生するSema4Dは骨芽細胞上で受容体Plexin-B1に認識される。骨吸収を行っている間、破骨細胞はSema4DとPlexin-B1の相互作用を介して骨吸収部位近傍での骨形成を抑制する。
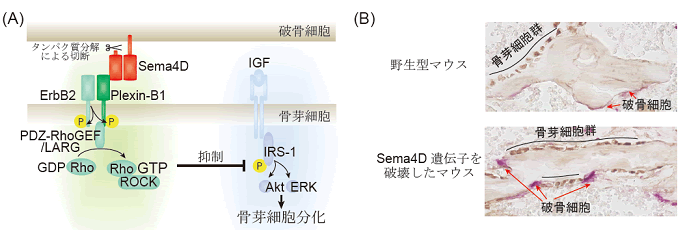
図2 Sema4Dは低分子量GTPアーゼたんぱく質RhoAを活性化して、
骨芽細胞の分化と骨吸収部位への遊走を抑制する
- (A)Sema4D-Plexin-B1-RhoA経路による骨芽細胞分化抑制の分子メカニズム
- 骨芽細胞上に発現する受容体Plexin-B1がSema4Dを認識すると、Plexin-B1はチロシンキナーゼ型受容体ErbB2によってリン酸化されて活性化する。活性化したPlexin-B1はRhoAのグアニンヌクレオチド交換因子であるPDZ-RhoGEFやLARGを介して、RhoAおよびRho結合キナーゼROCKを活性化する。このSema4D-Plexin-B1-RhoA経路は、骨芽細胞の分化に必須の情報伝達経路であるIGFシグナルを阻害するため、骨芽細胞分化は抑制される。
- (B)Sema4Dによる細胞局在の制御
- 野生型マウスの骨表面では破骨細胞が存在する領域の近傍に骨芽細胞群が観察されることはほとんどない。それに対して、Sema4D遺伝子を破壊したマウスの骨表面では、破骨細胞の近くに存在する骨芽細胞が多数観察された。赤矢印は破骨細胞、黒線は骨芽細胞群を示す。
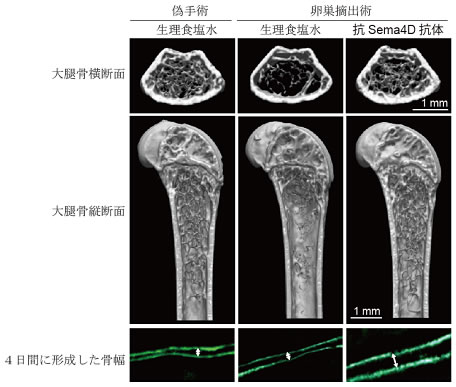
図3 抗Sema4D抗体はマウスの骨粗しょう症における骨量減少を治療する
卵巣を摘出したマウスでは、偽手術(卵巣摘出なし/生理食塩水群)を行ったマウスに比べ8週間後には重度の骨粗しょう症を発症する(卵巣摘出術/生理食塩水群)。この骨粗しょう症モデルマウスに抗Sema4D抗体を投与することにより、骨を再生することに成功した(卵巣摘出術/抗Sema4D抗体群)。下段の2重蛍光ラベル間の両矢印は新しく形成した骨の幅を示す。抗Sema4D抗体で治療したマウスの骨量の回復は、骨形成が促進した結果であることが分かる。
<用語解説>
- 注1) Semaphorin 4D(セマフォリン フォー ディー:Sema4D)
- 「セマフォリン」は、「セマドメイン」と呼ばれる特徴的なアミノ酸配列を持つ一群のたんぱく質であり、神経線維の行き先を決めるシグナル分子として有名な因子。それぞれのセマフォリンには、特異的に結びつくことができるたんぱく質(受容体)が存在し、細胞と細胞の間での情報の伝達に働き、神経細胞の軸索が伸びる過程に作用することが知られていた。Sema4Dはそのアミノ酸配列の類似性からセマフォリンたんぱく質に属するが、免疫系細胞で初めて同定され、免疫セマフォリンと呼ばれることでも有名な因子。Sema4Dは、Plexin-B1やCD72に結びつくことで、細胞内に情報を伝達する。これまでの知見で、Sema4Dはがんの増殖・転移の促進や免疫系の活性化などにも関与することが分かっている。
- 注2) 破骨細胞
- 骨の表面に存在し、古くなった骨を壊す細胞。複数の細胞が融合したもので複数の核を持つ(多核細胞)。骨の表面を移動しながら、各所で塩酸やたんぱく質分解酵素を放出して骨を溶解・分解し、その分解産物を吸収することで、古い骨を破壊する。この一連の過程を「骨吸収」と呼ぶ。破壊した箇所では、骨芽細胞により新しい骨が形成される。
- 注3) 骨芽細胞(こつがさいぼう)
- 骨の表面に存在し、新しい骨のもととなるたんぱく質を産生・分泌する細胞。破骨細胞が骨を破壊した場所に移動し、骨形成を行うと考えられている。
- 注4) ビスフォスフォネート剤
- 細胞死を誘導することにより、破骨細胞の働きを妨げ、骨吸収を防ぐ薬剤。現在、骨粗しょう症やがんの骨転移にみられる骨病変などの治療薬として使われている。
- 注5) 骨芽細胞の運動能
- 1つの細胞からなる単細胞生物が動き回る能力を持つのと同様に、脊椎動物などの多細胞生物を成す細胞の中にも、自ら動く能力(運動能)を持つものが多くある。骨芽細胞もその1つであり、骨の表面を動き回り、各所で骨の形成を行っている。
<論文名および著者名>
“Suppression of bone formation by osteoclastic expression of Semaphorin 4D”
(破骨細胞におけるSemaphorin 4Dの発現は、骨形成を抑制する)
doi: 10.1038/nm.2489
Takako Negishi-Koga, Masahiro Shinohara, Noriko Komatsu, Haruhiko Bito, Tatsuhiko Kodama, Roland H. Friedel and Hiroshi Takayanagi
<お問い合わせ先>
<研究に関すること>
高柳 広(タカヤナギ ヒロシ)
東京医科歯科大学 大学院医歯学総合研究科 分子情報伝達学 教授
〒113-8549 東京都文京区湯島1-5-45
Tel:03-5803-5471 Fax:03-5803-0192
E-mail:
研究室ホームページ https://osteoimmunology.com/
<JSTの事業に関すること>
金子 博之(カネコ ヒロユキ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: