本研究成果のポイント
- ユビキチン結合タンパク質p62はリン酸化によって選択的オートファジーを促進
- p62タンパク質のリン酸化の亢進により異常タンパク質の細胞内蓄積が減少
- 異常タンパク質蓄積に基づく神経変性疾患の治療にも期待
独立行政法人理化学研究所(野依良治理事長)は、認知症や運動機能障害などを引き起こす神経変性疾患において、神経細胞内で共通してみられる「異常タンパク質」を分解する新たなメカニズムを解明しました。これは、理研脳科学総合研究センター(利根川進センター長)構造神経病理研究チームの貫名信行チームリーダーと松本弦研究員らによる成果です。
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、ハンチントン病注1)などの神経変性疾患に共通する特徴は、神経細胞内に異常タンパク質の蓄積が認められることです。異常タンパク質は細胞毒性注2)を持つため、蓄積すると細胞死を引き起こします。細胞にはプロテアソーム注3)やオートファジー注4)といった、タンパク質を分解するシステムが備わっていますが、それらのシステムを制御するメカニズムはまだよく分かっていません。
研究グループは、異常タンパク質の分解に関与するp62タンパク質(p62)に注目し、p62のアミノ酸配列403番目にあるセリン(S403)がリン酸化されることで、分解するために目印を付加された(ユビキチン注5)化)タンパク質と強く結合することを発見しました。そしてこの複合体は、p62小体注6)を形成し、タンパク質分解システムである選択的オートファジーによって分解されるメカニズムを明らかにしました。実際に、ハンチントン病のモデル細胞では、分解されずに蓄積してしまう毒性のある異常ハンチンチンタンパク質(ハンチントン病の原因タンパク質)が、p62のS403リン酸化を促進させることで顕著に減少することが確認できました。細胞内異常タンパク質の蓄積によって引き起こされる他の神経変性疾患においても、S403のリン酸化を促進させることで、発症抑制の可能性が期待できます。
本研究成果は、JST戦略的創造研究推進事業チーム型研究「CREST」の「精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出」研究領域(研究総括:独立行政法人国立精神・神経医療研究センター樋口輝彦総長)における研究課題「ポリグルタミン病の包括的治療法の開発(研究代表者:貫名信行)」、文部科学省脳科学研究戦略推進プログラム(課題E:水澤英洋拠点長)の一環として行われ、米国の科学雑誌『Molecular Cell 』(10月号)に掲載されるのに先立ち、オンライン版(10月20日付け:日本時間 10月21日)に掲載されます。
1.背景
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、ハンチントン病などの神経変性疾患に共通する特徴は、神経細胞内に凝集した異常タンパク質の蓄積です。異常タンパク質は細胞毒性を持つため、神経細胞変性や細胞死を引き起こします。細胞にはプロテアソームやオートファジーといった、異常タンパク質を分解し細胞内から除去するためのシステムが備わっていますが、それらを制御するメカニズムについてはまだよく分かっていません。ほとんどの異常タンパク質は、ユビキチン化によって目印がつけられプロテアソームで分解されますが、プロテアソームは凝集した異常タンパク質を壊すことができません。分解できなかった異常タンパク質は選択的オートファジーにより分解されると考えられています。神経変性疾患における神経細胞では、ユビキチン化された異常タンパク質の凝集体が蓄積していることから、選択的オートファジーによる異常タンパク質の分解機構に問題があるのではないかと考えられます。
研究グループは2004年にハンチントン病を含むポリグルタミン病の主要な病理所見である核内封入体注7)(核内に凝集した異常タンパク質)に結合するタンパク質を探索し、p62タンパク質(p62)を同定しました。異常タンパク質の蓄積やプロテアソームの阻害でp62の発現が増加することが明らかとなり、p62が異常タンパク質の分解に関与していることが示唆されました。また最近の研究で、オートファジーによるタンパク質分解システムが阻害されると、p62が核内封入体として蓄積することや、異常タンパク質の蓄積を伴う神経変性疾患の患者の脳組織でp62の蓄積がみられることが報告されています。そこで、研究グループは、p62の機能に着目し、異常タンパク質の分解メカニズムの解明に挑みました。
2.研究手法と成果
研究グループは、リン酸化などの翻訳後修飾によってp62の機能が制御されていると考え、質量分析によりp62の修飾部位を同定しました。するとp62は多くの部位でリン酸化を受けていることが分かりました(図1A)。次に、これらのリン酸化部位に対する特異的な抗体を作成し、プロテアソームとオートファジーのそれぞれの阻害によってリン酸化が顕著に増加するアミノ酸配列403番目のセリン残基(S403)を同定しました(図1B)。このS403のリン酸化は脱リン酸化酵素の阻害によって増加することから、細胞内ではS403リン酸化型p62と非リン酸化型p62が平衡状態で共存していることが示唆されました(図1C)。
さらに、オートファジーを遺伝的に欠失したATG5ノックアウトマウスでは、ユビキチン化タンパク質とp62が異常に蓄積することが知られていましたが、ATG5ノックアウトマウスの神経細胞を組織染色すると、S403リン酸化型p62が核内封入体に蓄積していることが分かりました(図2)。試験管内リン酸化反応によってこのS403をリン酸化する酵素がカゼインキナーゼ2(CK2)であることを同定し、CK2が直接p62のS403をリン酸化することを確認しました。また、このCK2を細胞内で過剰発現させるとS403リン酸化型p62が増加すると同時にp62の全体量が減少することが分かり、選択的オートファジーによって異常タンパク質とともにS403リン酸化型p62の分解が促進されることが示唆されました。
p62は細胞内でp62小体と呼ばれる顆粒状の構造体を形成することが知られていますが、S403リン酸化型p62が蓄積する場所を特定するために、蛍光タンパク質で標識して観察したところ、p62小体内に局在することが分かりました(図3A)。またS403がリン酸化された状態に似せたp62変異体(S403E変異体)を細胞で発現すると、野生型と比べてより多くのp62小体を形成しました。さらに、S403E変異体のp62小体はより多くのユビキチン化タンパク質を取り込んでいることや(図3B)p62のS403リン酸化でユビキチン化タンパク質との結合力が増強されることを明らかにしました。これらの実験結果から、S403リン酸化型p62がユビキチン化タンパク質と結合してp62小体を形成し、選択的オートファジーのシステムを利用して異常タンパク質の分解を行っていることが示唆されました。
神経変性疾患ではユビキチン化された異常タンパク質が細胞内に蓄積しています。従って、p62のS403リン酸化を促進することで選択的オートファジーを亢進することができれば、異常タンパク質を効率よく分解し疾患の治療につながることが期待できます。その可能性を探るため、研究グループは、ハンチントン病の病因遺伝子であるハンチンチンの一部を発現したモデル細胞において、p62のS403リン酸化を促進させた場合の異常ハンチンチンの蓄積の変化を調べました。その結果、CK2の過剰発現でS403リン酸化を促進させると、異常ハンチンチンの凝集体が顕著に減少し、またp62の発現を抑えるとこの効果は抑制されることが分かりました(図4)。このことは、p62のS403リン酸化の促進により、細胞毒性を持つ異常タンパク質を選択的に除去できる可能性を示しています。
以上の結果から研究グループは、細胞内のp62はリン酸化型と非リン酸化型が平衡状態で共存し、S403リン酸化型p62はプロテアソームで壊すことができないユビキチン化タンパク質と強く結合してp62小体を形成し、選択的オートファジーで最終的に分解する「タンパク質の品質管理」の新たな制御メカニズムを提唱しました(図5)。
3.今後の期待
今回の結果から、p62のS403リン酸化を特異的に促進する薬剤を開発することができれば、選択的オートファジーを亢進させ異常タンパク質を効率よく分解できることが期待できます。ハンチントン病だけでなく、異常タンパク質の細胞内蓄積を特徴とするアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症などの神経変性疾患の治療への応用も期待できます。
<補足説明>
- 注1) ハンチントン病
- 主に中年以降に発症する常染色体優性遺伝の遺伝性慢性進行性の疾患。臨床症状は主に不随意運動で、知能障害、精神症状を伴う。1983年にハンチントン病遺伝子が第4染色体短腕に存在することが示され、1993年にその原因遺伝子(ハンチンチン遺伝子)が同定された。この原因遺伝子の一部の塩基配列に存在するCAG繰り返し配列が正常より長いために引き起こされる。CAG繰り返し配列が翻訳されるとグルタミン鎖となり、正常より長くなったグルタミン鎖を病因にもつ疾患群をポリグルタミン病と呼ぶ。
- 注2) 細胞毒性
- 細胞内外に蓄積する異常タンパク質は細胞の機能を障害し死に至らしめる毒性を持つ。細胞内でも核内か細胞質に蓄積するかによってその毒性の機序は異なると考えられる。この異常タンパク質の蓄積を防ぐことにより、細胞毒性や神経の変性を抑えることが疾患の発症を予防するために必要である。
- 注3) プロテアソーム
- 細胞質や核内に分布しているタンパク質を分解する巨大な酵素複合体。ポリユビキチン鎖により標識された変性タンパク質を選択的に分解する。大きなタンパク質複合体や凝集したタンパク質などは分解できない。
- 注4) オートファジー
- 細胞が自らの細胞内成分を分解する主要メカニズム。細胞内のオルガネラや安定なタンパク質などの細胞質成分をオートファゴソーム(小胞)へとりこみ、リソソームで分解する。p62などの特定のタンパク質によって働くオートファジーを選択的オートファジーという。
- 注5) ユビキチン
- ユビキチンは他のタンパク質の修飾に使われるタンパク質。タンパク質分解、DNA修復、翻訳調節、シグナル伝達などさまざまな生命現象に関わる。ユビキチン化とはタンパク質修飾の一種で、ユビキチンリガーゼなどの働きによりユビキチンタンパク質が基質タンパク質に付加されること。ユビキチンが複数連なったポリユビキチン鎖の修飾を受けたタンパク質は、通常選択的にプロテアソームで分解される。
- 注6) p62小体
- p62が形成する細胞内の顆粒構造体。脂質膜を持たないセクエストソームとp62を含むオートファゴソーム、オートファゴソームがリソソームと融合したオートリソソームの異なる構造体の総称。それらすべての構造体の中にp62が含まれるが、形態的にそれらを光学顕微鏡下で区別できないため、p62を含む顆粒構造全てを含む。
- 注7) 核内封入体
- 一般に光学顕微鏡で可視できるタンパク質凝集体を封入体という。アルツハイマー病における神経原線維変化、パーキンソン病のレビー小体などは細胞質封入体である。ポリグルタミン病は、疾患遺伝子産物の伸長ポリグルタミン(正常より長くなったグルタミン)を含むタンパク質が核内に蓄積し、核内封入体を形成することが特徴である。
<参考図>
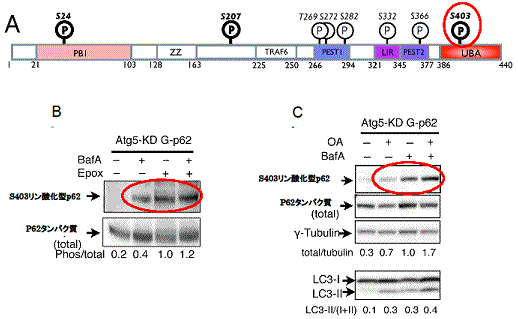
図1 p62の機能はリン酸化による制御を受けている
- A:今回同定したp62アミノ酸配列のリン酸化部位(図中P部分)。P(太字)部位はプロテアソーム阻害で増加する。S403はユビキチン結合部位に存在する。
- B:S403リン酸化されたp62タンパク質はオートファジー(BafA)またはプロテアソーム(Epox)によるタンパク質分解を阻害した場合に増加する。
- C:S403のリン酸化は脱リン酸化酵素の阻害(OA+)によっても増加することから、p62はS403リン酸化型と非リン酸型が平衡状態であると考えられる。
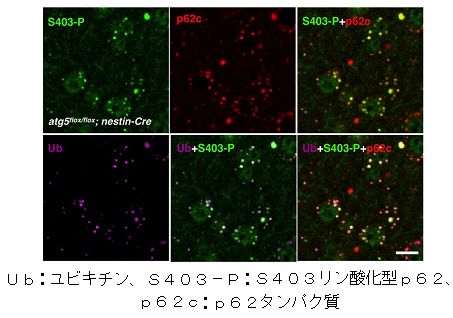
図2 オートファジー欠損マウスの神経細胞に蓄積する封入体は
S403リン酸化型p62を含む
オートファジーを遺伝的に欠損させたATG5ノックアウトマウスの脳では、ユビキチンとp62を含む封入体が神経細胞内に蓄積することが知られている。(左下図紫色、中央上図赤色)S403リン酸化型p62(左上図緑色)と重ねると色が交わることからS403リン酸化型p62は封入体に含まれていることが分かる(右下図ピンク色)。
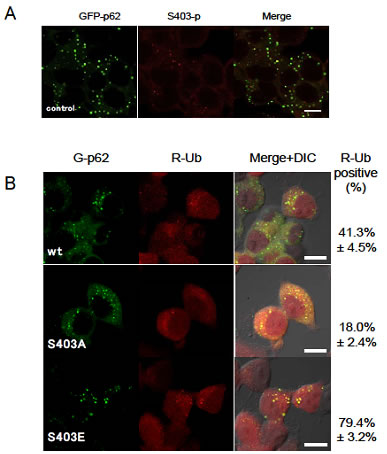
図3 S403リン酸化型p62はp62小体に局在し、
ユビキチン化タンパク質を隔離する
- A:p62を緑色で可視化(GFP-p62)した。p62は顆粒状のp62小体を形成する。(左図緑色)。S403リン酸化型p62(中央図赤色)と重ねると色が重なり(右図)、S403リン酸化型p62はp62小体に局在していることが分かる。
- B:緑色で可視化したp62(G-p62)と赤色で可視化したユビキチン(R-Ub)細胞を作製した(左、中央図)。S403がリン酸化された状態に似せたS403E変異体(つまりS403リン酸化型p62が過剰発現した状態に似ている)では、ユビキチンがp62小体に蓄積しているが(右下図:黄色)、S403がリン酸化されないS403A変異体(つまりS403非リン酸化型p62が過剰に発現した状態)ではユビキチンが蓄積しているp62小体はあまり見られない(中央右図)。
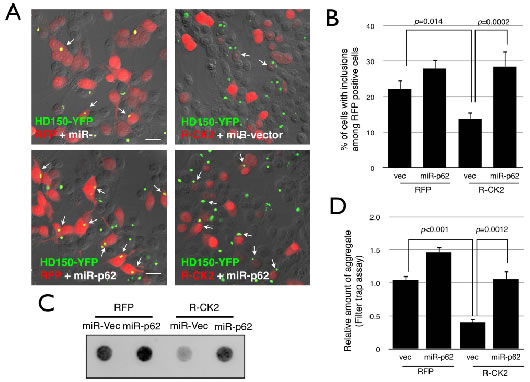
図4 S403リン酸化型p62の促進により異常タンパク質を選択除去できる
- A、B:黄色蛍光タンパク質で可視化したグルタミン150回リピートのハンチンチンエクソン11
(HD150-YFP)を発現させた細胞に赤色蛍光タンパク質で可視化したCK2(RFP-CK2)の遺伝子を導入した。異常なHD150-YFPタンパク質は細胞内で凝集体を作るが(A左上図:黄色)、RFP-CK2発現細胞では、HD150-YFPの凝集体をもつ細胞が少なく(A右図)、この効果はp62の発現を抑制すると見られなくなる(A左下図)。
- C、D:凝集したHD150-YFPタンパク質の量を調べると、RFP-CK2を過剰発現した細胞では、有意に分解が促進していた。またp62の発現をRNAレベルで抑制する(miR-p62)とCK2のHD150-YFPタンパク質の凝集抑制効果は消失した。
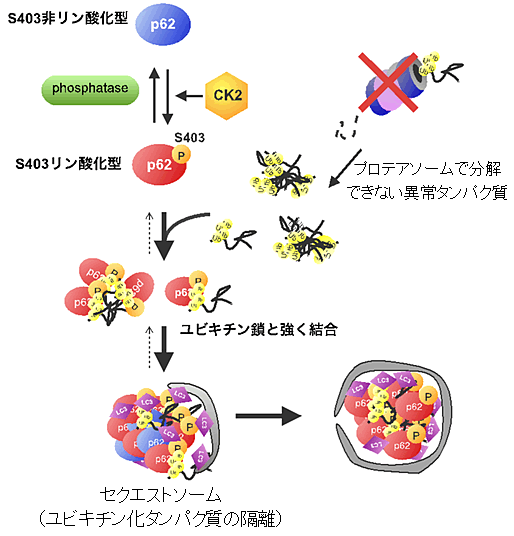
図5 p62のリン酸化による選択的オートファジーの制御機構
p62は細胞内においてS403リン酸化型とS403非リン酸化型の平衡状態で存在する。リン酸化型p62はユビキチン鎖と強く結合し、ユビキチン化タンパク質をセクエストソームへ運ぶ。セクエストソームはオートファゴソームに取り込まれ、セクエストソームに隔離されていたユビキチン化タンパク質は、選択的オートファジーにより分解される。
<原著論文情報>
Gen Matsumoto, Koji Wada, Misako Okuno, Masaru Kurosawa, and Nobuyuki Nukina
“Serine 403 phosphorylation of p62/SQSTM1 regulates selective autophagic clearance of ubiquitinated proteins” Molecular Cell 2011 doi: 10.1016/j.molcel.2011.07.039
<報道担当・問い合わせ先>
(研究に関すること)
独立行政法人理化学研究所
脳科学総合研究センター 構造神経病理研究チーム チームリーダー
貫名 信行(ヌキナ ノブユキ)
TEL:048-467-9702 FAX:048-462-4796
E-mail:
独立行政法人理化学研究所
脳科学総合研究センター 構造神経病理研究チーム 研究員
松本 弦(マツモト ゲン)
TEL:048-462-1111 FAX:048-462-4796
E-mail:
(JSTの事業に関すること)
独立行政法人科学技術振興機構
イノベーション推進本部 研究領域総合運営部
石井 哲也(イシイ テツヤ)
TEL:03-3512-3524 FAX:03-3222-2064
(脳科学研究戦略推進プログラム事業に関すること)
脳科学研究戦略推進プログラム 事務局
TEL:0564-55-7803 FAX:0564-55-7805
(報道担当)
独立行政法人理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
独立行政法人科学技術振興機構 広報ポータル部
TTEL:03-5214-8404 FAX:03-5214-8432