JST 課題達成型基礎研究の一環として、東京大学 大学院医学系研究科の谷口 維紹 教授と柳井 秀元 助教らは、核酸を認識する多くの受容体の働きを一度に阻害して、免疫反応を抑制するオリゴ核酸「ISM ODN注1)」を開発しました。
DNAやRNAといった核酸による免疫反応の活性化は、ウイルスや細菌などの病原体に対する生体防御応答に重要です。しかし、自己免疫疾患においては、自己由来の核酸によって免疫反応が活性化され、病態をさらに悪化させてしまいます。また、敗血症などの過度の炎症では、細胞死が起きることにより、細胞内の核酸が外部に放出され、さらに炎症反応を促進してしまいます。これらの反応を抑制するためには、核酸を認識する受容体の働きを抑えることが考えられますが、核酸を認識する受容体が複数あるため、これを一度に抑えられる阻害剤はこれまでありませんでした。
本研究グループはこれまでに、あらゆる核酸による免疫反応の活性化には、核酸の監視役であるHMGBたんぱく質注2)が必須であることを見いだしていました。その知見をもとに、本研究ではHMGBたんぱく質に強く結合するISM ODNを開発しました。また、ISM ODNがさまざまな核酸による免疫反応を抑制することが分かりました。さらに、マウスを用いた多発性硬化症注3)や敗血症注4)のモデル動物での実験を行い、ISM ODNが実際にこれらの病態モデル動物の発症を抑制することも明らかにしました。
今回開発したISM ODNに類似した化合物や、HMGBたんぱく質にさらに強く結合する化合物を開発することは、将来、自己免疫疾患や敗血症などの治療に役立つものと期待されます。
本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で2011年6月27日の週(米国東部時間)に公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長) |
| 研究課題名 |
「核酸を主体とした免疫応答制御機構の解明とその制御法の開発」 |
| 研究代表者 |
谷口 維紹(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成21年11月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とする人間の免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、核酸に対する自然免疫応答のしくみや関与する物質を明らかにすることで、感染防御や自己免疫疾患における免疫応答の制御法の確立を目指します。
<研究の背景と経緯>
自己免疫疾患では、自分のDNAやRNAといった核酸や、炎症などに伴って起きる細胞死によって放出される核酸が抗原として免疫系によって認識されて、免疫を活性化し、病状を悪化させることが知られています。症状を治療・軽減するために、この反応を抑制する仕組みが望まれています。これまでは各種の核酸に特異的な個々の受容体が免疫系に備わっていることが分かっていました。しかし、まだ見つかっていない受容体もあり、個々の受容体に対する阻害剤で全ての反応を抑えるのは困難で、またその仕組みがあるかどうかも分かっていませんでした。
<研究の内容>
本研究グループは最近、HMGBたんぱく質が核酸に対する万能な監視役として機能し、HMGBたんぱく質と核酸の結合が免疫系の活性化に必須であることを突き止めました(図1)。そこで、この万能な受容体であるHMGBたんぱく質を阻害することができれば、核酸による反応を抑制することができるのではないかと考えました。HMGBたんぱく質は核酸と結合することが分かっていたので、この性質を利用し、HMGBたんぱく質とは強く結合し、かつ免疫系を活性化しないよう核酸の配列を工夫したオリゴ核酸ISM ODNを作製しました(図2)。ISM ODNは、HMGBたんぱく質と強く結合することで、さまざまな種類の核酸によって活性化されるI型インターフェロン(IFN-α/β)注5)をはじめ、炎症性サイトカイン注6)の産生を強く抑制することが分かりました(図3)。この抑制にはISM ODNが20塩基以上の長さであること、その塩基配列は重要ではないこと、また、リン酸基の骨格が通常のDNAやRNAのようなホスホジエステル結合注7)ではなく、ホスホロチオエート結合注7)である必要があることも分かりました。さらに、ISM ODNは細胞内でエンドソームやリソソーム注8)と呼ばれる細胞内小器官に局在することも分かりました(図4)。このことはISM ODNがエンドソームやリソソームでHMGBたんぱく質と結合して、核酸によって活性化される免疫反応を抑制しているということを示しているものと考えられます。
そしてISM ODNによる抑制作用は樹状細胞注9)のような抗原提示細胞でも起きていました。ISM ODNをマウスに投与しておくと、核酸によって活性化されるCD8陽性T細胞や、B細胞によるIgG1などの抗体産生が抑制されることも明らかとなりました(図5)。これらのことはISM ODNが細胞レベルのみならず、マウス個体レベルでも作用するということを示しています。そこで本研究グループは、ISM ODNが自己免疫疾患や炎症の症状を抑えることができるのかどうか検討を行いました。その結果、自己免疫疾患の1つである多発性硬化症モデルや敗血症モデルにおいて、ISM ODNがこれらの病態を強く抑制する効果があることが分かりました(図6)。ISM ODNがHMGBたんぱく質に強く結合してしまうことで、自己のDNAやRNAによって活性化される免疫反応を抑制した結果、これらの症状が抑えられたと考えられます。
<今後の展開>
今回、核酸による免疫系の活性化において万能な監視役であるHMGBたんぱく質に強く結合するISM ODNが、核酸による免疫反応を強く抑制することが明らかになりました。今回は明らかにできませんでしたが、HMGBたんぱく質の一種であるHMGB1たんぱく質は炎症などの反応において細胞外に放出され、炎症性サイトカインとして作用することも知られており、ISM ODNはこのHMGB1たんぱく質の作用を抑えている可能性もあります。今後これらの詳細を明らかにし、ISM ODNやその類似物など、HMGBたんぱく質を標的とした、より良い阻害剤を開発することにより、自己免疫疾患や敗血症などに対する新たな治療法につながるものと期待されます。
<参考図>
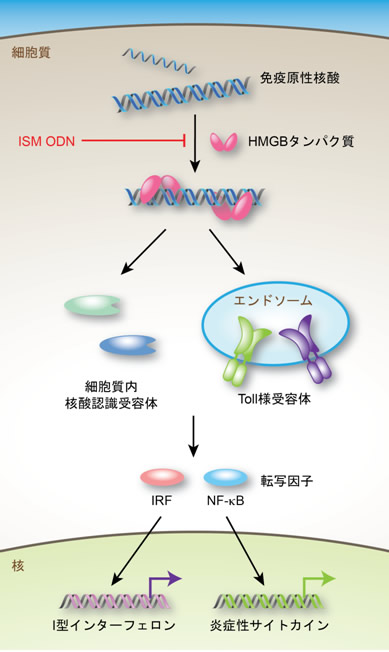
図1 自然免疫系における核酸認識モデル
細胞内に取り込まれた免疫系を活性化する核酸は、万能な核酸センサーであるHMGBたんぱく質と結合する。HMGBたんぱく質・核酸複合体は、エンドソームに局在するToll様受容体や細胞質内核酸認識受容体と結合して、下流のシグナル伝達経路を活性化する。これによって転写因子であるIRFやNF-κBが活性化され、I型インターフェロンや炎症性サイトカインなどの遺伝子を発現誘導する。本研究では、このモデル中のHMGBたんぱく質をターゲットとしており、それ自身では免疫系を活性化することのないISM ODNを用いてHMGBたんぱく質を介した免疫反応を阻害している。

図2 HMGBたんぱく質とISM ODNの結合
リコンビナントHMGBたんぱく質(HMGB1、HMGB2、HMGB3)と、可視化させるためにビオチン化したISM ODNを用いプルダウンアッセイ(共沈実験)を行った。競合物として、ビオチン化していないISM ODNを2、4、8μMの濃度で加えた。競合物であるISM ODNの量が増えるほど、HMGBたんぱく質と共沈するビオチン化したISM ODNの量が減っており、HMGBたんぱく質とISM ODNが結合していることが分かる。
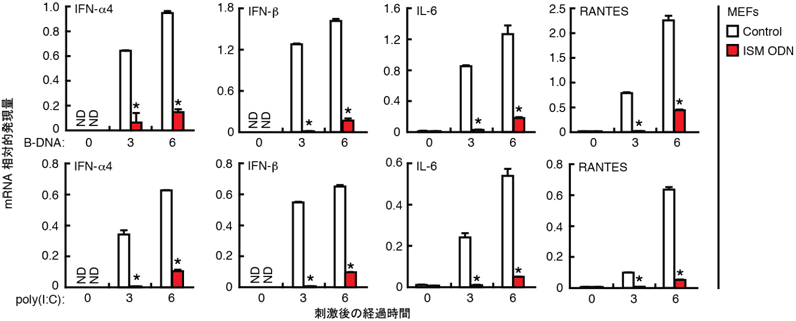
図3 核酸による免疫応答活性化におけるISM ODNの抑制効果
未処理(Control)あるいはISM ODN(1μM)で1時間前処理したマウス胎児線維芽細胞(mouse embronic fibroblast:MEF)を、代表的な核酸であるB-DNA(5μg/mL)またはpoly(I:C)(5μg/mL)で3あるいは6時間刺激した。図中に示したサイトカイン遺伝子のmRNA発現量は定量的RT-PCR法によって解析した。★印は対照(Control)と比較してP<0.01であることを示している。データは標本数3における平均値と標準偏差を表しており、NDは不検出であったことを示す。ISM ODNによって前処理することで、B-DNAやpoly(I:C)の刺激による炎症性サイトカインの産生が抑制されており、ISN ODNが免疫反応を抑制することが分かる。
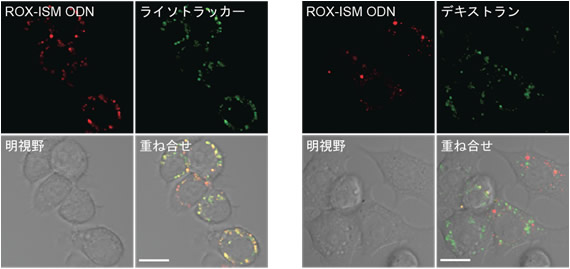
図4 ISM ODNの細胞内局在
RAW264.7細胞を可視化のためローダミン付加したISM ODN(ROX-ISM ODN、赤色)(1μM)で1時間刺激した。この時、リソソームのマーカーであるライソトラッカー(左図、緑色)、またはエンドソームやリソソームのマーカーであるデキストラン(右図、緑色)を加えた。共焦点蛍光顕微鏡によって観察を行った。スケールバーは10μmを表す。重ね合わせで黄色になっている部分は、ISM ODNがリソソームやエンドソームに局在していることを示している。
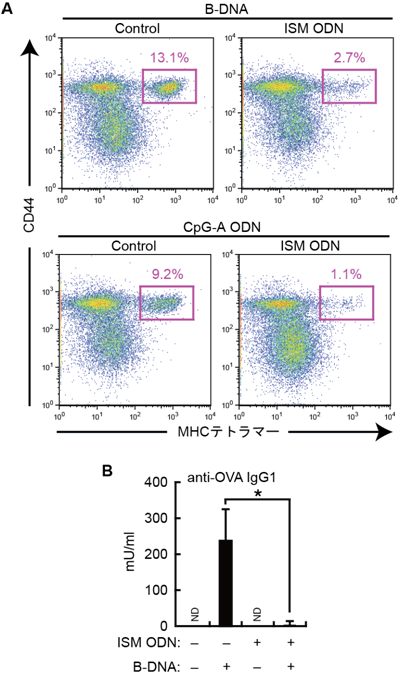
図5 核酸を介した免疫応答に対するISM ODNのin vivoにおける抑制効果
- (A) マウスをオボアルブミン(OVA)たんぱく質(0.5mg)で免疫し、補助活性化剤としてB-DNA(10μg)またはCpG-A ODN(50μg)を投与した。ISM ODN(1mg)の同時投与のあり・なし(Control)について、免疫後6日に脾臓細胞を調製し、フローサイトメーターで解析した。数値はCD8α陽性T細胞のうち、CD44陽性、OVA特異的MHCクラスIテトラマー陽性T細胞の割合(%)を示している。OVAと共にB-DNAやCpG-A ODNを投与した場合OVA特異的CD8α陽性T細胞が検出されるが、ISM ODNの投与によってその割合が減少し、免疫反応が抑制されていることが分かる。
- (B) マウスをOVAたんぱく質(50μg)とB-DNA(10μg)で免疫し、ISM ODN(0.5mg)の同時投与の有無について、OVA特異的IgG1の産生をELISAで測定した。★印はP<0.01であることを示している。データは標本数3における平均値と標準偏差を表しており、NDは不検出であったことを示す。OVAと共にB-DNAを投与するとB細胞によって抗OVA抗体が産生されるが、ISM ODNの投与によって抗体産生が抑制されていることが分かる。
これらのことはB-DNAやCpG-A ODNといった核酸はHMBGたんぱく質と結合することで、樹状細胞のような抗原提示細胞の免疫反応を活性化させるが、ISM ODNは抗原提示細胞を介した免疫反応も抑制することを示している。
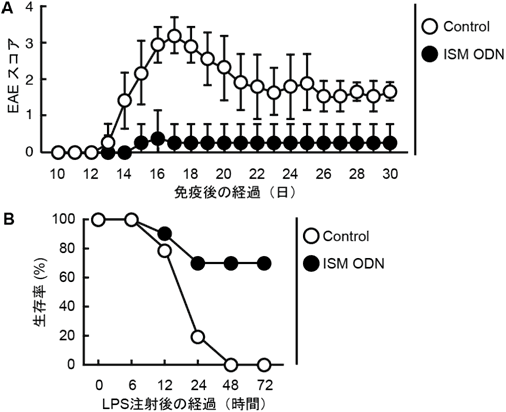
図6 自己免疫疾患および敗血症モデルに対するISM ODNの発症抑制効果
- (A) 実験的自己免疫性脳脊髄炎(EAE)モデルにおいて、対照群(Control)またはISM ODNを投与したマウスのEAEスコアの平均値と標準偏差を示す。EAEスコアは、0:無症状、1:尾の緊張の低下、2:後肢運動低下、3:後肢不完全麻痺、4:後肢完全麻痺、5:四肢麻痺とした。
- (B) ISM ODN(0.1μg)を1時間前に投与したマウスと投与していないマウス(Control)に対し、LPS(1.25mg)を注射し、72時間後までの生存率(%)を調べた。
ISM ODNの投与によってEAEや敗血病の発症が抑制できることが分かる。
<用語解説>
- 注1) ISM ODN(immuno suppressive oligodeoxynuclotide mutated in CpG sequence)
- Toll様受容体9(TLR9)のリガンドである、CpG-Bをもとに塩基配列を改変した20塩基の短いDNA。DNAやRNAなどの核酸のうち、数十塩基対までの短いものは、オリゴ核酸と呼ばれる。TLR9のリガンドにはほかにCpG-Aがある。CpG-Aは、形質細胞様樹状細胞と呼ばれる樹状細胞の一種に大量のI型インターフェロンを産生させることが知られている。CpG-Bにはこのようなインターフェロン産生能はなく、他の炎症性サイトカインの産生を引き起こす。
- 注2) HMGBたんぱく質(high mobility group boxたんぱく質)
- DNA結合ドメイン(HMGBドメイン)を2つ有しており、互いに高い相同性を示すHMGB1、HMGB2、HMGB3の3種類があることが知られている。細胞死や刺激などにより細胞外に放出され、炎症性サイトカインとして機能することも知られている。
- 注3) 多発性硬化症
- 有髄神経を取り巻く髄鞘という組織が失われるという脱随疾患で、脳や中枢神経が炎症により脱随し、しびれや運動障害がみられる。マウスモデルとして実験的自己免疫性脳脊髄炎(EAE)が知られている。
- 注4) 敗血症
- 敗血症は感染が引き金になって発症することが多く、全身性の炎症反応を示す。病原性のリポ多糖(LPS)はエンドトキシンとも呼ばれ、マウスなどに投与した場合、エンドトキシンショックや敗血症性ショックと呼ばれる症状を引き起こすことが知られている。
- 注5) I型インターフェロン(IFN-α/β)
- ウイルスに感染した際に細胞から分泌されるサイトカインの一種。インターフェロンαとインターフェロンβがあり、抗ウイルス、抗がん作用を示すことが知られている。
- 注6) 炎症性サイトカイン
- 病原体の生体内への侵入があった際、免疫系は発熱などの炎症反応を誘導することにより病原体を排除する。この炎症反応の原因となるサイトカインを炎症性サイトカインと呼ぶ。
- 注7) ホスホジエステル結合、ホスホロチオエート結合
- DNAやRNAなどに含まれる、通常のホスホジエステル結合のリン酸基の酸素原子が硫黄原子に置換されているものをホスホロチオエート結合と言う。
- 注8) エンドソーム、リソソーム
- エンドソームは細胞外の分子の取り込みや、細胞表面の分子の分類に関わる。エンドソームに取り込まれた一部の分子は再利用され、不要な分子はエンドソームがリソソームと融合することで分解される。リソソームは生体膜に包まれた構造体で細胞内消化の場であり、内部に加水分解酵素を持ち、膜内に取り込まれた生体高分子はここで加水分解される。分解された物体のうち有用なものは、細胞質に吸収される。
- 注9) 樹状細胞
- 病原体を認識してサイトカインを放出するほか、T細胞に病原体由来の抗原を提示し、抗原特異的なT細胞を活性化する働きをすることが知られている。
<論文名>
“Suppression of immune responses by nonimmunogenic oligonucleotides with high-affinity for HMGB proteins”
(HMGBたんぱく質に強い結合性を示す非免疫原性核酸による免疫応答の抑制)
doi: 10.1073/pnas.1108535108
<お問い合わせ先>
<研究に関すること>
谷口 維紹(タニグチ タダツグ)
東京大学 大学院医学系研究科 免疫学講座 教授
柳井 秀元(ヤナイ ヒデユキ)
東京大学 大学院医学系研究科 免疫学講座 助教
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3373(教授室)/03-5841-3378(助教室) Fax:03-5841-3450
E-mail:
<JSTの事業に関すること>
石井 哲也(イシイ テツヤ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: