JST 課題解決型基礎研究の一環として、京都大学 大学院医学研究科の岩田 想 教授、島村 達郎 特定講師、小林 拓也 講師らは、花粉症の薬の標的である「ヒスタミンH1受容体(H1R)」の立体構造をX線結晶構造解析注1)によって解明しました。
花粉症をはじめとするアレルギー疾患は、花粉などの異物に免疫機能が過剰に反応することが原因です。アレルギー症状が起こるメカニズムは複雑ですが、花粉症やアレルギー症状は、花粉などの刺激で体内にあるヒスタミン注2)などの炎症物質が飛び出し、それらが受容体と呼ばれる膜たんぱく質(Gたんぱく質共役型受容体(GPCR)注3))に結合することで引き起こされます。花粉症の薬として知られている抗ヒスタミン薬は、ヒスタミンが受容体H1Rに結合するのをブロックすることで花粉症の症状を抑制します。しかし、抗ヒスタミン薬は、H1R以外の受容体にも結合しやすいため、眠気や口渇、不整脈などの副作用を引き起こす場合があります。そのため、副作用を抑えたより効果的な抗ヒスタミン薬の開発に向けて、H1Rの立体構造の解明が有効な手段として期待されていました。
本研究では、H1Rの立体構造を世界で初めて明らかにしました。また、H1Rと抗ヒスタミン薬の複合体の立体構造から、抗ヒスタミン薬の結合様式や、H1Rに特有なアミノ酸に囲まれた薬剤結合部位の存在も明らかにしました。
本研究により、分子レベルで薬の標的の「形」が明らかになったことで、今後、その立体構造情報をもとに、より効果的で副作用の少ない花粉症・アレルギー疾患の治療薬の探索・設計が可能となるものと期待されます。
本研究は、九州大学の白石 充典 助教、米国・スクリプス研究所のレイモンド・スティーブンス 教授
と共同で行われ、本研究成果は、2011年6月22日(英国時間)に英国科学雑誌「Nature」のオンライン速報版で公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
「岩田ヒト膜受容体構造プロジェクト」 |
| 研究総括 |
岩田 想(京都大学 大学院医学研究科 教授) |
| 研究期間 |
平成17~22年度 |
JSTはこのプロジェクトで、構造解析の極めて困難な疎水的な膜たんぱく質であるヒト膜受容体の構造解析において、膜受容体の精製・結晶化の普遍的な技術を確立し、ヒト膜受容体構造解析を系統的に行う技術の確立を目指します。
<研究の背景と経緯>
近年、多くの日本人がかかっているスギ花粉症は、国民病とも呼ばれ、花粉症による経済的損失は年間数千億円にも及ぶと言われます。花粉症をはじめとするアレルギー疾患は、花粉などの異物に免疫機能が過剰に反応することが原因で起こる疾患です。くしゃみや鼻水などのアレルギー症状は、体内に侵入した花粉などを異物と認識し、ヒスタミンなどの炎症物質を放出し、それらが神経や血管細胞にあるヒスタミン受容体と呼ばれるGPCRに結合することで引き起こされます。
花粉症やアレルギーの治療薬として知られる抗ヒスタミン薬は、ヒスタミンがH1Rに結合する作用を阻害することで花粉症などのアレルギー症状を抑制しますが、眠気や口渇、不整脈といった副作用を引き起こすものがあります。このような副作用は、抗ヒスタミン薬が脳に移行しやすいことや、H1R以外のアミン受容体注4)にも結合しやすいことなどが原因です。そのため、より選択性が高く、強い効果を持つ抗ヒスタミン薬を開発するためには、H1Rの立体構造を明らかにする必要がありました。
一方で、膜たんぱく質であるH1Rは、可溶性の細胞内のたんぱく質と異なり、立体構造を明らかにするために必要なたんぱく質の精製や結晶化が非常に困難なため、これまで立体構造が解明されていません。そこで本研究では、より副作用の少ない抗ヒスタミン薬の探索・設計のために必要なH1Rの構造情報を得ることを目的に、H1Rの立体構造の解明を試みました。
<研究の内容>
本研究では、まず、人が持つH1R遺伝子を合成し、酵母を用いてH1Rを大量に発現・精製するための技術を構築しました。H1Rは、膜たんぱく質の結晶化で効果をあげているLipidic cubic phase法注5)を用いて結晶化を行い、X線結晶構造解析によって抗ヒスタミン剤の一種であるドキセピン注6)とH1Rの複合体の立体構造を解明しました(図1a)。
H1Rの全体構造は、これまでに構造が決定されているGPCRと同様に7本の膜貫通したらせん構造のヘリックスを持ち、H1Rとともにアミン受容体ファミリーに属すβ2アドレナリン受容体(図1b)やドーパミンD3受容体(図1c)とよく似た構造でした。ドキセピンは、H1R以外のアミン受容体でも保存されているアミノ酸に囲まれていました(図2a)。このことは、ドキセピンが他のアミン受容体にもよく結合する原因の1つであることを示しています。また、ドキセピンが結合している部位の近くに、H1R特有のアミノ酸と相互作用しているリン酸イオンが結合していました(図2b)。
次にH1Rの立体構造情報を利用して、抗ヒスタミン薬の中で第二世代と呼ばれ、H1Rへの結合選択性が高いレボセチリジン注7)やフェキソフェナジン注8)とH1Rの複合体構造を、コンピューターを用いて計算しました(図3)。それらの計算結果から得られたモデルでは、これらの薬剤のカルボキシル基が上述のリン酸イオンと同等の位置に存在し、H1R特有のアミノ酸と相互作用していました。このような結果から、レボセチリジンやフェキソフェナジンのH1Rへの結合選択性の高さは、H1Rに特有のアミノ酸とカルボキシル基との相互作用が原因であることが示唆され、抗ヒスタミン薬のH1Rへの結合選択性は、H1R特有のアミノ酸との相互作用が重要な役割を担うことが明らかになりました。
<今後の展開>
創薬分野では近年、たんぱく質の立体構造をもとにした創薬戦略(Structure-Based Drug Design)が進められています。特に、人が持つ受容体は創薬のターゲットとして注目されており、これらの受容体の立体構造を明らかにすることで、より効果的な薬剤の設計が可能になると期待されています。
本研究結果からH1Rの立体構造が明らかになり、抗ヒスタミン薬の結合部位の詳細情報を得ることができました。これらの立体構造の情報をもとに、今後、副作用を抑えた抗ヒスタミン薬の探索・設計が可能になると考えられ、花粉症やアレルギー症の治療薬への貢献が期待されます。
<参考図>
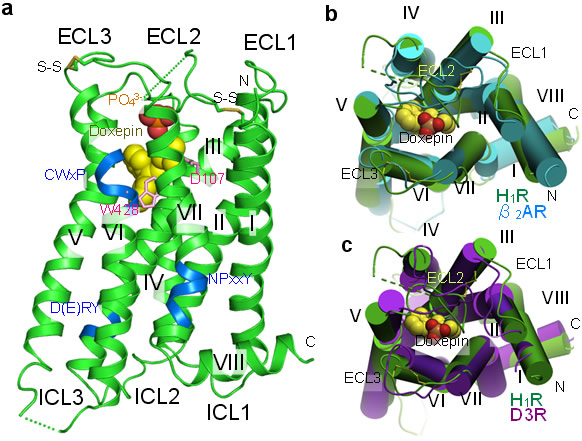
図1 H1Rとドキセピン複合体の立体構造
- a) 全体構造。ドキセピンを黄色で、リン酸イオンの炭素原子をオレンジ色、酸素原子を赤色で表示している。
- b) H1Rの構造(緑色)とβ2アドレナリン受容体(水色)を比較したもの。
- c) H1Rの構造(緑色)とドーパミンD3受容体(紫色)を比較したもの。H1Rは、同じアミン受容体であるβ2アドレナリン受容体やドーパミンD3受容体と、全体構造がよく似ている。
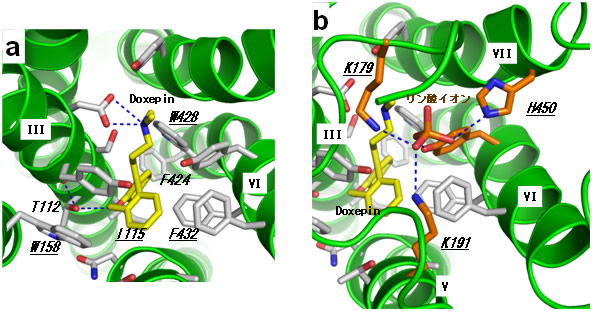
図2 リガンド結合部位の様子
- a) ドキセピン(黄色)と周囲のアミノ酸(灰色)の相互作用。周囲のアミノ酸のほとんどのものがアミンの受容体で高度に保存されている。
- b) リン酸イオンと周囲のアミノ酸の相互作用。K179、K191、H450は、H1Rに特有のアミノ酸である。
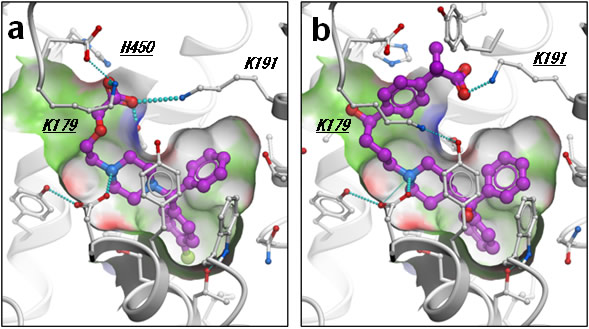
図3 H1RとH1R選択性の高い薬剤との結合モデル
- a) H1Rとレボセチリジン複合体のモデル構造。
- b) H1Rとフェキソフェナジン複合体のモデル構造。これらの薬剤のカルボキシル基は、図2bにおいてリン酸イオンが結合していた場所に結合し、H1Rに特有のアミノ酸であるK179、K191と相互作用している。
<用語解説>
- 注1) X線結晶構造解析
- 解析対象のたんぱく質を結晶化し、X線照射によって得られる回折データから、結晶内部で原子がどのように配列しているかを決定する手法。
- 注2) ヒスタミン
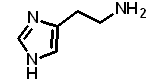 活性アミンの一種。分子式は、「C5H9N3」。通常時は細胞内に保存されており、外部からの刺激により細胞外へと放出され、アレルギー反応や炎症の原因ともなる。
活性アミンの一種。分子式は、「C5H9N3」。通常時は細胞内に保存されており、外部からの刺激により細胞外へと放出され、アレルギー反応や炎症の原因ともなる。- 注3) Gたんぱく質共役型受容体(GPCR:G-protein coupled receptor)
- Gたんぱく質と共役して細胞外の情報を細胞内へ情報伝達する受容体ファミリー。多くの薬の標的となっている。
- 注4) アミン受容体
- ヒスタミン、アドレナリン、ドーパミン、セロトニンといった生体アミンを受容するGPCRファミリー。
- 注5) Lipidic cubic phase法
- 脂質(モノオレインなど)からなる脂質二重層内に膜たんぱく質を存在させ、生体膜に近い環境で結晶化を行う方法。膜たんぱく質の結晶化に有効な手法。
- 注6) ドキセピン
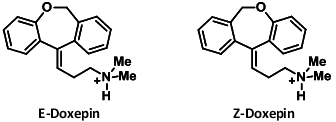 第一世代の抗ヒスタミン薬の1つ。分子式は、「C19H21NO」。
第一世代の抗ヒスタミン薬の1つ。分子式は、「C19H21NO」。- 注7) レボセチリジン
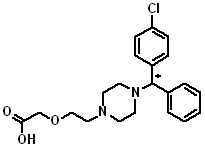 第二世代の抗ヒスタミン薬の1つとして知られている。分子式は、「C21H25ClN2O3」。
第二世代の抗ヒスタミン薬の1つとして知られている。分子式は、「C21H25ClN2O3」。- 注8) フェキソフェナジン
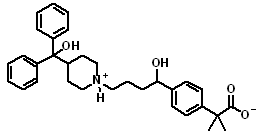 第二世代の抗ヒスタミン薬の1つで、アレルギー性疾患治療剤である。分子式は、「C32H39NO4」。
第二世代の抗ヒスタミン薬の1つで、アレルギー性疾患治療剤である。分子式は、「C32H39NO4」。
<論文名および著者名>
“Structure of the human histamine H1 receptor complex with doxepin”
(ヒト由来ヒスタミンH1受容体とドキセピンの複合体の立体構造)
doi: 10.1038/nature10236
Shimamura T., Shiroishi M., Weyand S., Tsujimoto H., Katritch V., Abagyan R., Cherezov V., Liu W., Han G. W., Kobayashi T., Stevens R. C., Iwata S.
<お問い合わせ先>
<研究に関すること>
島村 達郎(シマムラ タツロウ)
京都大学 大学院医学研究科 分子細胞情報学 特定講師
〒606-8501 京都府京都市左京区吉田近衛町 京都大学 大学院医学研究科 A棟3階
Tel:075-753-4389 Fax:075-751-8262
E-mail:
<JSTの事業に関すること>
金子 博之(カネコ ヒロユキ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: