<本研究成果のポイント>
- 反発性軸索誘導分子Sema3Aにより、マクロピノサイトーシスが誘導
- マクロピノサイトーシス誘導にはSyntaxin1Bの減少が必要
- 神経回路形成機構の理解と神経再生法確立に貢献する、新たなターゲットを提示
独立行政法人 理化学研究所(理研、野依 良治 理事長)は、間違った神経回路の形成を阻害する反発性軸索誘導因子による成長円錐の退縮が、今まで考えられてきたメカニズムとは全く違う、マクロピノサイトーシス注1)と呼ぶ大きな細胞膜の回収によって制御されていることを世界で初めて明らかにしました。これは、理研 脳科学総合研究センター(利根川 進 センター長) 発生神経生物研究チームの御子柴 克彦 チームリーダー(独立行政法人 科学技術振興機構(JST) 戦略的創造研究推進事業 発展研究(SORST)の「カルシウム振動プロジェクト」 研究総括)、樺山 博之 研究員(元 JST SORST「カルシウム振動プロジェクト」 研究員)らによる共同研究の成果です。
正しい神経回路が形成されるには、誘因性軸索誘導因子と反発性軸索誘導因子という2種類の因子が欠かせません。誘因性軸索誘導因子は、神経突起先端部分の成長円錐注2)に働きかけ、正しい神経細胞へと成長を促し、シナプス注3)形成を誘導します。逆に反発性軸索誘導因子は、成長円錐を退縮させることによって神経突起の伸長を止め、間違った神経細胞とのシナプス形成を阻害します。この成長円錐の退縮は、細胞膜表面積の減少を伴いますが、その仕組みはこれまで不明のままでした。2008年に研究グループは、反発性軸索誘導因子であるSema3A注4)が成長円錐でマクロピノサイトーシスを誘導することを見いだしました。このマクロピノサイトーシスの特徴は、これまでよく知られているものとは異なり、大規模な細胞膜の細胞内への取り込みによって形成される、非常に大きな空胞(Vacuole:直径0.2μm~5μm)を伴います。研究グループは、この空胞面積と成長円錐の表面積が逆相関を示すことから、このマクロピノサイトーシスが成長円錐の退縮に重要であることを見いだしていました。
今回研究グループは、マクロピノサイトーシスを特異的に阻害するアミロライド誘導体(EIPA)注5)を用いて、マクロピノサイトーシスを介してSema3Aが成長円錐を退縮させる仕組みを世界で初めて明らかにしました。また、このSema3Aによるマクロピノサイトーシス誘導には膜輸送に関与するSyntaxin1B注6)タンパク質(膜輸送分子)の減少が必要であることも分かりました。これまで成長円錐の退縮は、「アクチンなどの骨格系タンパク分子による制御」と考えられてきましたが、今回の発見は反発性軸索誘導において、「マクロピノサイトーシスによる成長円錐の退縮制御」という新しい分子機構による概念を提唱するものです。
本研究成果は、米国科学雑誌「The Journal of Neuroscience」(2011年5月18日号)に掲載されます。
1.背景
私たちの神経回路形成は、誘因性軸索誘導因子と反発性軸索誘導因子の組み合わせによって成り立っています。そのうち反発性軸索誘導因子は、神経突起先端にある成長円錐の退縮を引き起こすことで神経突起の伸長を止め、間違った神経細胞とのシナプス形成を阻害します。この成長円錐の退縮は、正常な神経回路形成のために極めて重要な役割を担っています。例えば、反発性軸索誘導分子の1つであるSema3Aを欠損したマウスは、初期発生期の神経突起が間違った方向へ伸び続け、神経回路網が正常に形成されません。また、Sema3Aは脊髄損傷時にその発現が誘導され、神経再生を阻害することが分かっています。このため、脊髄損傷治療の面からも、この反発性軸索誘導因子による成長円錐の退縮の仕組みを解明することは重要とされています。しかしこれまで、成長円錐の退縮時の膜表面積の減少の制御にかかわる分子機構の実体は不明のままでした。
細胞膜を回収するシステムとしてエンドサイトーシス注7)が知られています。2008年に研究グループは、Sema3Aによって成長円錐でマクロピノサイトーシスが誘導されることを報告しました。マクロピノサイトーシスの特徴として、1)クラスリン非依存性の細胞膜回収のエンドサイトーシスであること、2)蛍光ラベルされた分子量10万以上のデキストランを取り込むことで可視化できること、3)取り込まれた小胞は非常に大きいため、空胞(Vacuole)とも呼ばれ、顕微鏡下でしばしば容易に観察できること、があげられます。近年マクロピノサイトーシスはあらゆる生命現象に深く関わることが示され、例えば、血管内腔形成、さまざまなウイルスの哺乳類細胞への侵入、プリオンの細胞への侵入、また、抗原提示細胞が抗原を飲み込む際も知られています。
2008年の成果は、神経細胞でマクロピノサイトーシスが誘導されることを示した最初の報告でしたが、Sema3A誘導のマクロピノサイトーシスの生理的役割や分子機構は解明できていませんでした。Sema3Aによって取り込まれた空胞面積は、成長円錐の表面積と逆相関し、成長円錐の退縮とともに空胞は増えていきます。従って研究グループは、マクロピノサイトーシスが成長円錐の退縮に重要な役割を担っていると考え、マクロピノサイトーシスを特異的に阻害するEIPAを用いて解明することに取り組みました。
2.研究手法と研究成果
(1)EIPAによるSema3Aとボツリヌフ毒素の阻害
ニワトリの培養背根神経節の神経細胞の成長円錐は、Sema3Aにより退縮します。しかしEIPAの存在下では、Sema3Aによる成長円錐の退縮は抑制されました(図1)。デキストランの取り込みも同様に抑制されました。この結果は、Sema3Aによる成長円錐の退縮が、マクロピノサイトーシスによる細胞膜の大規模な回収によるものであることを示しています。
次に、成長円錐でマクロピノサイトーシスがどのように誘導されるかを調べるため、マクロピノサイトーシスを成長円錐で制御する分子の同定を試みました。まず、膜輸送分子であるSyntaxin1Bを切断する活性を持つボツリヌフ毒素(Neurotoxin C1注8))に着目しました。Neurotoxin C1は成長円錐を退縮させると同時に、空胞形成を誘導することが知られており、その空胞がマクロピノサイトーシスによる空胞と非常によく似ていることから、研究グループはNeurotoxin C1による空胞形成がマクロピノサイトーシスによるものと推測し、解析を行いました。その結果、デキストランがNeurotoxin C1による空胞に取り込まれることが分かりました(図2)。また、このNeurotoxin C1によるデキストランの取り込みと成長円錐の退縮は、EIPAにより抑制されました。これらの結果は、Neurotoxin C1による空胞形成と成長円錐の退縮がマクロピノサイトーシスによるものであることを示しています。
(2)マクロピノサイトーシスの負の制御因子Syntaxin1Bの同定
Neurotoxin C1は成長円錐に局在するSyntaxin1Bを切断することで、空胞形成を誘導することが知られていました。従って、Syntaxin1Bの発現を減少させることで同様に、成長円錐の退縮とマクロピノサイトーシスの誘導が起きるか調べたところ、実際にそれらの現象を観察することができました(図3)。つまり、Syntaxin1Bはマクロピノサイトーシスの負の制御因子であるとともに、マクロピノサイトーシスが成長円錐を退縮させることを示しています。
Syntaxin1Bの減少により誘導される成長円錐の退縮とマクロピノサイトーシスは、Sema3Aによるものと非常によく似ていたため、Sema3AがSyntaxin1Bの機能や発現を低下させている可能性が考えられました。興味深いことに、成長円錐のSyntaxin1Bのタンパク量は10分間のSema3A処理によって、減少することが分かりました(図4)。このようなSyntaxin1Bの減少は、ほかの反発性軸索誘導分子ephrin-A2注9)でも観察できますが、アクチン繊維の脱重合を阻害する薬剤では観察できませんでした。これは、Sema3AがSytaxin1Bの発現を抑制することによって、マクロピノサイトーシスを誘導することを示しています。
逆にSyntaxin1Bを過剰発現させると、Sema3Aによる成長円錐の退縮とマクロピノサイトーシス誘導が抑制されることが分かりました(図5)。これによりSema3AがSyntaxin1Bの発現を減少させることでマクロピノサイトーシスを誘導し、その結果、成長円錐を退縮させていることが明らかとなりました。
3.今後の期待
これまでの研究では、成長円錐の退縮を決めるのはアクチンなどの骨格系タンパク質と考えられてきました。それに対し本研究は、成長円錐の退縮に「マクロピノサイトーシスによる大規模な細胞膜の回収」という新たな分子機構が働いていることを提唱するものです(図6)。Sema3Aは発生初期の神経回路網形成に重要であり、また、神経再生が著しく困難な脊髄損傷において、中枢神経系の神経再生を阻害する分子としても知られています。今回の成果は、Sema3Aがマクロピノサイトーシスによって成長円錐を退縮させている可能性を世界で初めて示した点で、大きな意義があります。今後、Sema3Aに依存的なマクロピノサイトーシスの分子機構をさらに詳しく解明することで、神経再生法の確立にも貢献することが期待できます。
<参考図>
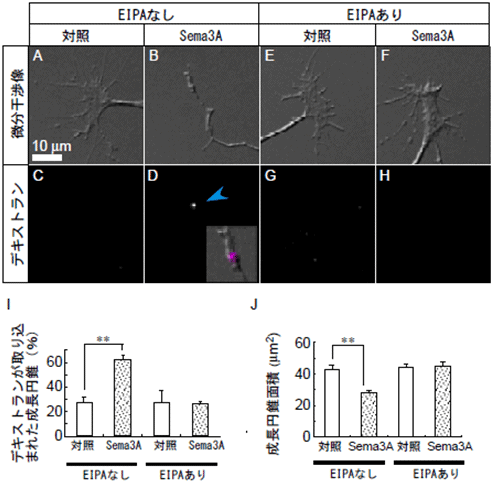
図1 EIPA存在下ではSema3Aによるデキストランの取り込みと成長円錐の退縮が抑制
- A~D : ニワトリ胚背根神経節神経細胞の成長円錐の固定標本。通常成長円錐は手の平のような形で(A)、デキストランの取り込みも観察されない(C)。Sema3A添加により、デキストランの取り込み(青矢頭、D)、と成長円錐の退縮(B)が起きる。図Dの挿入図はデキストラン(マゼンタ)と微分干渉像を重ねたもの。デキストランが退縮した成長円錐に取り込まれている。
- E~H : マクロピノサイトーシス阻害剤EIPA存在下における成長円錐。Sema3A添加を行っても、デキストランの取り込みや成長円錐の退縮は起こらない。
- I : デキストランを取り込んだ成長円錐の割合(%)。通常Sema3A処理をすると成長円錐のデキストラン陽性率は対照(牛血清アルブミン)処理と比べ、有為に上昇する。しかしEIPA存在下では、Sema3A処理を行っても、デキストラン陽性率は増加しない。これはSema3Aによるデキストランの取り込みがマクロピノサイトーシスを介していることを示している。
- J : 成長円錐面積。Sema3A処理によって、成長円錐の面積は減少する(退縮)。しかしEIPA存在下では、Sema3A処理による成長円錐の面積の減少は抑制される。これはSema3Aによる成長円錐の退縮がマクロピノサイトーシスによるものであることを示している。
- **は、統計的に差が有意であることを示す。
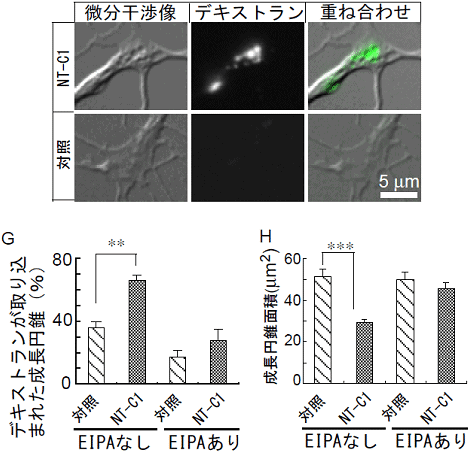
図2 成長円錐におけるマクロピノサイトーシス制御分子の探索
- A~C : Neurotoxin C1(NT-C1)処理したニワトリ胚背根神経節神経細胞の成長円錐のライブイメージング。空胞にデキストランが取り込まれている。
- D~F : 対照の成長円錐。空胞形成やデキストランの取り込みは観察されない。
- G : デキストラン陽性成長円錐の割合。NT-C1処理により、デキストラン陽性成長円錐が有為に増加する。EIPA存在下ではNT-C1処理を行ってもデキストラン陽性成長円錐の割合は増加しない。
- H : 成長円錐面積。NT-C1処理により、成長円錐の面積が減少するが、EIPA存在下では、NT-C1処理による成長円錐の面積の減少は抑制される。これはNT-C1処理による成長円錐の退縮がマクロピノサイトーシスを介していることを示す。
- **、***は、統計的に差が有意であることを示している。*の数が多いほど有為である。
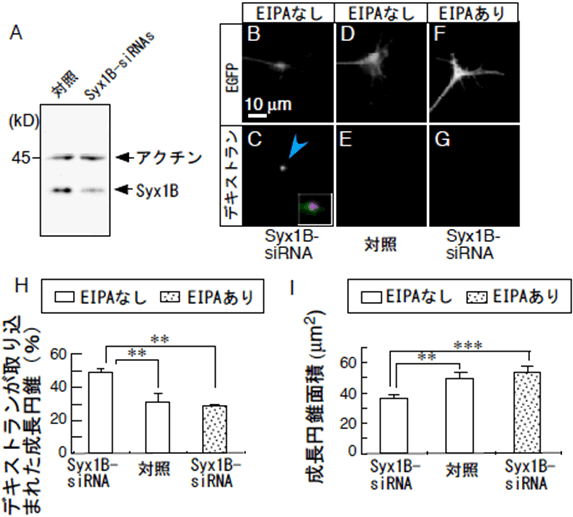
図3 Syntaxin1Bはマクロピノサイトーシスの負の制御因子
- A : Syntaxin1Bの発現を抑制するsiRNA(Syx1B-siRNA)を導入した背根神経節神経細胞におけるSyntaxin1Bの発現抑制の様子。対照と比べ、Syntaxin1Bの発現が約53.4%まで低下する。
- B~G : 成長円錐の固定標本。蛍光タンパクEGFPを共導入し、siRNAが導入した成長円錐を可視化したもの。Syx1B-siRNAを導入した成長円錐はデキストランの取り込みと退縮が観察できる(B,C)。対照のsiRNAを導入した成長円錐ではデキストランの取り込みも退縮も観察できない(D,E)。EIPA存在下では、Syx1B-siRNAによるデキストランの取り込みと成長円錐の退縮は抑制される(F,G)。
- H : デキストラン陽性成長円錐の割合(%)。B-Gで示した成長円錐のデキストラン陽性率を解析した。
- I : B-Gで示した成長円錐の面積。
- **、 ***は、統計的に差が有意であることを示している。*の数が多いほど有為である。
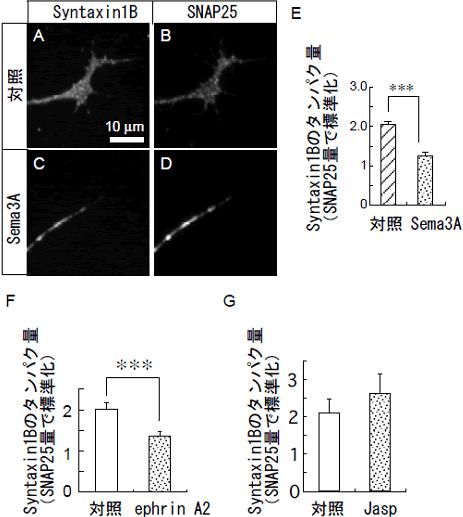
図4 Sema3Aにより、成長円錐におけるSyntaxin1Bのタンパク量が減少する
- A~D : 対照またはSema3A処理した成長円錐の免疫染色像。Syntaxin1B抗体とSNAP25抗体で二重染色した。
- E : 成長円錐におけるSyntaxin1Bタンパク量の定量化。SNAP25タンパク量でSyntaxin1Bタンパク量を標準化し比較した。Sema3A処理によって、有為にSyntaxin1Bタンパク質は減少する。
- F : 反発性軸索誘導因子のephrin A2によっても、Sema3Aと同様に、成長円錐においてSyntaxin1Bタンパク量が低下する。
- G : 擬似的に成長円錐の形態を退縮させるアクチン繊維の脱重合阻害剤(Jasp)はSyntaxin1Bタンパク量を低下させない。
- ***は、統計的に差が有意であることを示す。
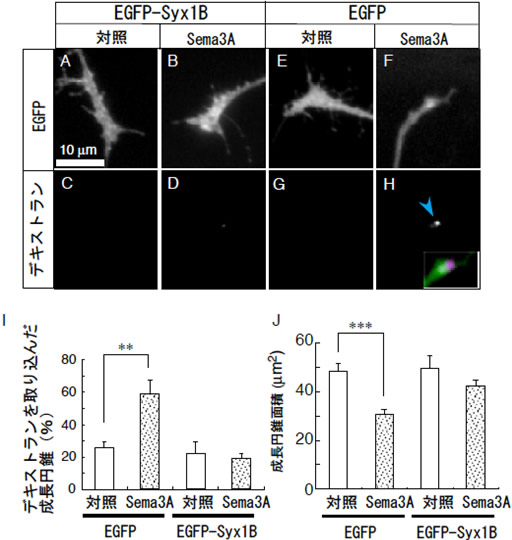
図5 Syntaxin1B過剰発現はSema3Aによる成長円錐の退縮を抑制する
- A~D : EGFPまたはEGFP-Syntaxin1B(EGFP-Syx1B)を過剰発現した成長円錐の固定標本。EGFP-Syx1Bを過剰発現した成長円錐ではSema3A処理による成長円錐の退縮(A,B)やデキストランの取り込み(C, D)を抑制する。
- E~H : EGFPを発現した成長円錐ではSema3A処理によって成長円錐の対縮(E, F)やデキストランの取り込み(G,H)が観察される。図Hの挿入図はデキストラン(Hのマゼンタ部分)とFの重ね合わせた画像。退縮した成長円錐にデキストランが取り込まれた。
- I : デキストラン陽性成長円錐の割合。Sema3A処理により、デキストラン陽性成長円錐が有為に増加する。EGFP-Syx1Bを過剰発現すると、Sema3A処理を行ってもデキストラン陽性成長円錐の割合は増加しない。
- J : 培養ディッシュ中の成長円錐面積。Sema3A処理により、成長円錐の面積が減少する。
- EGFP-Syx1Bを過剰発現は、Sema3A処理による成長円錐の面積の減少を抑制する。これはSema3A処理による成長円錐の退縮がマクロピノサイトーシスを介していることを示す。
- **、***は、統計的に差が有意であることを示し、*の数が多いほど有意差がある。
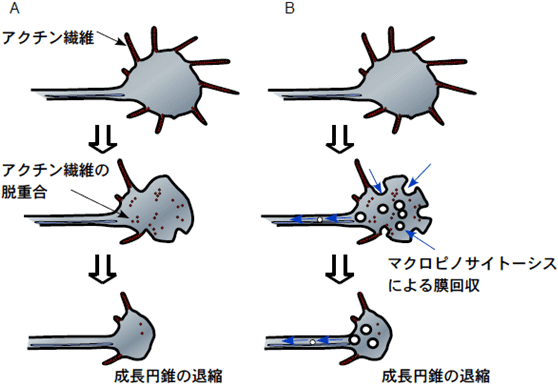
図6 本研究の結果から推測される、成長円錐退縮の新しい分子機構
- A :これまで考えられてきた成長円錐の退縮は、アクチンなどの骨格系タンパク質の動態変化によって引き起こされると考えられてきた。
- B :今回提唱する成長円錐の退縮機構は、マクロピノサイトーシスによって、細胞膜の大規模な回収が起こり、成長円錐の面積が減り、退縮するというものである。この新しい分子機構は、反発性軸索誘導に必要不可欠な重要なステップであると考えられる。また、この現象は、神経再生が困難な脊髄損傷時にも同様に起こっていると予想され、脊髄損傷治療法の開発に貢献できる可能性がある。
<補足説明>
- 注1) マクロピノサイトーシス
- エンドサイトーシスの1つ。特徴として、クラスリン非依存性、分子量10万以上のデキストランなどでラベルされ、取り込まれる細胞膜が大きく、しばしば空胞として容易に顕微鏡下で観察できる(直径0.2μm~5μm)。マクロピノサイトーシス特異的阻害剤として、ナトリウム/プロトン交換体阻害剤のアミロライド、またはその誘導化合物、5-(N-エチル-N-イソプロピル)アミロライド(EIPA)が知られる。
- 注2) 成長円錐
- 発達期に標的細胞とシナプスを形成するために、神経細胞は神経突起を伸ばす。神経突起方向を決めている。

ニワトリ背根神経節神経細胞の神経突起の先端にある成長円錐- 注3) シナプス
- 神経細胞同士の情報伝達に関わる構造。情報を伝える細胞と伝えられる細胞の間には約20nmのすき間がある。情報を伝える細胞はこのすき間に神経伝達物質を放出し、伝えられる細胞側の神経伝達物質受容体がそれを受けとることにより神経情報が伝わる。
- 注4) Sema3A
- 反発性軸索誘導分子の1つで、成長円錐を退縮させることで、神経突起の伸長を止め、間違った細胞とのシナプス結合を阻害する。
- 注5) アミロライド誘導体(EIPA)
- マクロピノサイトーシスの阻害剤であるアミロライドの誘導体、5-(N-エチル-N-イソプロピル)アミロライドの略。ナトリウム/プロトン交換体の阻害剤。
- 注6) Syntaxin1B
- Syntaxin1にはアイソフォームが2つあり、1Aと1Bが知られる。1Aは非常によく研究されているアイソフォームで、膜輸送に関与する。1Bは1Aに比べあまり解析が進んでいない。ニワトリ胚背根神経節の成長円錐では1Bが発現している。
- 注7) エンドサイトーシス
- 細胞は脂質二重膜(形質膜)によって細胞外と隔てられている。細胞外の物質や形質膜を細胞内へ取り込むことをエンドサイトーシスと呼ぶ。よく知られたエンドサイトーシスとしてクラスリン依存性のものがあり、直径が100~150nmの小胞を形成する。他に、カベオリン依存性のエンドサイトーシスは直径50~80nm、マクロピノサイトーシスは直径0.2μm~5μmの小胞を形成する。
- 注8) Neurotoxin C1
- ボツリヌフ菌(学名:Clostridium botulinum)が作り出す毒素。亜鉛依存性のメタロプロテアーゼの1つで、非常に強い毒性を示す。基質として膜輸送に関わるsyntaxinファミリーのうち、syntaxin1,2,3を切断することが分かっている。成熟神経シナプスの神経伝達物質の放出を抑制する。
- 注9) ephrin-A2
- 反発性軸索誘導因子の1つ。
<お問い合わせ先>
<研究に関すること>
御子柴 克彦(ミコシバ カツヒコ)
独立行政法人 理化学研究所 脳科学総合研究センター 発生神経生物研究チーム チームリーダー
樺山 博之(カバヤマ ヒロユキ)
独立行政法人 理化学研究所 脳科学総合研究センター 発生神経生物研究チーム 研究員
Tel:048-467-9745 Fax:048-467-9744
納富 さより(ノウドミ サヨリ)
独立行政法人 理化学研究所 脳科学研究推進部
Tel:048-467-9654 Fax:048-462-4914
<JSTの事業に関すること>
金子 博之(カネコ ヒロユキ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
独立行政法人 理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
独立行政法人 科学技術振興機構 広報ポータル部
Tel:03-5214-8404 Fax:03-5214-8432