JST 課題解決型基礎研究の一環として、理化学研究所の袖岡 幹子 主任研究員、大阪大学 大学院工学研究科の藤田 克昌 准教授らは、細胞中の小さな分子の動きを小さなタグを付けて観察することに成功しました。
薬などの小さな分子が細胞内のどこに動いていくのかを知ることは重要ですが、そのままでは調べることができません。そのため、注目する分子に別の蛍光分子注1)をタグとして結合させて蛍光顕微鏡注2)で検出する方法がよく用いられています。しかし、このタグは20~30個以上の原子でできた大きな分子であるため、注目する分子本来の性質が変わってしまうことが問題となっていました。
本研究グループは、2個の炭素原子と1個の水素原子からなる極めて小さな構造のアルキン注3)タグを用いた観察法を考案しました。アルキンは三重結合注4)を持つため、分子間の結合状態を観察するラマン顕微鏡注5)を用いることで検出が可能です。一方、細胞の構成分子には三重結合を持つものが少ないため、アルキンタグを付けた分子の細胞内での位置を調べることができます。この特徴を利用して今回、細胞がDNAを複製する時の材料となる2’-デオキシチミジン(dT)によく似た2’-デオキシウリジン(dU)にタグとなるアルキンを結合させた「5-エチニル-2’-デオキシウリジン(EdU)」を使って、その動きを調べました。EdUを人間の子宮頸がん由来の細胞(HeLa細胞)の培養液に加え、分子の動きをラマン顕微鏡で観察した結果、EdUが細胞に取り込まれた後、細胞核に集まっていく様子を観察することに成功しました。また、DNAが作られる周期もdTとEdUでほとんど変わらないことが分かりました。dTは31個の原子からなる小さな分子ですが、アルキンタグを付けたEdUもdTと同じような性質を示したと考えられます。この結果から、小さな分子の生細胞内での動きを観察するためにアルキンタグは有効であると分かりました。本研究成果は今後、生きた細胞の中で薬などの動きを観察する技術の発展に貢献するものと期待されます。
本研究成果は、米国化学会誌「Journal of The American Chemical Society」のオンライン速報版で近日中に公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
: |
「袖岡生細胞分子化学プロジェクト」 |
| 研究総括 |
: |
袖岡 幹子(理化学研究所 主任研究員) |
| 研究期間 |
: |
平成20~25年度 |
JSTはこのプロジェクトで、生命の根幹を担う現象である「細胞死」の仕組みを明らかにすべく、細胞死を制御する低分子化合物「細胞死制御分子」と新しい化学的解析手法の開発を行い、これらを組み合わせることで分子レベルでの解明を目指します。
<研究の背景と経緯>
基礎医学や薬理学、分子生物学などのライフサイエンスの研究では、細胞の生理的な機能を調べるために、薬物や内因性の生理活性物質などの低分子化合物の細胞内分布を調べることがありますが、化合物の分布はそのままでは見ることができないため、化合物を細胞に取り込ませた後に蛍光分子で染色するか、あらかじめ化合物に蛍光分子をタグとして結合させてから細胞に取り込ませることが必要です。しかし、化合物を細胞に取り込ませた後で染色する場合には、染色のために時間がかかったり染色の段階で細胞が死んでしまったりするため、リアルタイムで動的状態を調べることは困難です。また、蛍光分子をあらかじめ化合物に結合させてから細胞に取り込ませる場合には、蛍光分子をタグとして結合させることで、観察したい化合物の性質が全く変わってしまう可能性があるという問題があります。これは、蛍光分子が一般には20~30個以上の原子からなるかなり大きな分子であり、場合によっては観察したい低分子化合物よりも大きな分子であるためです。
<研究の内容>
本研究グループは、分子の振動を検出するラマン顕微鏡を用いて、分子の構造や状態を分析しながら観察することにより、細胞を非標識でイメージングすることができることに着目しました。ラマン顕微鏡を使うと、細胞中のチトクロームcや脂質などの特徴的なシグナルを検出して画像化することにより、細胞を染色することなくイメージングができます。もし、ある化合物がラマンスペクトル注6)で特徴的なシグナルを与えるならば、そのような化合物の細胞内分布は、ラマン顕微鏡を使うことによりイメージングが可能となることが期待されます。そこで、ラマンスペクトルで特徴的なシグナルを与え、しかも比較的小さな分子を探しました。いくつかの候補が見つかりましたが、中でも、2個の炭素原子が三重結合でつながった極めて小さな構造を有するアルキンは有望と考えられました。アルキンはラマンスペクトルで2120cm-1付近に非常に強いシグナルを与えるのに対し、細胞をラマン顕微鏡でイメージングすると、1800~2800cm-1の領域には細胞の構成成分に由来するシグナルはほとんど観測されませんでした。
生きて増殖している細胞に、DNAの構成成分であるdTなどによく似た構造の物質を与えると、細胞核の中のDNAに誤って取り込まれます。しかし蛍光分子のような大きなものをタグとして結合させると、細胞内でdTとして認識されなくなってしまい、DNAには取り込まれません。そこで、dTによく似たdUにアルキンをタグとして結合させたEdUを生きて増殖している細胞に取り込ませ、ラマン顕微鏡でイメージングしてみることにしました。図1に示すように、dUとEdUのラマンスペクトルを比較すると、アルキンを有するEdUは2120cm-1付近に強いシグナルを与えるのに対して、dUにはこのシグナルは認められないことから、このシグナルがアルキン由来であることが分かります。また、細胞のラマンスペクトルにおいては、2120cm-1付近にはEdUのシグナルを妨害するような大きなシグナルは観測されませんでした。
次に、生きて増殖しているHeLa細胞にEdUを加えて6時間培養した後に、ラマン顕微鏡で細胞を観察しました。2123cm-1のシグナルはアルキン、749cm-1のシグナルはチトクロームc、2849cm-1のシグナルは脂質が分布することを示します。図2に示すように、EdUが核に集まっている様子がイメージングできました。それに対し、EdUを加えないで培養したHeLa細胞を同じ条件で観察すると、2123cm-1のシグナルは認められず、チトクロームcと脂質のみが観察されました。これにより、細胞核の部分に観察された2123cm-1のイメージはEdUのアルキンタグのシグナルに由来することが確認されました。培地にEdUを加えてから、時間経過とともに変化する様子を見た結果を図3に示します。EdUを培地に加える前の細胞には2123cm-1のシグナルは全く観測されず、EdUはこの段階では細胞核には存在しないことが分かります。細胞増殖の進行とともに細胞核にEdUが取り込まれた細胞の割合が増える様子が観察され、開始後21時間には、EdUが取り込まれていることを示す2123cm-1のラマンシグナルがほとんどの細胞に観測されました。つまり細胞内でDNAが複製される間隔が21時間程度であることを示しており、HeLa細胞の倍加時間(分裂から分裂までの平均所要時間)がおよそ20時間であることとよく一致しています。ラマン顕微鏡を用いてアルキンタグを検出する方法により、細胞増殖に伴うDNA合成をリアルタイムでモニターできたことを示すものであると考えられます。
<今後の展開>
今回タグとして用いたアルキンはたった2つの炭素原子からなる極めて小さな構造です。このような小さな構造であれば、小さな生物活性物質に結合させても、その活性、細胞内分布などの性質は大きく変化しないことが期待されます。従って、アルキンをタグとして用いてラマン顕微鏡で観察するイメージング方法は、今回成功したdT(EdU)に限らず、生きた細胞内での多くの低分子化合物の分布をリアルタイムでダイナミックにイメージングする方法として適用可能であると考えられます。しかし、今回の方法には、ラマン顕微鏡の感度の限界のために比較的長い露光時間を要するという改善すべき点があります。今後、ラマン分光法の技術開発を続けることにより、ラマン顕微鏡の感度の向上による露光時間の短縮が可能となり、さらに進化したリアルタイムでダイナミックなイメージング法が開発されることが期待されます。
<参考図>
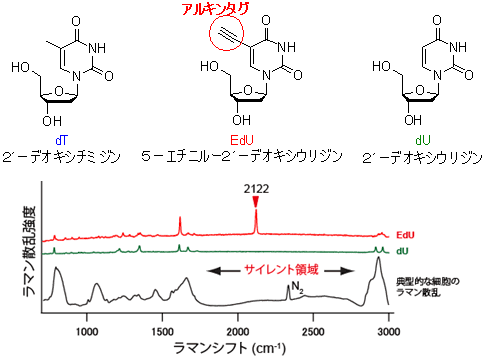
図1 dT、EdU、dUの構造(上段)と、EdU、dU、典型的な細胞のラマンスペクトル(下段)
細胞がラマンシグナルをほとんど発しないラマンサイレント領域中の2122cm-1に、EdUはアルキンタグ由来の強いラマンシグナルを与えた。また、アルキンタグを持たないdUは2122cm-1のシグナルを示さない。
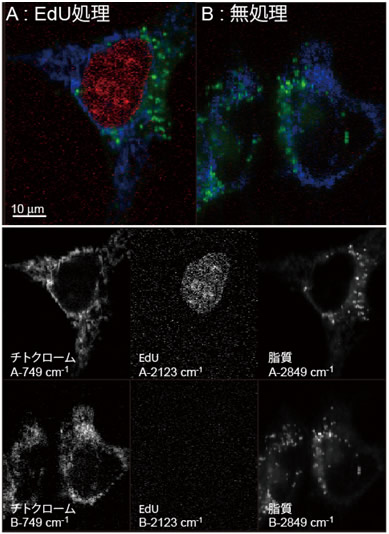
図2 EdU処理した細胞のラマンイメージ(A)と、無処理細胞のラマンイメージ(B)
749cm-1はチトクロームc、2123cm-1はEdU、2849cm-1は脂質の分布を示す。EdUを処理した細胞のみ、核に2123cm-1の分布が観察される。
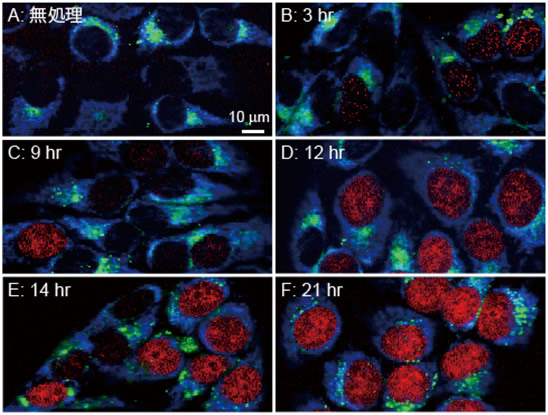
図3 EdUが時間依存的に核に取り込まれる様子
図の青色はチトクロームc、赤色はEdU、緑色は脂質の分布を示す。EdU処理後、次第にEdUが集積した細胞の割合が増加し、倍加時間が経過した21時間後にはほぼ全ての細胞でEdUの集積が確認された。
<用語解説>
- 注1) 蛍光分子
- 蛍光分子は特定の波長の光を吸収し、蛍光を放つ性質を持つ。代表的なものとして、フルオロセインがあり、これは37個の原子から構成されている。
- 注2) 蛍光顕微鏡
- 観察したいサンプルに光を当て、放たれる蛍光の分布を観察する顕微鏡。
- 注3) アルキン
- 2個の炭素原子が三重結合でつながった構造のこと。アルキンの中で最も小さな分子はHC≡CHのアセチレンである。また、これをタグとして付ける場合の構造である-C≡CHはエチニル基と呼ぶ。
- 注4) 三重結合
- 炭素同士が1つのσ軌道と2つのπ軌道で計3つの結合を作ったもの。単結合、二重結合に比べて結合エネルギーが高く、結合距離も短い。
- 注5) ラマン顕微鏡
- 物質に光を当てると、原子の結合状態(分子の振動状態)に応じた波長の光を吸収する。その後、吸収した光は散乱光として放出されるが、散乱光と入射光の波長が異なることがある。この現象はラマン効果と呼ばれ、この効果は原子の結合状態に由来するため、波長変化を観察することで原子の結合情報、つまり物質の組成や結晶構造を知ることができる。この分析手法と顕微鏡を組合せ、物質を検出しながら観察(イメージング)を行うことを可能とした計測装置をラマン顕微鏡と呼ぶ。
- 注6) ラマンスペクトル
- ラマン効果による光の振動数の変化をラマンシフトと呼ぶ。この数値ごとに散乱光の強度をグラフ化したものがラマンスペクトルである。
<論文名>
“Imaging of EdU, an Alkyne-tagged Cell Proliferation Probe, by Raman Microscopy”
(ラマン顕微鏡によるEdU、アルキン標識された細胞増殖プローブのイメージング)
doi: 10.1021/ja108404p
<お問い合わせ先>
<研究に関すること>
袖岡 幹子(ソデオカ ミキコ)
理化学研究所 主任研究員
〒351-0198 埼玉県和光市広沢2-1
Tel:048-467-9373 Fax:048-462-4666
E-mail:
<JSTの事業に関すること>
小林 正(コバヤシ タダシ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: