JST 課題解決型基礎研究の一環として、徳島大学疾患ゲノム研究センターの岡崎 拓 教授らは、マウスでリンパ球の膜表面にある「LAG-3」と呼ばれるたんぱく質が自己免疫疾患注1)の発症に重要な役割を果たしていることを突き止めました。
自己免疫疾患の多くは効果的な根治療法がなく、対症療法による治療が中心となっています。自己免疫疾患は多くの遺伝子が関与するため、原因遺伝子を特定することは極めて困難です。また、自己免疫疾患の制御に関与する遺伝子はいくつか報告されていますが、それらがどのように協調して働き、実際に自己免疫疾患の発症を制御しているかはほとんど解明されていません。本研究グループはこれまでに、免疫反応を抑制する「PD-1」遺伝子を働かなくしたマウスがさまざまな自己免疫疾患を発症することを発見しましたが、この因子を含めた多因子によるネットワークシステムのさらなる解明が望まれています。
本研究グループは今回、モデルマウスを用いて、PD-1に加えてLAG-3という遺伝子も働かなくすると自己免疫疾患が悪化することを発見しました。また、LAG-3だけを欠損させても自己免疫疾患は発症しませんが、他の要因と組み合わせることにより、さまざまな自己免疫疾患の発症を引き起こすことも分かりました。さらに、LAG-3遺伝子によって作られるたんぱく質がリンパ球上に発現して、リンパ球の活性化を抑制することも分かりました。つまり、通常はLAG-3がPD-1などと協調して行き過ぎた免疫反応を抑制することにより自己免疫疾患の発症を制御しているのだと考えられます。LAG-3は人間にもあるため、今後LAG-3の機能を調節することにより、自己免疫疾患や感染症、アレルギーの治療に役立つものと期待されます。
本研究は、京都大学、金沢大学、理化学研究所、実験動物中央研究所の協力のもと行われ、本研究成果は、2011年2月7日(米国東部時間)発行の米国科学雑誌「Journal of Experimental Medicine」にオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立がんセンター 総長)
|
| 研究課題名 |
: |
「自己免疫疾患制御分子の同定による新規治療法の開発」 |
| 研究代表者 |
: |
岡崎 拓(徳島大学疾患ゲノム研究センター 教授) |
| 研究期間 |
: |
平成21年10月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、モデル動物を利用して、自己免疫疾患の原因遺伝子を同定することにより、新規治療法の開発につなげることを目指します。
<研究の背景と経緯>
人口の5%が何らかの自己免疫疾患にかかっていると言われていますが、その多くについて効果的な根治療法はなく、対症療法による治療が中心となっています。効果的な根治療法の開発には、疾患がどのように発症するのかを解明することが不可欠ですが、ほとんどの自己免疫疾患は多くの遺伝子が関与するため、原因遺伝子を特定することは極めて困難です。また、自己免疫疾患の制御に関与する遺伝子がいくつか報告されているものの、それらがどのように協調して働き、実際に自己免疫疾患の発症を制御しているかはほとんど解明されていません。
本研究グループはこれまでに、PD-1欠損マウスがマウスの系統ごとに異なる種類の自己免疫疾患を自然発症することを見いだし、その解析を行いました。例えば、BALB/cという本来正常な系統のマウスでPD-1を欠損させる(BALB/c-PD-1欠損マウス)と、自己免疫性の拡張型心筋症や胃炎を自然発症します(図1)。もし、PD-1と協調して自己免疫疾患の発症を制御する分子が特定できれば、自己免疫疾患の発症を制御する多因子のネットワークシステムが解明され、新規の診断法・治療法の開発につながるものと期待されています。
<研究の内容>
自己免疫疾患を発症した人間やモデル動物では、親和性成熟とクラススイッチ注2)という2種類の機能変化を受けた抗体が高頻度に検出されます。そこで本研究グループは、自己免疫疾患を発症するPD-1欠損マウスとNODマウス(non-obese diabetic mouse)注3)とを、この2種類の機能変化に必須の酵素AID(Activation-induced cytidine deaminase)注4)を欠損させたマウス(AID欠損マウス)とそれぞれ交配させると、抗体の機能変化が起こらなくなるので、自己免疫疾患の症状が好転するのではないかと予測しました。しかし実際には、PD-1・AID二重欠損マウスは、PD-1欠損マウスでは見られない激しい心筋炎を自然発症し、NOD-AID欠損マウスはNODマウスよりも早期に1型糖尿病注5)を発症しました(図2)。そこで、AIDの機能不全が自己免疫疾患を誘導する可能性をさまざまな角度から検証しましたが、その証拠は得られませんでした。
反対に、AID遺伝子を欠損しているものの、全く自己免疫疾患を発症しないマウスが産まれたことから、これらの影響はAIDの機能不全によるものではなく、AID遺伝子の近くに存在する別の遺伝子の変異、あるいはマウスの系統による差の影響である可能性が高くなりました。そこで、AID遺伝子座の近くに存在し、自己免疫疾患を誘導する遺伝素因を「aida変異」、aida変異を有するマウスを「aidaマウス注6)」と命名しました。
自己免疫疾患を発症する(aida変異を持つ)PD-1・AID二重欠損(aida)マウスと、自己免疫疾患を発症しない(aida変異を持たない)PD-1・AID二重欠損マウスの染色体を詳細に比較した結果、aidaマウスにはAID遺伝子の近くに存在するLAG-3という免疫細胞の表面に発現するたんぱく質の遺伝子に変異があり、その機能が欠失していることを発見しました(図3)。
LAG-3遺伝子の変異はAID欠損マウスの作製に使用したES細胞では認められなかったため、系統による差ではなく、AID欠損マウスをBALB/c系統に戻し交配注7)する過程で偶然起こった突然変異であることが分かりました。その後、LAG-3、PD-1、AIDの欠損をさまざまに組み合わせて発症する自己免疫症状を解析したところ、BALB/c系統においてはLAG-3単独の欠損では自己免疫疾患を発症しませんが、PD-1欠損と協調して激しい心筋炎を発症させること、NODマウスではLAG-3単独の欠損で1型糖尿病の発症を悪化させることなど、LAG-3が与えるさまざまな影響が分かりました。また、PD-1とAIDを欠損させたところ胃炎や拡張型心筋症を発症しなかったことから、PD-1欠損マウスが発症する胃炎や拡張型心筋症には、抗体分子の親和性成熟とクラススイッチが必須であることも分かりました。一方、PD-1・LAG-3二重欠損マウスが発症する激しい心筋炎やNOD-LAG-3欠損マウスが発症する1型糖尿病には、抗体分子の親和性成熟とクラススイッチは不要であり、これらのことから、自己免疫疾患の種類によって抗体分子の親和性成熟とクラススイッチの関与が異なることが明らかになりました。このように、当初AIDの欠損によると考えられていた自己免疫症状の悪化はLAG-3の欠損によるものでした。
さらに、Tリンパ球の活性化におけるLAG-3とPD-1の機能を解析し、PD-1とLAG-3が協調的に働き、リンパ球の増殖やサイトカインの産生を抑制することも解明しました(図4)。
このように、LAG-3は自己免疫疾患の発症制御において極めて重要な役割を果たしますが、単独で欠損させただけでは大きな影響が確認されていなかったため、自己免疫疾患における役割ははっきりとしていませんでした。LAG-3欠損がPD-1欠損と偶然出会ったことが、今回のLAG-3分子がPD-1をはじめとした他の免疫制御分子と協調してリンパ球の自己に対する反応を抑制しているという機能の発見につながりました。
<今後の展開>
自己免疫疾患は複数の因子が発症に関与する多因子疾患ですが、本来は健常なBALB/cという系統のマウスでもPD-1とLAG-3の両者を欠損させるだけで自己免疫疾患を自然発症したことから、両者の機能をさらに解析することにより自己免疫疾患制御ネットワークシステムの根幹が解明される可能性があります。
人間にもLAG-3がありますが、自己免疫疾患における機能はほとんど解析されていません。今後、人間の自己免疫疾患におけるLAG-3の機能をより詳細に解析すること、LAG-3の機能を制御できる薬剤を開発することにより、自己免疫疾患の新規診断・治療につながる可能性があります。また、自己免疫疾患と同様に異常な免疫応答であるアレルギー疾患、一種の自己免疫応答である腫瘍免疫や移植片の拒絶、自己の細胞に感染して毒性を発揮するウイルス感染症などに対しても、効果的な治療法の開発につながるものと期待されます。
<参考図>
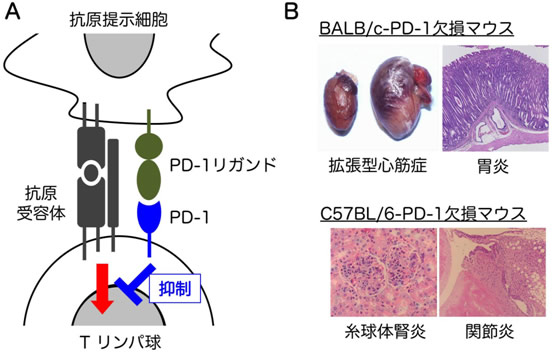
図1 免疫補助受容体PD-1を欠損させたマウスは自己免疫疾患を発症する
- A: PD-1は、抗原受容体刺激を抑制する、免疫補助受容体である。
- B: PD-1を欠損させたマウスは、BALB/cという系統では自己免疫性の拡張型心筋症や胃炎を自然発症し、C57BL/6という系統では、自己免疫性の糸球体腎炎や関節炎を自然発症する。
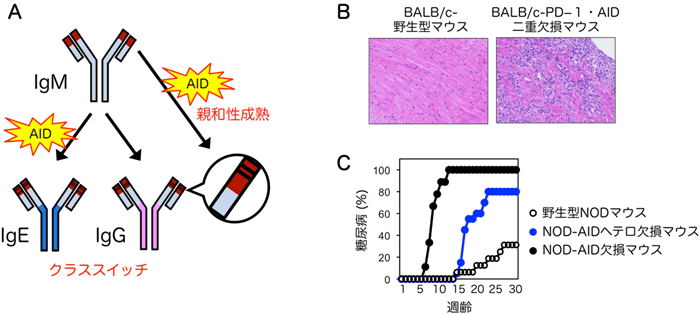
図2 AID欠損は自己免疫疾患を悪化させた
- A: 抗体分子は、AIDの働きにより親和性成熟とクラススイッチという機能修飾を受け、抗原に対する親和性が向上するとともに、抗原処理様式が多様化する。
- B: BALB/c系統のPD-1欠損マウスにAID欠損を追加すると、激しい心筋炎を自然発症した。
- C: NODマウスにAID欠損を導入すると、1型糖尿病の発症が大幅に促進された。
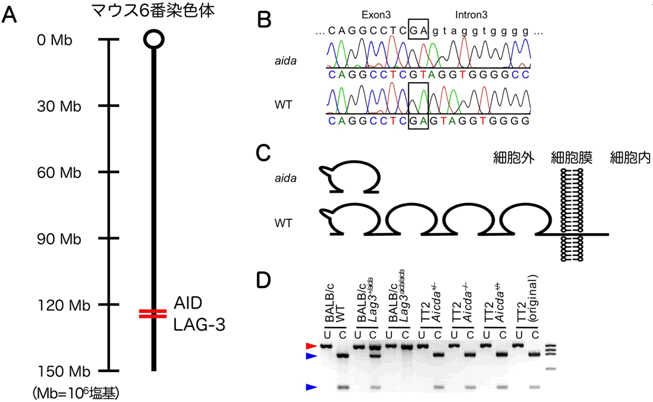
図3 当初AID欠損の影響と考えられた自己免疫疾患の悪化は、LAG-3遺伝子に偶然導入された突然変異によるものであった
- A: マウス第6番染色体上に、AID遺伝子とLAG-3遺伝子は近接して存在する。
- B: AID欠損マウスのLAG-3遺伝子は、塩基が2つ欠失していた。
- C: LAG-3は、細胞膜を貫通する膜たんぱく質であるが、この欠失変異により、不完全なたんぱく質しかできなくなった。
- D:この欠失変異は、AID欠損マウスをBALB/c系統に戻し交配する過程で、偶然導入された突然変異であった。
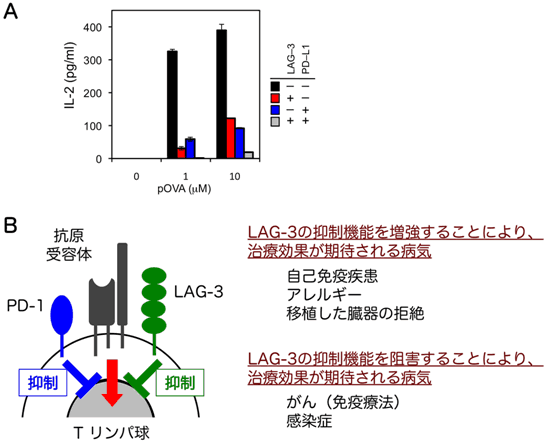
図4 LAG-3はPD-1と協調してTリンパ球の自己に対する反応を抑制する
- A: Tリンパ球が抗原刺激に反応して産生するIL-2の量を測定したところ、PD-1とLAG-3はともにIL-2の産生量を減少させた。また、両者が共存する際には、IL-2の産生量がさらに減少した。
- B: LAG-3とPD-1は活性化したTリンパ球の表面に発現し、抗原受容体刺激を抑制する。LAG-3の抑制機能を増強する薬剤が開発されれば、自己免疫疾患やアレルギーの治療、臓器移植時の免疫抑制剤として利用できる可能性がある。また、LAG-3の抑制機能を阻害する薬剤が開発されれば、がんの免疫療法や、感染症の治療に利用できる可能性がある。
<用語解説>
- 注1) 自己免疫疾患
- 異物を認識し排除するための役割を持つ免疫系が、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことで症状を引き起こす疾患の総称。
- 注2) 親和性成熟とクラススイッチ
- 抗体分子には親和性成熟とクラススイッチという機能修飾が起こる。親和性成熟とは、抗体分子の抗原に対する親和性が抗原刺激により増すことで、クラススイッチとは抗体分子の重鎖定常領域が置換されることにより、抗原特異性を保持したまま、その機能が変化することを言う。
- 注3) NODマウス(non-obese diabetic mouse)
- 加齢により一部のマウスが1型糖尿病を自然発症するモデルマウス。
- 注4) AID(Activation-induced cytidine deaminase)
- 活性化したBリンパ球に発現する、シチジンのアミノ基を取り除きウリジンに変換する酵素。抗体分子の親和性成熟とクラススイッチに必須の酵素であり、AID欠損マウスでは、両者とも全く起こらない。AID欠損マウスは自己免疫疾患を基本的には発症しないが、抗体の機能が不十分なために腸内の細菌が異常増殖しており、それを抑え込むために免疫系が異常に活性化していることが知られている。
- 注5) 1型糖尿病
- 膵臓のインスリン分泌細胞が死滅するために発症する糖尿病。いくつかの原因が報告されているが、自己免疫によるものが最も多いと考えられている。生活習慣の影響が強いとされる2型糖尿病と比較して若年に多い。
- 注6) aidaマウス
- ヴェルディの悲劇のオペラAida(アイーダ)と、aidaマウスが重篤な自己免疫疾患になることを掛けて名付けた。
- 注7) 戻し交配
- 異なる系統のマウスを交配して得られた産仔を、再度片方の系統のマウスと交配すること。特定の遺伝子変異を有するマウスの遺伝子背景を変更する際には、通常10世代以上に渡って戻し交配される。今回は、CBA系統とC57BL/6系統のF1系統で作製されたAID欠損マウスの遺伝子背景をBALB/c系統に変更するために、BALB/c系統に10世代に渡り戻し交配された。
<論文名>
“PD-1 and LAG-3 inhibitory co-receptors act synergistically to prevent autoimmunity in mice”
(PD-1とLAG-3は協調して自己免疫疾患の発症を制御する)
doi: 10.1084/jem.20100466
<お問い合わせ先>
<研究に関すること>
岡崎 拓(オカザキ タク)
徳島大学疾患ゲノム研究センター ゲノム機能分野
〒770-8503 徳島県徳島市蔵本町3丁目18番地の15
Tel:088-633-9158 Fax:088-633-9159
E-mail:
<JSTの事業に関すること>
河村 昌哉(カワムラ マサヤ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3531 Fax:03-3222-2066
E-mail: