JST 課題解決型基礎研究の一環として、関西医科大学附属生命医学研究所の木梨 達雄 教授らは、リンパ球の接着を制御する分子の破綻が自己免疫疾患注1)の発症につながることを発見しました。
リンパ球は白血球の一種で異物侵入に対し、攻撃・排除する役割をしており、血管を通じて全身を移動し、リンパ節内の血管内皮に接着して浸潤し、リンパ節内を巡回することが知られています。リンパ球はリンパ節内で異物侵入に対する監視役の樹状細胞に遭遇すると、接着して異物侵入の情報を受け取り、活性化されてこれを撃退します。このように免疫システムに重要な接着のメカニズムを解明し制御できるようになれば、免疫反応を促進したり、逆に過剰な免疫反応を抑えることができると考えられます。木梨教授らはこれまで、免疫細胞特異的に発現する接着制御分子(RAPL)がリンパ球の接着や移動の調節に重要な働きをしていることを明らかにしています。しかし自分の身体を異物と見なして攻撃してしまう自己免疫疾患において、接着制御分子がどのような役割を果たしているのかは今までよく分かっていませんでした。
本研究グループは今回、RAPLを持っていないマウス(RAPL欠損マウス)を作製し、そのマウスでは加齢とともに正常な自己細胞を異物と見なす自己抗体ができて、ループス腎炎などの自己免疫疾患やリンパ腫を発症することを発見しました。さらにその発症メカニズムとして、RAPLがリンパ球の増殖を抑えているために、RAPLが欠損するとリンパ球の過剰な増殖を招いていることも明らかにしました。
この成果は、リンパ球の接着と増殖が連携して制御されており、両者に関与する分子の破綻は、自己免疫疾患の発症につながることを示しています。また、こうした疾患研究のモデルとなるマウスを新しく創出することによって、ヒト全身性エリテマトーデス(SLE)などの自己免疫疾患の病態解明と新しい治療法の開発に役立つものと期待されます。
本研究成果は、2010年12月30日(米国東部時間)に米国科学雑誌「Immunity」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立がんセンター 総長)
|
| 研究課題名 |
: |
「接着制御シグナルの破綻と自己免疫疾患」 |
| 研究代表者 |
: |
木梨 達雄(関西医科大学附属生命医学研究所 分子遺伝学部門 教授) |
| 共同研究者 |
: |
片桐 晃子(関西学院大学 理工学部 生命科学科 生命医化学専攻 教授) |
| 研究期間 |
: |
平成21年10月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、自己寛容における免疫動態制御シグナルが果たす機能と制御を明らかにして、新たな自己免疫発症機構を提示し、難治性自己免疫疾患との関連を明らかにすることを目指します。
<研究の背景と経緯>
リンパ球の全身性の移動は異物侵入に対する免疫監視に重要な働きをしています。リンパ球は血管内皮に接着してリンパ組織や炎症部位に移動し、異物由来の抗原を認識することによって免疫反応の担い手としての能力を獲得します。木梨教授らはこれまで、共同研究者である片桐教授とともにがん抑制遺伝子(細胞のがん化を押さえる遺伝子)であるRASSFファミリー注2)に属するRAPLが、細胞表面のたんぱく質であるインテグリン注3)を介して、リンパ球と血管内皮や抗原提示細胞との接着を調節していることを明らかにしました。近年、RASSFファミリー遺伝子群は、アポトーシス誘導能および増殖抑制機能を持つことから、がん抑制遺伝子として重要であることが示唆されています。しかしRAPLの接着を制御する働きがRASSFファミリー遺伝子群によるガン抑制の働きとどのようにつながっているのかは不明でした。また、生体免疫系の過剰応答に起因する自己免疫疾患やアレルギー疾患で、RAPLがどのような働きをしているのかも分っていませんでした。
<研究の内容>
本研究では、RAPLが免疫システムにおける自己寛容注4)の成立・維持と過剰応答を制御しているのではないかと考え、RAPL欠損マウスを作製し解析しました。あるたんぱく質が機能しないようにさせた場合に、細胞内や体内でどのようなことが起きるのかを解析することで、そのたんぱく質がどういった働きを担っているのかを明らかにする手法は、現代の生物学では非常に良く用いられています。その結果、RAPL欠損マウスでは加齢とともに自己抗体ができて、ループス腎炎などの自己免疫疾患様症状やBリンパ腫を発症することが分りました(図1、図2)。そのメカニズムとして、RAPLが細胞周期の進行に関与するp27kip1(CDKインヒビター注5))というたんぱく質の核と細胞質間の移行を制御しており、p27kip1は核に移行できないと機能しなくなって細胞増殖を抑制できなくなることがわかりました。また、RAPLは抗原刺激に対する免疫反応であるT細胞とB細胞の増殖を抑制していることも分りました。そのためRAPLが欠損すると、リンパ球は過剰な増殖応答を示すようになり、同時にp27kip1は細胞質に異常に蓄積するようになります(図3、図4)。p27kip1の核から細胞質への移行には特定のアミノ酸として10番目セリン(S10)のリン酸化が必要ですが、RAPLが正常に存在する場合はそのリン酸化が抑制され、p27kip1が細胞質へ移行してしまわないようにしていることも確かめられました(図5、図6)。また、RAPL欠損マウスのp27kip1が正常に核内に移動できるように、p27kip1の一部を変化させてS10のリン酸化が起きないようにしたところ、RAPL欠損による自己免疫疾患発症やリンパ腫が認められなくなりました。これらのことから、接着制御分子RAPLがp27kip1の核内移行を促進し、リンパ球の増殖を抑制するシグナルとして、リンパ球増殖性疾患の発症抑制に重要な機能を果たしていることが明らかになりました(図7)。
本研究成果は、リンパ球における接着と増殖が連携して制御されていることを示唆するとともに、接着制御分子の破綻が自己免疫疾患の発症につながることを明らかにし、SLEなどの自己免疫疾患の治療策定に新たな視点を与えるものと考えられます。
<今後の展開>
本研究で作製に成功した、接着制御分子RAPLの破綻により自己免疫疾患を発症するモデルマウスを用いて、RAPLが関与すると考えられる自己寛容の成立・維持の機構を明らかにすることで、さらに詳細に自己免疫疾患発症機構が提示できるものと予想されます。また、RAPLによってp27kip1が核内に移行する際の分子機構をより詳細に解明することで、リンパ球の増殖を抑制させる働きを担う決定的なターゲット分子が見いだされ、リンパ球増殖性の自己免疫疾患に新たな治療法を確立できるものと期待されます。
<参考図>
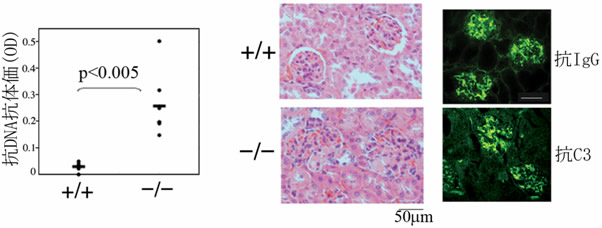
図1 RAPL欠損マウスは加齢するとループス腎炎を発症する
- 左側: 10ヵ月令RAPL欠損マウス(-/-)は正常マウス(+/+)に比べ、SLEなどの自己免疫疾患で陽性になる抗dsDNA抗体価が上昇しています。
- 右側: 腎臓切片のHE染色像、抗IgG、C3抗体による蛍光染色像。RAPL欠損マウス(-/-)の糸球体は肥大し、免疫複合体が沈着しています。
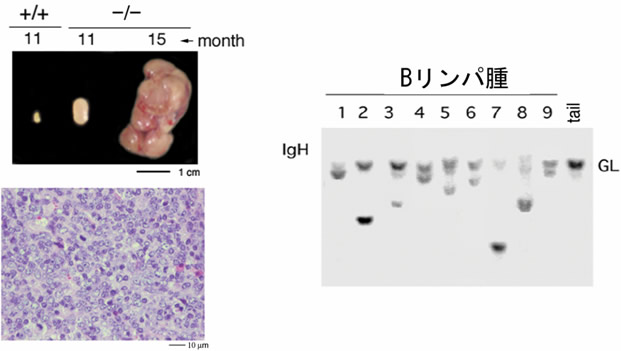
図2 RAPL欠損マウスはBリンパ腫を発症する
- 左側: 11ヵ月と15ヵ月令のRAPL欠損(-/-)マウスの腫脹したリンパ節(上)と組織像。リンパ節は巨大化し、組織像からBリンパ腫であることが分かります。
- 右側: RAPL欠損マウス由来Bリンパ腫の免疫グロブリンの再編成をサザンブロットで検討したところ、全て1種類のB細胞由来であることが確認されました。
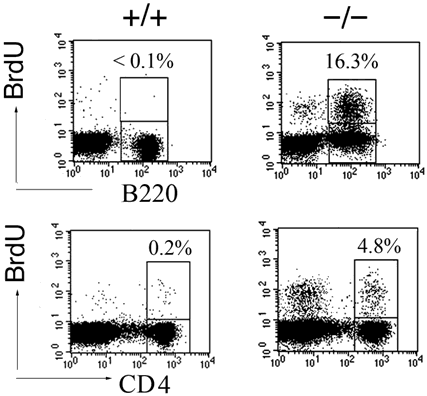
図3 RAPL欠損リンパ球は、生体内で増殖している
- 上: B220陽性B細胞のBrdU(ブロモデオキシウリジン)取り込みを示しています。BrdUはチミジンのアナログで、細胞周期のS期特異的にDNAに取り込まれます。RAPL欠損B細胞(-/-)は、正常B細胞(+/+)に比べ、BrdU取り込みが亢進しています。
- 下: CD4陽性T細胞のBrdU取り込みを示しています。RAPL欠損T細胞(-/-)は、正常T細胞(+/+)に比べてBrdU取り込みが亢進しています。
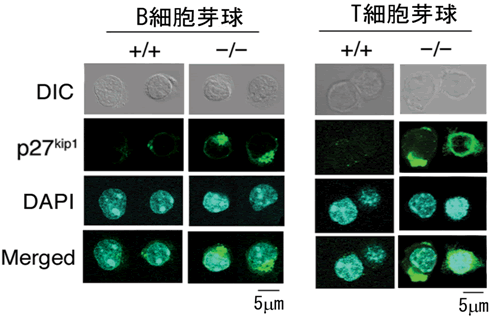
図4 抗原刺激したRAPL欠損リンパ芽球では、p27kip1が細胞質に蓄積している
- 左側: 正常B細胞芽球(+/+)ではp27kip1は分解されてなくなっていますが、RAPL欠損B細胞芽球(-/-)ではp27kip1が細胞質に蓄積しています。
- 右側: 正常T細胞芽球(+/+)ではp27kip1は分解されてなくなっていますが、RAPL欠損T細胞芽球(-/-)ではp27kip1が細胞質に蓄積しています。
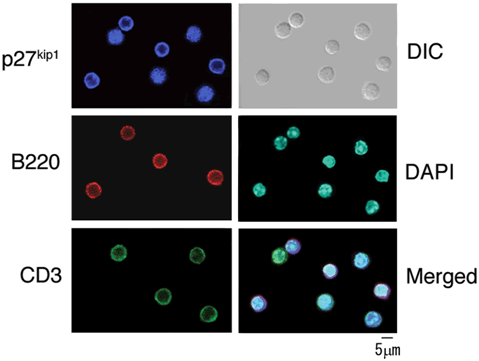
図5 p27kip1の細胞内局在は、B細胞とT細胞で異なる
赤い蛍光色素で示したB細胞ではp27kip1が細胞質に存在しますが、緑の蛍光色素で示したT細胞はp27kip1が核内に存在します。
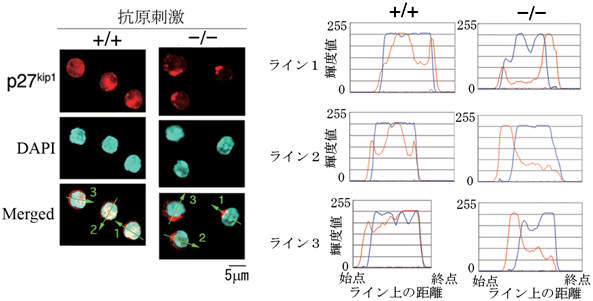
図6 RAPL欠損B細胞では、p27kip1の核内移行が起こらない
- 左側: 赤い蛍光色素はp27kip1、青い蛍光色素はDAPI染色(核)を示しています。抗原受容体刺激2時間後、正常B細胞(+/+)では、核内にp27kip1が存在しますが、RAPL欠損B細胞(-/-)では、細胞質に留まったままです。
- 右側: 赤(p27kip1)と青(核)の蛍光強度を左側の1番下のラインに沿って定量した結果を示しています。正常B細胞(+/+)では、青いラインと赤いラインが重なっていて、核内にp27kip1が存在していますが、RAPL欠損B細胞(-/-)では、青いラインと赤いラインが重なっておらず、p27kip1が細胞質に存在することが分かります。
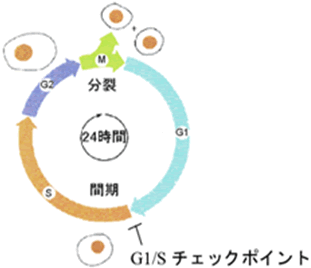
図7 RAPLの機能
RAPLは、p27kip1の核内移行を促進し、G1/Sチェックポイントとして、リンパ球増殖性疾患の抑制に重要な働きをしています。
<用語解説>
- 注1) 自己免疫疾患
- 異物を認識し排除するための役割を持つ免疫系が、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことで症状を来す疾患の総称。自己免疫疾患の1つであるループス腎炎とは、免疫グロブリンと補体分子の複合体が沈着することによって起こる腎炎で、抗DNA抗体などの自己抗体産生の亢進とともに起こる持続性の糸球体腎炎。またSLEも自己免疫疾患である膠原病の一種で、ループス腎炎や他のさまざまな臓器の炎症が起こる。
- 注2) RASSFファミリー
- 細胞のがん化過程に登場し、その機能が失われるとがん化が起きるがん抑制遺伝子と、その機能が活性化するとがん化が起きるがん遺伝子が知られている。RASSFファミリーは、細胞分裂を促進させるがん遺伝子であるRasと拮抗して働く、エフェクターとして同定されたがん抑制遺伝子の1つである。
- 注3) インテグリン
- α鎖とβ鎖の二量体からなる細胞表面分子。接着分子として機能し、リンパ球ではLFA-1などのインテグリンが発現している。
- 注4) 自己寛容
- 特定抗原に対する特異的免疫反応の欠如あるいは抑制状態のことを「寛容」と言い、自己の体組織成分に対する免疫無反応性(自己寛容)は、これに由来する。
- 注5) CDKインヒビター
- 細胞周期は、CDK(cyclin-dependent kinase)/サイクリン複合体が細胞内の因子を特異的に活性化することで進行し、細胞分裂が起こる。細胞周期が異常に活性化されれば、細胞は過度に増殖し、がん化する。CDKに結合し、その活性を阻害する因子を「CDKを阻害する者(インヒビター)」と呼ぶ。p27kip1は主にcyclinE/Cdk2複合体を阻害し、細胞分裂の準備としてのDNA複製を一旦停止させることで、細胞周期が正常かどうかの検問(チェックポイント)として機能している。
<論文名>
“Deficiency of Rap1-binding protein RAPL caused lymphoproliferative disorders through the mislocalization of p27kip1”
(Rap1結合たんぱく質RAPLの欠損によるp27kip1の細胞内局在異常
は、リンパ球増殖性疾患の発症を引き起こす)
doi: 10.1016/j.immuni.2010.12.010
<お問い合わせ先>
<研究に関すること>
木梨 達雄(キナシ タツオ)
関西医科大学附属生命医学研究所 分子遺伝学部門 教授
〒570-8506 大阪府守口市文園町10-15
Tel:06-6993-9445 Fax:06-6994-6099
E-mail:
<JSTの事業に関すること>
河村 昌哉(カワムラ マサヤ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3531 Fax:03-3222-2066
E-mail: