JST 課題解決型基礎研究の一環として、慶應義塾大学 医学部の川内 健史 特別研究講師らは、哺乳類の大脳皮質が作られる際に、神経細胞が移動するための「足」となる分子を同定し、さらに、その「足」を動かす仕組みを解明しました。
大脳皮質が正しく機能するためには、誕生した神経細胞が目的地まで適切に移動して配置されることが重要です。この神経細胞の移動が障害されると、滑脳症(てんかんや精神遅滞を伴う脳奇形)や統合失調症など、多くの脳疾患が引き起こされると考えられています。大脳皮質の神経細胞は、放射状突起と呼ばれる長い突起をつたって移動することは観察されていましたが、神経細胞がどのようにして放射状突起とくっつき、さらに、その突起上を「歩いて」いくのかについては分かっていませんでした。
川内特別研究講師らは今回、大脳皮質の神経細胞が放射状突起とくっつくための「足」の実体が、細胞の表面にあるN-カドヘリンという分子であることを発見しました。さらに神経細胞は、一度その「足」を細胞内に取り込み、前方へと運んでから再びその「足」を細胞表面へと「踏み出す」ことにより、放射状突起の上を「歩いて」いることが分かりました。
本研究は、高次機能を担う大脳皮質がどのようにして作られるのかを理解するという基礎的な意義に加えて、その異常によって引き起こされるさまざまな脳疾患や細胞の移動と関連する種々の疾患の原因究明および治療にも寄与できることが期待されます。
本研究成果は、2010年8月26日(米国東部時間)発行の米国科学雑誌「Neuron」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
: |
「脳神経回路の形成・動作と制御」
(研究総括:村上 富士夫 大阪大学 大学院生命機能研究科 教授)
|
| 研究課題名 |
: |
「細胞内機能ドメインが大脳皮質形成に果たす役割の解明」 |
| 研究者 |
: |
川内 健史(慶應義塾大学 医学部 特別研究講師) |
| 研究実施場所 |
: |
同上 |
| 研究期間 |
: |
平成21年10月~平成26年3月 |
JSTはこの領域で、脳の統合的理解を目指し、新たな視点に立って脳を構成する神経回路の形成やその動作原理並びにその制御機構の解明に挑戦する研究を対象とします。上記研究課題では、脳が働くための基盤となる脳神経回路がどのようにして形成されるかという問題に対して、細胞内機能ドメインの役割から解析し、脳の形成機構およびその破綻による脳疾患の機構に迫ります。
<研究の背景と経緯>
記憶・学習・思考といった脳の機能は、特定の場所に配置された神経細胞が互いにネットワークを作って情報のやり取りを行うことによって実行されます。哺乳類の大脳皮質は、細胞の形態や機能が異なる神経細胞群が脳の奥側から表層にかけて6つの層をなしており、この6層構造が乱れると、てんかんや精神遅滞などを伴う重篤な脳疾患を引き起こします(図1)。すなわち、脳が正しく機能するためには、神経細胞が適切な場所に配置されることが非常に重要となります。
大脳皮質が作られる過程において、神経細胞を産み出すもととなる神経前駆細胞や神経幹細胞は、大脳皮質の脳室側(脳の奥側;図1参照)のみに存在し、その場所で神経細胞を産み出します。そのため、大脳皮質の6層構造を作るためには、脳室近辺で誕生した神経細胞が表層の決められた位置まで移動しなければなりません。神経細胞は、いくつかの異なる移動様式による多段階の移動を行いますが、移動過程の大半は、脳の奥側から表層にかけて伸びている放射状突起と呼ばれる長い突起をつたって移動する様式であることが知られています(図2)。このような「放射状突起をつたった神経細胞の移動」は、1970年代にアメリカのグループによってすでに観察されていましたが、大脳皮質の神経細胞がどのような分子を使って放射状突起にくっついているのか、また、その分子をどのように動かして表層へと移動しているのかについては、長い間謎でした。
<研究の内容>
川内特別研究講師らはこれまでに、簡便な個体への遺伝子導入法などを用いることにより、移動神経細胞の形態変化を制御する分子を世界で初めて同定することに成功しており(参考文献1)、その後も、移動神経細胞が多段階の形態変化を起こすために必要な細胞内の分子のいくつかを明らかにしてきました(参考文献2、参考文献3)。
本研究では、これまでの細胞内分子の研究で確立してきた解析手法を応用することにより、大脳皮質の移動神経細胞が放射状突起にくっつくための「足」となる分子が、細胞の表面にあるN-カドヘリン注1)という細胞接着分子の1つであることを同定しました(図3)。発生期の大脳皮質においてN-カドヘリンの発現を抑制した神経細胞は、放射状突起に沿って表層へと移動することができませんでした。
細胞が移動するためには、後ろ側の「足」を「地面」(放射状突起)から離して前へと踏み出すことが必要であることから、N-カドヘリンはずっと放射状突起にくっついたままではなく、進行方向の後ろ側にあるものは次々と回収されているであろうことが予想されます。そこで、大脳皮質の神経細胞において、細胞の表面にある分子を細胞内へ取り込む過程(これをエンドサイトーシス注2)と言います)を阻害する実験を行いました。その結果、その神経細胞は放射状突起にくっつくことはできましたが、その後、表層へ向かって動くことはできませんでした。この神経細胞の細胞表面のN-カドヘリン量は増加していたことから、エンドサイトーシスを阻害した神経細胞は、細胞表面のN-カドヘリンを細胞内へと回収することができず、このために表層へ向かって移動することができなかったと考えられます。
では、細胞内に取り込まれたN-カドヘリンは、その後どうなるのでしょうか。一般に、エンドサイトーシスされた分子は、そのまま分解されることもあれば、再び細胞表面へ運ばれてリサイクルされることもあります。そこで、細胞内で分解される経路(分解経路)や細胞表面へリサイクルされる経路(リサイクル経路)を、移動神経細胞の中でそれぞれ遮断する実験を行ったところ、リサイクル経路を遮断した場合のみ、放射状突起に沿った神経細胞移動が障害されました。また、リサイクル経路を遮断した神経細胞は、細胞の中に異常なN-カドヘリンの蓄積が見られたことから、この細胞はN-カドヘリンの輸送が異常になっていることが分かりました。すなわち、正常な移動神経細胞では、N-カドヘリンは、細胞内へと取り込まれた後、リサイクル経路により、再び前方の細胞表面へと運ばれていると考えられます(図4)。
これら一連の研究により、神経細胞は、N-カドヘリンという「足」を一度引っ込めて(細胞内に取り込んで)から、それをリサイクルして前方へと運ぶことにより次の一歩を踏み出し、放射状突起の上を移動していることが明らかとなりました。
<今後の展開>
神経細胞移動の異常は、てんかんや精神遅滞を伴う脳奇形のみならず、統合失調症などの高次脳機能疾患とも関連があると言われています。本研究は、これらの脳疾患の原因究明および新しい治療法の開発につながることが期待されます。
大脳皮質の6層構造は、哺乳類のみに見られる構造です。この6層構造がどのようにしてできるかをさらに解析していくことにより、記憶・学習・思考などを司る脳の構造と機能の理解に大きく寄与するものと期待されます。
細胞が移動するという現象は、脳に限らず、多くの組織の発生においても重要であり、さらにはがん細胞の転移などにも深い関連があります。N-カドヘリンは、がん細胞の転移とも関係する可能性が示唆されていることから、本研究の成果は、神経科学分野のみならず、広範囲の生命科学分野や医学生物学分野にも貢献するものと期待されます。
<付記>
本研究は、先端医療研究財団の鍋島 陽一 先端医療センター長(研究当時は京都大学 大学院医学研究科 教授)、国立精神・神経医療研究センター 神経研究所の星野 幹雄 研究部長(研究当時は京都大学 大学院医学研究科 助教)、慶應義塾大学 医学部の仲嶋 一範 教授との共同で行ったものです。
<参考図>
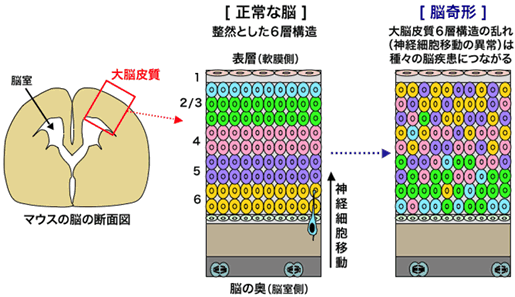
図1 哺乳類の大脳皮質の構造
哺乳類の大脳皮質(図はマウスの大脳皮質の模式図を示しています)は、細胞の形や機能が異なる神経細胞群(図では色分けしてあります)が積み重なった6層構造を示します。この6層構造が乱れると、種々の脳疾患が引き起こされることが知られています。
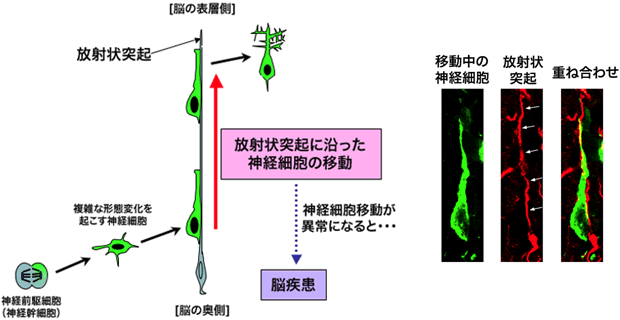
図2 発生期の大脳皮質における神経細胞の移動様式
神経前駆細胞から産み出された神経細胞は、複雑な形態変化を起こした後、放射状突起をつたうようにして、長い距離を移動します。この移動は、図1で示した6層構造の形成に必須であり、神経細胞移動の異常は脳疾患と深い関連があります。右の3枚の写真は、移動中の神経細胞(緑)と放射状突起(赤)の実際の写真です。神経細胞は放射状突起(白矢印で示したもの)をつたうようにして移動していることが分かります。
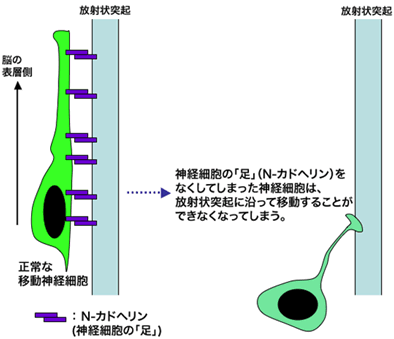
図3 神経細胞はN-カドヘリンを使って放射状突起の上を移動する
発生期の大脳皮質において、N-カドヘリンの発現を抑制すると、放射状突起に沿った神経細胞の移動が障害されました(図の右側の細胞)。この実験より、移動中の神経細胞は、N-カドヘリンを使って、放射状突起の上を移動していることが分かりました(図の左側の細胞)。
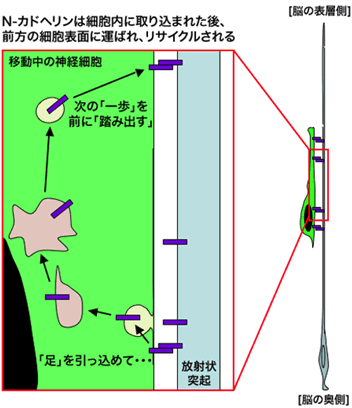
図4 移動神経細胞が「足」を前へ踏み出す仕組み
本研究により、移動神経細胞は、いったん「足」(N-カドヘリン)を引っ込めた後、それを細胞の前方まで運んで再び放射状突起と接着させることにより、前へ進んでいることが示唆されました。
<用語解説>
- 注1) N-カドヘリン
- N-カドヘリンは、細胞と細胞を接着させる分子(細胞接着分子)の1つです。隣り合う2つの細胞は、それぞれの細胞表面にある細胞接着分子が互いに結合することにより、ちょうど手をつなぐようにして接着します。細胞接着分子は非常にたくさんの種類がありますが、N-カドヘリンは、主にN-カドヘリン同士が手をつなぐことによって細胞を接着させ、他の細胞接着分子とはほとんど手をつなぐことはありません。
- なお本研究では、神経細胞の表面にあるN-カドヘリンが、放射状突起の上を「歩く」ために必要であることを発見しました。この働きは「手をつなぐ」というより「歩くための足」に近いので、N-カドヘリンのことを移動する神経細胞の「足」と表現しています。
- 注2) エンドサイトーシス
- 細胞の表面には、N-カドヘリンのように細胞と細胞をつなぐ分子(細胞接着分子)や細胞外からの刺激を受け取る分子(受容体)など、多くの分子が存在します。これらの分子は、外部からの刺激などに応答して、細胞の中へと取り込まれることがあります。この、細胞表面にある分子が細胞内へと取り込まれる過程のことを、「エンドサイトーシス」と呼びます。
<論文名>
“Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-Cadherin trafficking”
(Rabファミリー低分子量Gたんぱく質依存的なエンドサイトーシス経路は、N-カドヘリンの細胞内輸送を介して、神経細胞の移動と成熟を制御する)
doi: 10.1016/j.neuron.2010.07.007
<参考文献>
参考文献1:
Kawauchi T et al. “The in vivo roles of STEF/Tiam1, Rac1 and JNK in cortical neuronal migration”
EMBO J. 22, 4190-4201 (2003).
参考文献2:
Kawauchi T et al. “Cdk5 phosphorylates and stabilizes p27kip1 contributing to actin organization and cortical neuronal migration”
Nature Cell Biol. 8. 17-26 (2006).
参考文献3(日本語総説):
川内 健史「細胞内現象からみた大脳皮質形成のメカニズム―“in vivo細胞生物学”による神経発生研究の展開―」 蛋白質核酸酵素 53, 1957-1967 (2008).
<お問い合わせ先>
<研究に関すること>
川内 健史(カワウチ タケシ)
慶應義塾大学 医学部 解剖学教室 特別研究講師
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3743 Fax:03-5379-1977
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)
科学技術振興機構 イノベーション推進本部 研究推進部(さきがけ担当)
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3525 Fax:03-3222-2067
E-mail: