JST 課題解決型基礎研究の一環として、大阪大学 大学院工学研究科の松村 浩由 准教授らと東京大学医科学研究所の中村 義一 教授らは、RNAアプタマーが標的分子を捕捉する新しい仕組みを構造解析によって明らかにしました。
RNAアプタマーは、たんぱく質などの標的分子に強く結合する核酸分子です。RNAアプタマーが結合したたんぱく質はその働きが特異的に妨害されるため、治療困難とされている疾患の治療薬となるものと期待されています。しかし、RNAは「マイナス」の静電気を帯びているため、「プラス」の静電気を帯びたたんぱく質でなければ強く結合できないと考えられており、多種多様なたんぱく質に対して強く結合するRNAアプタマーを自在に開発できるのかといった疑問の声もありました。
本研究グループは今回、先に開発していたプラスとマイナスの引力だけではない力で結合するRNAアプタマーと、たんぱく質が結合した複合体の立体構造をX線結晶構造解析注1)によって初めて明らかにしました。その結果、RNA自身が持つしなやかな造形力を利用して標的たんぱく質の形に合わせた構造を作り出し、標的たんぱく質を捕捉することができることを見いだしました。
この研究によってアプタマーデザインの基盤が確立できたことから、これまで標的とされなかったたんぱく質に対してRNAアプタマーを作ることにより、抗体医薬に代わる次世代分子標的医薬(RNAアプタマー医薬注2))が開発できます。また、今回のRNAアプタマーを用いれば、医薬品用のヒト化抗体たんぱく質が高純度、かつ、今までよりも簡単な方法で得られるため、抗体医薬の開発の発展にも役立つものと期待されます。
本研究は、大阪大学 大学院工学研究科の森 勇介 教授らと共同で行われ、本研究成果は、2010年7月29日(英国時間)に英国科学雑誌「Nucleic Acids Research」のオンライン速報版で公開されます。また、同誌の上位5%に相当する「Featured Article」にも選ばれます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「生命現象の解明と応用に資する新しい計測・分析基盤技術」
(研究総括:柳田 敏雄 大阪大学 大学院生命機能研究科 教授) |
| 1) |
研究課題名 |
: |
「タンパク質完全結晶創成」 |
| 研究代表者 |
: |
森 勇介(大阪大学 大学院工学研究科 教授) |
| 共同研究者 |
: |
松村 浩由(大阪大学 大学院工学研究科 准教授)、安達 宏昭(株式会社 創晶 代表取締役社長) |
| 2) |
研究課題名 |
: |
「多目的RNAナノセンサー・モジュレーターの開発」 |
| 研究代表者 |
: |
中村 義一(東京大学医科学研究所 基礎医科学部門 教授) |
| 共同研究者 |
: |
坂本 泰一(千葉工業大学 工学部生命環境科学科 准教授)、宮川 伸(株式会社 リボミック 探索研究部長) |
| 研究期間 |
: |
ともに平成17年10月~平成23年3月 |
JSTはこの領域で、生命系科学技術の発展の原動力である未解明の生命現象の解析に資する新たな計測・分析に関する基盤的な技術の創出を目指しています。
<研究の背景と経緯>
RNAアプタマーは、たんぱく質などの標的分子に対して抗体のような高い親和性と高い特異性を有するRNA分子で、化学合成で大量合成が可能で改良も容易であるといった抗体にはない特徴を持っています。そのため医薬品や工業への応用が期待され、実用化に向けた研究が精力的に行われています。
しかし、RNAが「マイナス」の静電気を帯びているため「プラス」の静電気を帯びたたんぱく質しか標的にしにくいこと、また、たんぱく質とRNAアプタマーの複合体の立体構造がほとんど解明されておらず、その作用機構が不明であることなどの課題も残されていました。従って、プラスの静電気をあまり帯びないたんぱく質と強く結合するRNAアプタマーを開発し、かつ、その作用機構を明らかにすることができれば、新しいRNAアプタマーをデザインし、その機能をコントロールすることが可能となると期待されていました。
東京大学医科学研究所の中村教授らは2008年に、人間が持つ最も一般的な抗体で、プラスの静電気の部分が少ないIgGのFcドメイン(hFc)注3)に結合するRNAアプタマーの配列の特定に成功しています。このRNAアプタマーには6番目のウラシル(U6)の2’フルオロ化の修飾注4)が重要であること、ヒトIgGに特異的に作用するが他種生物のIgGには全く結合しないといった特徴があります(参考文献1)。また、抗体医薬の精製には抗体結合たんぱく質「プロテインA」を固定化したカラムが用いられていますが、中村教授らが取得したRNAアプタマーはプロテインAに代わることができます。プロテインAのカラムを用いた場合、酸性条件にすることによって抗体を溶出していますが、このアプタマーを用いると中性条件で二価の陽イオンを除くことでIgGを溶出することができ、抗体医薬品の精製において非常に有利です。
さらに本研究グループは2008年に、新しい結晶化技術を駆使してhFcとRNAアプタマーの複合体の高品質な結晶を得ることにも成功しています(参考文献2)。
<研究の内容>
本研究グループは今回、X線結晶構造解析法を用いて2008年に得たhFcとRNAアプタマーの複合体の高品質な結晶の立体構造解析を行い、高解像度(2.15Å分解能)で立体構造を明らかにしました。RNAアプタマーはhFcに2つ結合しており(図1)、以下のことが分かりました。
 RNAアプタマーがhFcとプラスとマイナスではない力で相互作用できる。
RNAアプタマーがhFcとプラスとマイナスではない力で相互作用できる。
一般に、RNAはマイナスに帯電しているためプラスに帯電しているたんぱく質表面に結合します(図2右)。本研究チームは今回、RNAアプタマーがプラスに帯電していないhFcの表面に結合できることを見いだしました(図2左)。このたんぱく質は結合前と結合後でその構造をほとんど変化させなかったことから(図3)、RNAアプタマーがたんぱく質の表面の形に沿った構造を作り出し、強い結合力を発揮することが示されました。この“RNAのしなやかな造形力”を利用すれば、新たな分子標的医薬品(アプタマー医薬品)が開発できます。
 RNAアプタマーのhFcとの相互作用をコントロールできる。
RNAアプタマーのhFcとの相互作用をコントロールできる。
カルシウムイオンがこのRNAアプタマーに結合することが分かりました。カルシウムイオンは、RNAアプタマーの深い溝に結合し(図1)、アプタマーの立体構造を保持していました。そこでカルシウムイオンを人為的に添加・除去したところ、RNAアプタマーとhFcとの結合が見事にコントロールできることが分かりました(図4)。
また本研究から、RNAアプタマーのU6に2’フルオロ化により付加されたフッ素原子(2’F)がRNAアプタマーの7番目のグアニジン(G7)の水素原子(H8)と相互作用すること、またこちらもRNAアプタマーの構造形成に重要であることが分かりました(図5)。U6の2’Fを違う原子に変えるだけで結合しないことも確認できました。
このように、RNAアプタマーの結合を簡便にコントロールできる技術が開発されたことにより今後、RNAアプタマーの医薬品だけでなく抗体精製などの工業的な利用も期待できます。
 RNAアプタマーは、ヒトIgGに特徴的なアミノ酸を認識することで非常に高い特異性を得ている。
RNAアプタマーは、ヒトIgGに特徴的なアミノ酸を認識することで非常に高い特異性を得ている。
RNAアプタマーとhFcの複合体の構造解析から、RNAアプタマーはhFcの342番目のグルタミン酸(Q342)の周りを取り囲むように結合していることが分かりました(図6)。Q342はヒトIgGに特徴的なアミノ酸であることから、RNAアプタマーはこの1つのアミノ酸であるQ342を認識することで非常に高い特異性を得ていることが分かりました(図7)。このように、非常に微小な部分(1つのアミノ酸)を特異的に認識することは抗体では困難であると予想され、この特徴を生かせば標的特異性の高い新たなアプタマー医薬品の開発につながるものと期待されます。
本研究で用いたアプタマーの標的分子であるhFcは、もともとRNA結合たんぱく質ではありません。このように、たんぱく質に結合することができるRNAアプタマーの重要な作用機構の詳細を解明したのは世界で初めてのことで、RNAの新たな可能性を切り開くものです。また、人工RNAである2’F修飾RNAとたんぱく質の複合体の解析も世界で初めての結果で、インパクトの高いものです。
<今後の展開>
本研究では、ヒトIgGに特異的に結合するRNAアプタマーとヒトIgGの複合体の詳細な構造を解明し、そのRNAアプタマーがたんぱく質を捕らえる新しい仕組みを明らかにしました。さらに、カルシウムイオンを用いたRNAアプタマーの結合のコントロールにも成功しました。このアプタマーを使うことでヒト化抗体やhFc融合たんぱく質を中性で精製することが可能になり、プロテインAに代わって今までよりも簡単な方法で抗体医薬品精製を行えるようになります。また、本研究のような新しいたんぱく質とRNAの相互作用の基盤とその機能コントロール技術は、次世代医薬品であるRNAアプタマー医薬品の開発に直接利用できます。
<参考図>
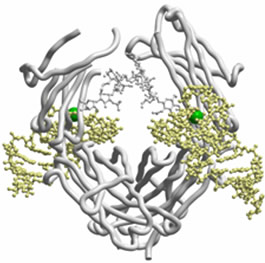
図1 ヒトIgGとRNAアプタマーの立体構造
2つのRNAアプタマー(黄)がヒトIgGのFcドメイン(白)を挟み込むようにして結合していることが分かった。また、RNAアプタマーにはカルシウムイオン(緑)が結合している。
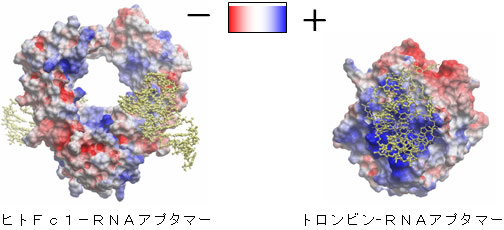
図2 たんぱく質の表面電荷
たんぱく質の表面にプラス(青)とマイナス(赤)の静電気を表示させた。RNAアプタマーは黄色のスティックで表している。トロンビンではたんぱく質のプラスに帯電した部分にRNAアプタマーが相互作用しているのに対して、ヒトFcとの相互作用部位にはそのような電荷の偏りは見られない。
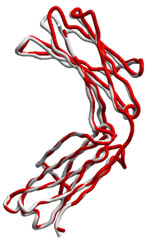
図3 RNAアプタマー結合前(白)と結合後(赤)のhFc1の立体構造
Fcの立体構造は、RNAアプタマーが結合することによってほとんど変化していない。
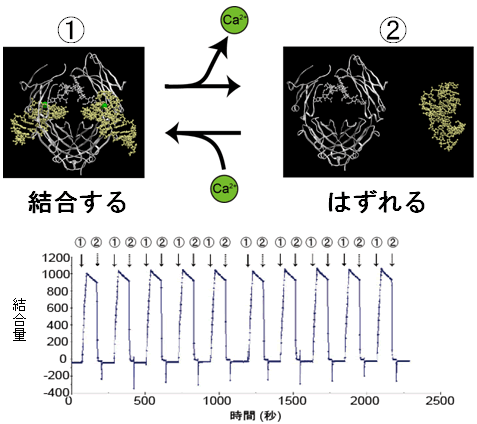
図4 RNAアプタマーの結合実験
 RNAアプタマーとFcの結合試験の結果。アプタマーにカルシウムイオン(Ca2+)とFcを加えることでレスポンスが上昇し、結合が見られた。
RNAアプタマーとFcの結合試験の結果。アプタマーにカルシウムイオン(Ca2+)とFcを加えることでレスポンスが上昇し、結合が見られた。 その状態からCa2+を除くことで、レスポンスが低下し、乖離(かいり)が確認できた。また、これらは何度でも繰り返し再現可能であった。
その状態からCa2+を除くことで、レスポンスが低下し、乖離(かいり)が確認できた。また、これらは何度でも繰り返し再現可能であった。
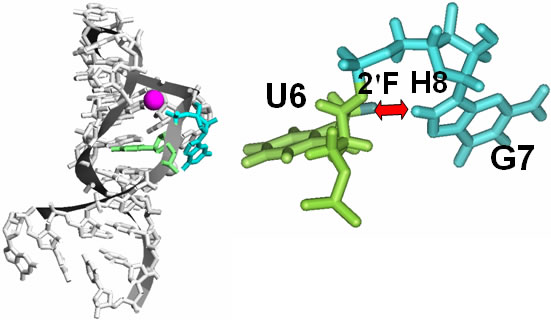
図5 複合体におけるRNAアプタマーの立体構造
(左)カルシウムイオンの結合部位
(右)U6の2’FとG7のH8との相互作用
RNAアプタマーにはカルシウムイオン(赤紫)が結合し、U6の2’Fによる相互作用によってその構造を形成していた。このように、U6の2’Fの重要性とカルシウムイオンによる機能発現が明らかになった。
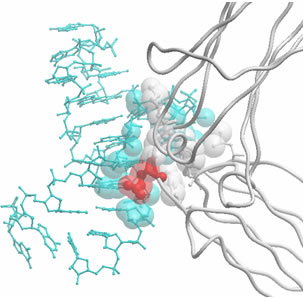
図6 hFc1とRNAアプタマーの相互作用面
RNAアプタマー(青)がhFc1(白)の表面にフィットするような構造を形成していることが分かる。ここでQ342(赤)は一番相互作用が大きく、ヒトIgGに特異的なアミノ酸であることから、Q342を認識することで高い特異性を得ている。

図7 RNAアプタマーの非常に高い特異性
プロテインAでは他種生物のIgGにも相互作用しているが、RNAアプタマーはヒトIgGにのみ、非常に特異的に相互作用している。
<用語解説>
- 注1) X線結晶構造解析
- 結晶化した分子の三次元構造をX線の回折を利用して詳細に観察することができる実験的な手法の1つ。たんぱく質などの結晶にX線を照射すると多数のさまざまな大きさの斑点からなる回折像が形成されますが、この回折像の斑点の位置や大きさから結晶内の原子や分子の位置が計算できます。この方法で分子を詳細に観察するためには、その分子からなる高品質結晶が必要ですが、特に今回のようなたんぱく質とRNAとの複合体の場合には高品質結晶の作製が困難で、X線結晶構造解析におけるボトルネックとなっています。
- 注2) RNAアプタマー医薬
- 近年、RNAアプタマー医薬は抗体医薬に代わる次世代医薬として注目されています。すでに海外では加齢黄斑変性症の治療薬が上市されており、数種類が臨床試験中です。
- 注3) Fcドメイン(hFc)
- ヒトIgGには、さまざまな抗原を認識するための変化に富んだ可変領域と、常に変わらない定常領域とがあります。この定常領域の一部がFcドメインです。抗体医薬品に使われるキメラ抗体やヒト化抗体では定常領域をヒトのものにしています。
- 注4) 2’フルオロ化の修飾
- 核酸医薬を生体内で活性を発現させるために、RNAのリボースの2’部位にフルオロ化(2’F)して生体内の分解酵素に対する耐性を持たせる必要があります。このように修飾されたアプタマーは、生体内での天然のRNAの10,000倍以上安定性が向上します。
<論文名>
“Conformational plasticity of RNA for target recognition as revealed by the 2.15Å crystal structure of a human IgG-aptamer complex”
(2.15Å分解能のヒトIgG-アプタマー複合体結晶構造により明らかとなったターゲット認識のためのRNAの構造可塑性)
doi: 10.1093/nar/gkq615
<参考文献>
1.Structural and molecular basis for hyperspecificity of RNA aptamer to human immunoglobulin G
RNA 14 1154-1163 (2008)
2.Crystallization and preliminary X-ray diffraction studies of an RNA aptamer in complex with the human IgG Fc fragment
Acta Cryst. F64, 942-944 (2008)
<お問い合わせ先>
<研究に関すること>
松村 浩由(マツムラ ヒロヨシ)
大阪大学 大学院工学研究科 准教授
〒565-0871 大阪府吹田市山田丘2-1
Tel:06-6879-7410 Fax:06-6879-7409
E-mail:
中村 義一(ナカムラ ヨシカズ)
東京大学医科学研究所 基礎医科学部門 教授
〒108-8639 東京都港区白金台4-6-1
Tel:03-5449-5307 Fax:03-5449-5415
E-mail:
<JSTの事業に関すること>
長田 直樹(ナガタ ナオキ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: