
HOME 研究代表者・研究課題 平成24年度採択 横田隆徳

画期的な新規核酸医薬の分子技術の創出
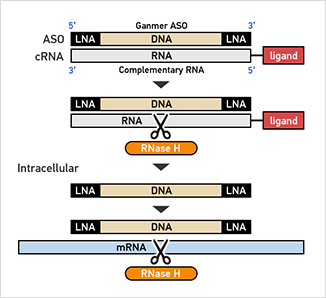
DNA/RNAヘテロ核酸の作用機序:
細胞内でDNA/RNAヘテロ2重鎖を細胞内のRNaseHが認識してligandの結合したRNA鎖を切断してunwindした後に標的も切断する。
急速な高齢化の下「元気な老い」を実現すべく、分子メカニズムが明らかになりつつあるアルツハイマー病、がん性疼痛などの難病を克服するために、医薬工の分野横断的な本研究により私たちが独自に開発した新規の核酸医薬を発展させ、既存薬では成し得なかった難病の原因分子の制御を達成します。これによりさまざまな難病に対して、副作用が少なくかつ内服が可能な根本的治療薬を開発し、日本発の基幹的な分子技術として新たな創薬産業分野を創成し、国際貢献を目指します。
- 従来のアンチセンス核酸やRNA干渉(siRNA)と分子構造も作用機序も異なる第3の核酸医薬であるDNA/RNAヘテロ核酸。
- アンチセンス核酸やRNA干渉(siRNA)よりもはるかに高効率の標的遺伝子抑制効果を示す。
- DNA/RNAヘテロ核酸自身が細胞分子生物学的に新規の現象である可能性がある。
- DNA/RNAヘテロ核酸には脂質、ペプチド、抗体、糖鎖のいずれのリガンド分子の結合が可能であり、それぞれの標的臓器、細胞に適したリガンドを選択できる。
- 横田 隆徳
- 東京医科歯科大学
大学院医歯学総合研究科
脳神経病態学分野
教授 研究室HP
主たる共同研究者
- 和田 猛
- 東京理科大学
薬学部
教授 - 小比賀 聡
- 大阪大学
大学院薬学研究科
教授 - 村上 正裕
- 大阪大谷大学
薬学部
教授 - 津本 浩平
- 東京大学
大学院工学研究科
教授
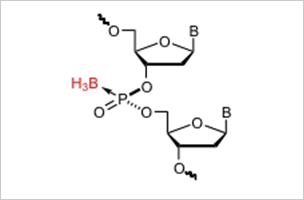
図1:リン原子の立体が制御されたボラノホスフェート型人工核酸
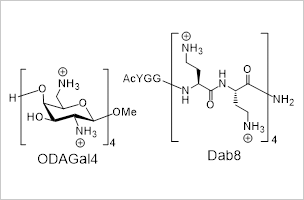
図2:ヘテロ二本鎖核酸を高度に安定化する人工カチオン性分子
これまでの研究成果(インパクト)
- げっ歯類のみならず霊長類においてもヘテロ2本鎖核酸の遺伝子制御効果を明らかにした。
- リン原子の立体が厳密に制御されたボラノホスフェート型人工核酸の高効率合成法を確立し、その性質を明らかにした。(図1)。
- 人工カチオン性オリゴ糖、オリゴペプチドが、RNase Aによるヘテロ二本鎖核酸の分解をほぼ完全に抑制することを明らかにした(図2)。なた、ヘテロ二本鎖核酸に応用可能なDab8-DNAコンジュゲートの合成法を確立した。
- 核酸塩基部に修飾を施した糖部架橋型核酸BNAP-AEOを合成し、相補鎖核酸に対する極めて優れた親和性を有することを見出した。
- ビタミンE化学修飾ヘテロ二本鎖核酸をTJ修飾剤と注腸剤としてマウスに繰り返し投与することにより、総コレステロール値および血清中トリグリセリド値を有意に抑制できることを実証した。
- 脳血管内皮細胞に対して特異的に結合するリガンドの候補となるドメイン抗体を複数決定することができ、これまでに確立されたコンジュゲー ト技術との組み合わせにより核酸を脳内へ送達させる分子を開発する基盤が整った。
今後の進め方
- 更なる有効性や異なる応用性を発揮する新規の分子構造のヘテロ核酸を提案・開発を進める。
- 高活性ヘテロ2本鎖核酸の分子選択とリン原子絶対立体配置の決定手法を開発する。
- ヘテロ2本鎖核酸に人工カチオン性分子を結合させ、腸管ヌクレ アーゼ耐性や細胞やマウスへ投与した際の影響を評価 を行う。
- BNAP-AEOのアンチセンス遺伝子発現抑制効果を検証する。BNAP-AEOの誘導体を合成し、更なる二重鎖形成能向上を図る。ヘテロ2本鎖核酸・リン原子上のキラリティ制御法へ応用を試みる。
- 経腸製剤化の基礎検討及びDDSの試作・評価を行う。
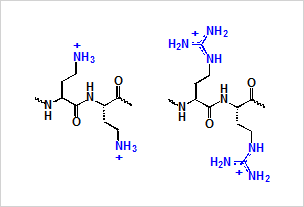
図1:ヘテロ二本鎖核酸を高度に安定化するカチオン性ペプチド
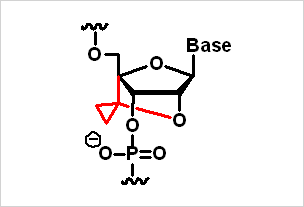
図2:新規糖部架橋型人工核酸 (シクロプロパン導入型(T,mC,A,G) )
これまでの研究成果(インパクト)
- リン原子の立体異性が厳密に制御された人工核酸の高効率合成法を確立した。カチオン性ペプチドがヘテロ2本鎖核酸を熱力学的に安定化し、分解酵素の耐性を劇的に向上させることを見出した(図1) 。
- 新規な糖部架橋型核酸であるシクロプロパンにおいて全4種の核酸塩基 (T,mC,A,G) の合成に成功した(図2)。核酸塩基部に修飾を施した糖部架橋型核酸を合成し、相補鎖核酸に対する優れた親和性を有することを見出した。
- ビタミンE結合ヘテロ2本鎖核酸においてリポ蛋白が血中輸送及び細胞内取り込みに関与することを明らかにした。また、高い遺伝子抑制効果を保ちつつ、実用化への障壁となる肝毒性の軽減に成功した。
- ヘテロ2本鎖核酸の経大腸投与による遺伝子抑制に成功した。
今後の進め方
- 高活性であるヘテロ2本鎖核酸の分子選択とリン原子立体配置の決定手法の開発。ヘテロ2本鎖核酸にカチオン性ペプチドを結合させ、臨床応用を目指す。
- 現在までの分子技術を用いて、更なる有効性や異なる応用性を発揮する新規の分子構造のヘテロ2本鎖核酸を提案・開発を進める。
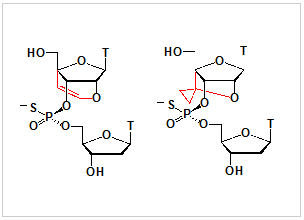
図1:リン原子立体制御架橋型新規人工核酸
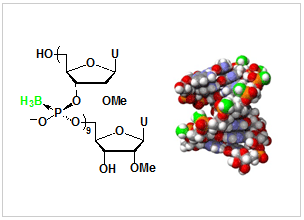
図2:リン原子の立体が制御されたボラノホスフェート型人工核酸
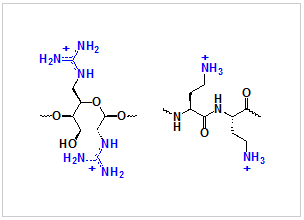
図3:ヘテロ2本鎖核酸に結合するカチオン性分子
これまでの研究成果(インパクト)
- 新規な糖部架橋構造を有する人工核酸の合成及び、リン原子の立体異性が厳密に制御されたホスホロチオエート型人工核酸の合成に成功した(図1)。
- リン原子の立体異性が厳密に制御されたボラノホスフェート型人工核酸の合成に成功した(図2)。
- ヘテロ2本鎖核酸に結合し安定化する新規構造のカチオン性分子の合成に成功した(図3)。
今後の進め方
- 絶対立体配置を有するホスホロチオエートを様々に組み合わせたヘテロ2本鎖核酸を合成し、その有効性 を評価する。
- ヘテロ2本鎖核酸にカチオン性人工ペプチドを結合させ、腸管内分解酵素であるヌクレ アーゼへの耐性を評価する。
- 新たに設計した架橋型人工核酸のRNA結合親和性・酵素耐性能の評価を行い、リン原子上の立体異性制御により最適化を検討する。
- ヘテロ2本鎖核酸のより最適化した核酸構造を開発する。
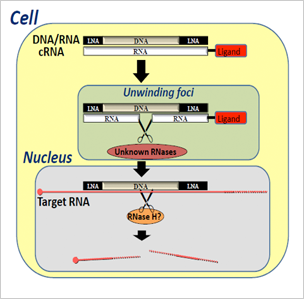
図1:DNARNAヘテロ核酸の細胞内機序
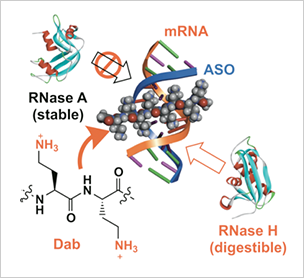
図2:ヘテロ2本鎖核酸に結合する
カチオン性オリゴペプチド
これまでの研究成果(インパクト)
- ヘテロ核酸の細胞内動態において、細胞質内の特定の部位での2本鎖の解離がおこることを明らかにした(図1)。
- プロトタイプの糖部架橋構造を有するリン原子の立体が厳密に制御されたホスホロチオエート13量体の自動合成に成功した。
- A型2重らせん構造を有するDNA/RNA二重鎖核酸に結合し、RNAse A耐性を向上させ、かつRNase H活性を向上させる新規カチオン性オリゴペプチドの合成に成功した(図2)。
- 高い遺伝子発現抑制効果を維持しつつ、リン原子上のキラリティー制御に適すると予想される新たな架橋型人工核酸を設計・合成しオリゴヌクレオチドへの導入にも成功した。
- 前年度確立したIn vitro評価系において、各種吸収促進剤の腸管上皮透過性に及ぼす効果を比較検討した。
今後の進め方
- 新たに設計した架橋型人工核酸のRNA親和性・酵素耐性能の評価を行い、リン原子上のキラリティー制御により適合性を検討する。
- ヘテロ核酸分子の腸管上皮透過性及び安定性とその改善に関する検討を行う。
- ヘテロ2本鎖核酸にカチオン性人工ペプチドを結合させ、腸管ヌクレ アーゼ耐性を評価する。
- ヘテロ2本鎖核酸の核内移行の機序を検討して、最適分構造を検討する。
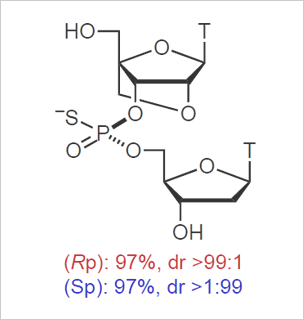
図1:リン原子立体制御架橋型人工核酸
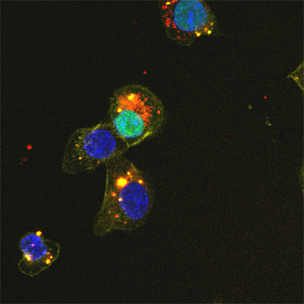
図2:キメラ2本鎖核酸の2本鎖の細胞内局在
これまでの研究成果(インパクト)
- プロトタイプの糖部架橋構造を有するモノマーを立体選択的に合成し、リン原子の立体が厳密に制御されたホスホロチオエート2量体の固相合成および13量体の小スケール自動合成に成功した(ジアステレオ選択性>99:1:図1)。
- A型2重らせん構造を有する2本鎖核酸の主溝に結合する新規カチオン性オリゴ糖の合成に成功した。
- リン原子上のキラリティー制御により適合する架橋型人工核酸として、架橋部位の構造を改変した新規分子を設計し、合成に着手した。
- キメラ2本鎖核酸に特有の細胞内局在と2本鎖の細胞内における分離(unwind)の部位について知見を得た(図2)。
- Gapmerアンチセンス核酸の長さの原理(鎖長が短いほど有効)を打ち破る新規のアンチセンス核酸分子デザインを考案して特許申請した。
- 核酸分子の経腸デリバリーの最適化研究に用いるin vitro評価系として、ヒト結腸a癌由来Caco-2細胞の単層培養系を改良を行って、高い濃度での脂肪酸ミセルの評価が可能な系を確立した。
今後の進め方
- 種々の絶対立体配置を有するホスホロチオエート13量体を合成し、アンチセンス活性を評価する。
- 二本鎖キメラ型ASOにカチオン性人工ペプチドを結合させ、エンドヌクレアーゼ耐性を評価する。
- 新たに設計した架橋型人工核酸のRNA親和性・酵素耐性能の評価を行い、リン原子上のキラリティー制御により適合性を検討する。
- キメラ2本鎖核酸のより最適化した、核酸構造を探索する。
