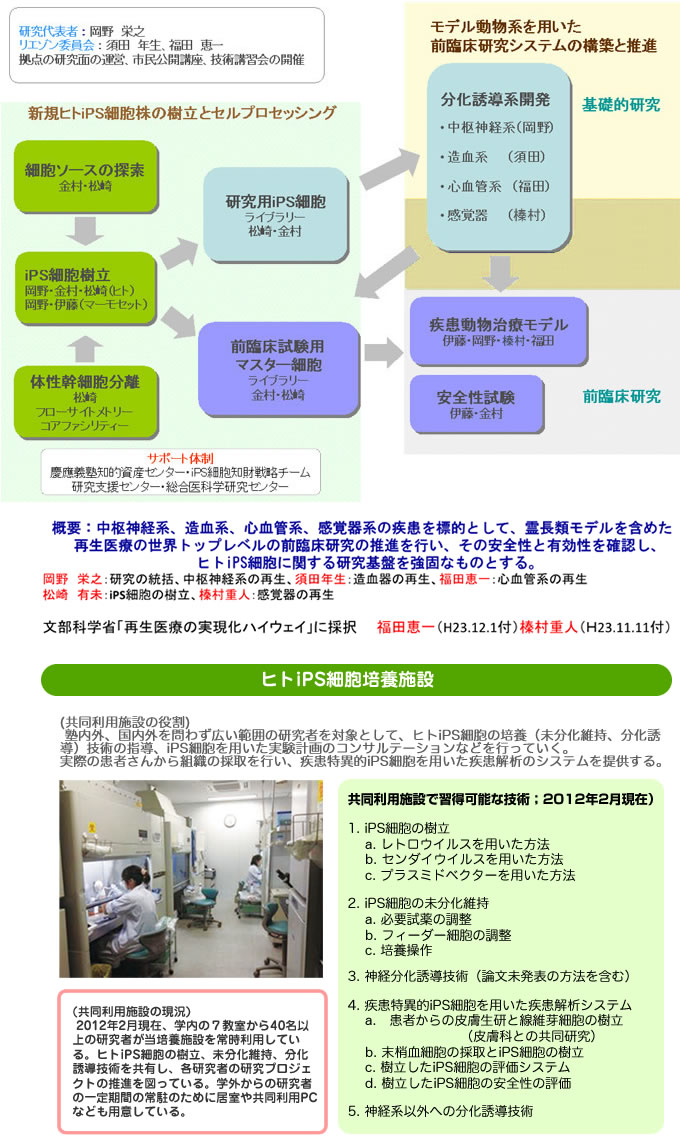
拠点事業紹介
iPS拠点事業
研究目的・概要
再生医療実現化を目指したヒトiPS細胞・ES細胞・体性幹細胞研究拠点
目 的
ヒトiPS細胞を始めとした多能性幹細胞の神経系、心血管系、造血系、感覚器への分化制御機構についての解析と誘導法の開発を行います。また、これら多能性幹細胞由来細胞を用い、ユニークな霊長類疾患モデルによる前臨床研究を行い、ヒトiPS細胞やES細胞を用いた再生医療の実現化を目標にします。
実施体制
研究代表者
| 岡野 栄之 | (慶應義塾大学 医学部 生理学教室 教授) |
分担代表研究者
| 中村 雅也 | (慶應義塾大学医学部整形外科学教室 准教授) |
| 須田 年生 | (慶應義塾大学医学部発生分化学教室 教授) |
| 福田 恵一 | (慶應義塾大学医学部再生医学教室(循環器) 教授) |
| 榛村 重人 | (慶應義塾大学医学部眼科学教室 准教授) |
| 松崎 有未 | (慶應義塾大学医学部生理学教室 特任准教授) |
| 羽鳥 賢一 | (慶應義塾大学大学院理工学研究科 特任教授) |
| 金村 米博 | (国立病院機構大阪医療センター 臨床研究センター再生医療研究室 室長) |
| 伊藤 豊志雄 | (公益財団法人 実験動物中央研究所 マーモセット研究部 部長) |
最新の研究成果・進捗状況
1)皮膚の細胞から2週間で神経幹細胞を作製することに成功
マウスおよびヒトの線維芽細胞にiPS細胞を作る4つの因子(Oct4, Sox2, Klf4, cMyc)を導入したのち、iPS細胞を作らずに神経幹細胞を誘導する培養条件で培養を行ったところ、約2週間で神経幹細胞を作製することに成功しました。この神経幹細胞(diNSC :directly induced neural stem cell)は、iPS細胞やES細胞から誘導した神経幹細胞に比べて極めて速いスピードで分化成熟するため、培養条件を工夫することにより、分化しにくく腫瘍のもとになる細胞と区別して培養することが可能になります。この方法によってヒトにおいても約2週間で線維芽細胞から神経幹細胞を誘導することが可能になりました。今後安全性をさらに検討したうえで、迅速な細胞移植を必要とする脊髄損傷などの急性神経損傷や筋萎縮性側索硬化症(ALS)などの急速に進行する神経変性疾患に対する細胞移植治療に応用することが期待されます。(Matsui et al. Stem Cells 2012)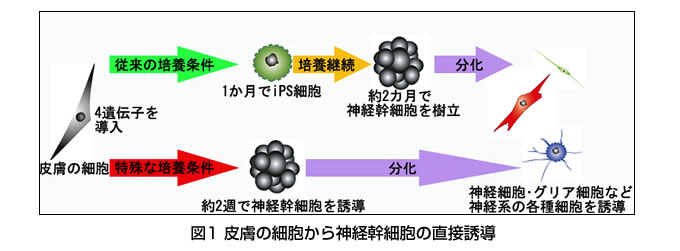
2) マウス脊髄損傷モデルに対する ヒト iPS 細胞由来神経幹細胞移植の有効性を確認
ヒト iPS 細胞から神経幹細胞を分化誘導し、これを免疫不全マウス脊髄損傷モデルに移植を行い、良好な運動機能の回復を得ることに成功しました。移植したヒト iPS 細胞由来神経幹細胞はマウス脊髄内で生着・分化し、マウス脊髄内ニューロンとシ ナプスを形成して神経伝導を改善させ、また脊髄損傷後の血管新生や神経線維の再生を促進することで、損傷脊髄の修復に働いていることが分かりました。また、移植後約 4ヶ月の長期経過観 察を行い、腫瘍化が認められないことも確認しています。(Nori et al. PNAS 2011)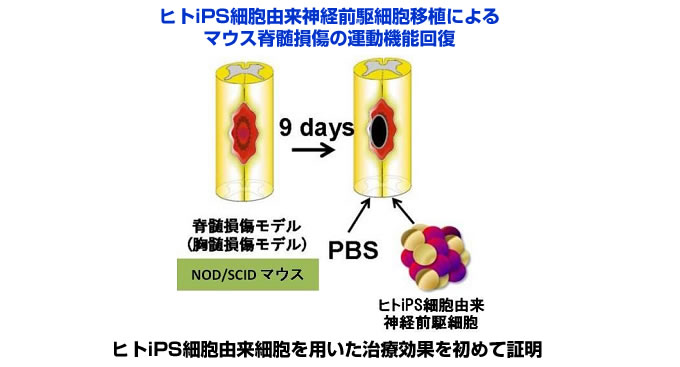
3) アルツハイマー病 iPS 細胞を樹立、その発症メカニズムを確認
アルツハイマー病患者の皮膚の細胞から、iPS 細胞を作製することに成功しました。さらにこの iPS 細胞から神経細胞を誘導し、アルツハイマー 病由来の細胞ではベーターアミロイドと呼ばれる毒性の高いたんぱく質が通常の約 2 倍産生されていることを確認しました。また、この細胞はベーターアミロイドの産生を抑制する薬剤に 鋭敏に反応することも示され、新規の治療薬の開発に利用できると期待されます。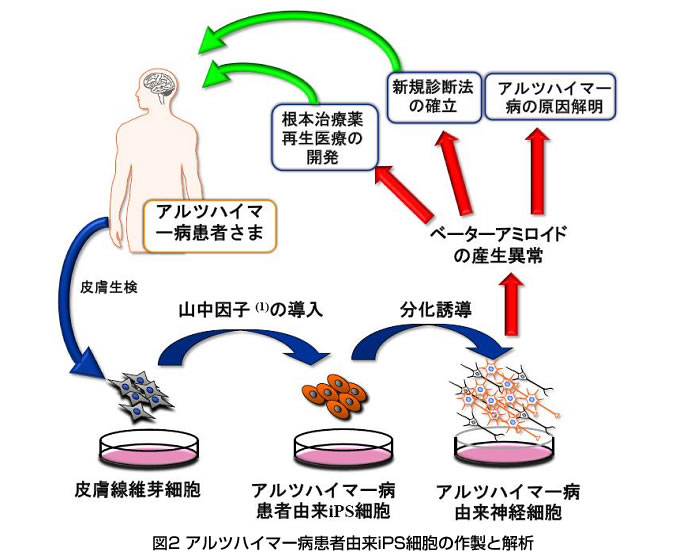
これまで、疾患 iPS 細胞樹立は、北米を中心としていくつかのグループで報告されています が、アルツハイマー病 iPS 細胞としては最初の学術論文です。今後、神経難病研究が新たな展 開を迎えることとなります。
今年度の展望・最終目標等
実験計画
| 1. | ゲノム挿入の起こらないエピゾーマルベクターあるいは、センダイウイルスベクターを使って樹立されたiPS細胞の細胞移植における有効性と安全性の評価 |
| 2. | ヒトiPS細胞由来神経前駆細胞の安全性・有効性の検討 |
| 3. | マーモセット脊髄損傷モデル作製と細胞移植 |
| 4. | ヒトiPS由来造血幹細胞を制御する技術基盤の開発 |
| 5. | ヒトiPS細胞を用いた心筋細胞の再生と臨床応用へ向けた基盤の開発(1)健常者および遺伝性心臓疾患からのiPS細胞の樹立 |
| 6. | 感覚器系(角膜・網膜)のヒト幹細胞技術開発および幹細胞治療の開発 |

