個別事業紹介
幹細胞治療開発領域
研究課題名
複数遺伝子搭載型新規麻疹ウィルスベクターを用いた安全かつ効率的なヒトiPS細胞樹立技術の開発
研究目的・概要
ヒトiPS(induced pluripotent stem cells)細胞の開発により線維芽細胞を始めとする自己細胞を用いた再生医療の実現が極めて現実的になってきてはいるものの、そのゴールとなる同細胞より安全かつ高効率に各種分化幹・前駆細胞を得る技術はまだ確立されていない。さらにヒトiPS細胞の作製においてはこれまでの報告において染色体DNAにランダムな遺伝子挿入がなされるレトロもしくはレンチウイルスベクターが広く用いられており、遺伝子挿入箇所に依存した重要遺伝子発現抑制による細胞機能不全や、癌関連遺伝子変異に由来する発癌性誘導等の危険性に関しては全く明らかになっていない。すなわちiPS細胞を元に各種分化幹・前駆細胞を作製する場合に、これらの重要な問題点を先ず解決することが急務であると考えられる。現在我々は、取り扱いが比較的容易で複数遺伝子搭載が可能な、染色体内遺伝子非組み込み型麻疹ウイルスベクターを用いてヒトiPS細胞を樹立する技術を開発中である。また既に報告されている染色体内遺伝子非組み込み型センダイウイルスベクターにより樹立されたヒトiPS細胞との発現プロファイルについて比較検討を行い、麻疹ウイルスベクターの有効性が示唆される結果を得た場合には、各拠点と連携しながら、本ウイルスベクターの本事業における広汎な応用の可能性を検討する。
実施体制
研究代表者
| 谷 憲三朗 | (九州大学 生体防御医学研究所 ゲノム病態学分野 教授) |


最新の研究成果・進捗状況
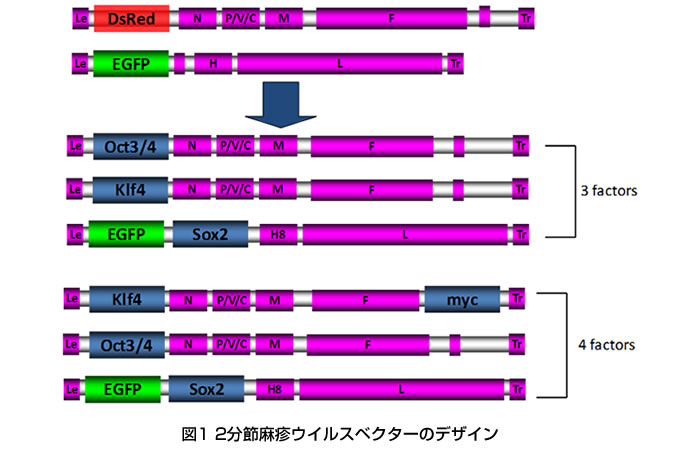
染色体非挿入型ウイルスである麻疹ウイルスゲノムを2分節化し、ヒトES細胞mRNAよりクローン化した外来遺伝子(Oct3/4, Sox2, Klf4, c-Myc, Nanog)を挿入した麻疹ウイルスベクターを作製した。これらの外来遺伝子を持つ麻疹ウイルスを増幅させ、3遺伝子(Oct3/4, Sox2, Klf4)、4遺伝子(Oct3/4, Sox2, Klf4, c-Myc)5遺伝子(Oct3/4, Sox2, Klf4, c-Myc, Nanog)を持つウイルスクローンを単離した。これらウイルスベクターの外来遺伝子発現能をRT-PCR法ならびにウエスタンブロット法にて確認後、麻疹ウイルスをPEG-it virus Precipitation SolutionTMにて濃縮し、濃縮ウイルスをヒト線維芽細胞等初代培養細胞、ヒト臍帯静脈内皮細胞に感染させ4遺伝子の免疫染色を行い、各々の外来遺伝子発現確認を行った。麻疹ウイルスの濃縮により力価が約10倍程度上昇したが、濃縮前の麻疹ウイルスと同様にヒト初代培養細胞への細胞障害性は見られなかった。さらに、麻疹ウイルス野生型Hタンパク質のpoint mutation (N481Y, N390I, E492G, N416D, T446S 、参考文献1)を持つH8タンパク質遺伝子を本麻疹ウイルスゲノムに挿入し、野生型麻疹ウイルスが SLAMおよびCD46をレセプターとして使用する能力を本麻疹ウイルスベクターにも賦与できるように遺伝子改変を行った(図1)。

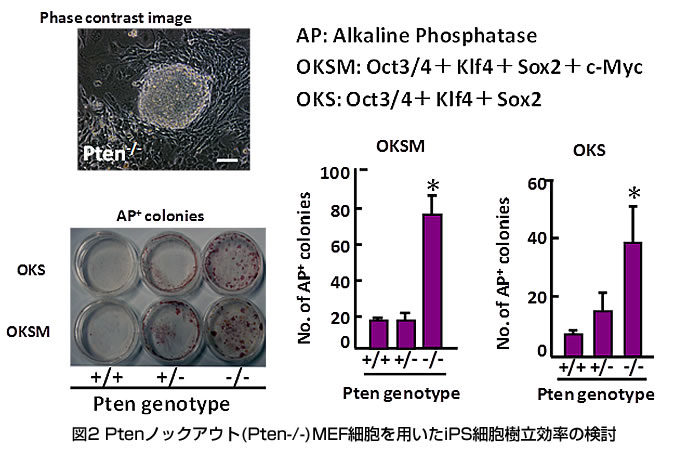
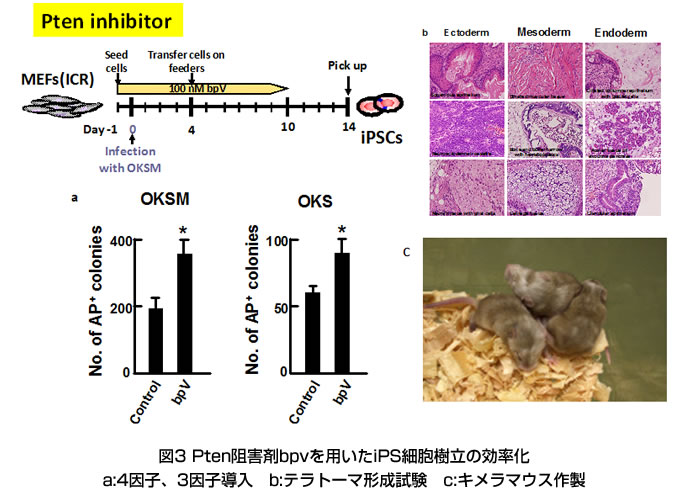
標的となるヒト初代培養細胞のCD46発現をフローサイトメトリーで確認し、既報の方法に従い麻疹ウイルスをヒト初代培養細胞に感染させ、現在ヒトiPS細胞樹立を試みている。昨年度得られたヒトiPS細胞様コロニーについて、感染性麻疹ウイルス残存の有無を確認するために、iPS細胞様培養上清と麻疹ウイルス感受性細胞(Vero/SLAM細胞)とを共培養し2週間程度観察したが、麻疹特有の細胞変性効果(巨細胞の出現)は認められなかった。また、細胞よりRNAを抽出し、RT-PCR法によりN遺伝子の増幅の有無を検討したが、N遺伝子の増幅は見られなかった。しかしながらこれらのコロニーは長期間継代培養ができないことから、現在も継続して新たなiPS細胞の樹立を試みている。さらに、Type I interferon receptor 欠損(IFRA-/-) SLAM knock in mouse (参考文献2)より作製したMEF細胞に、麻疹ウイルス受容体であるSLAMをレンチウイルスベクターにて導入し(MEF/hSLAM細胞)、マウス細胞を用いても本麻疹ウイルスベクターの遺伝子導入機能を検討できるシステムを構築した。MEF/hSLAM細胞に本麻疹ウイルスベクターを濃縮、感染し、マウスiPS細胞の樹立も並行して試みている。また、麻疹ウイルスベクターによるiPS細胞の樹立効率を高めるために、我々はPI-3-kinaseの抑制因子であるPtenタンパク質に着目し、Pten遺伝子ノックアウトマウスから樹立されたMEF細胞(Pten-/- MEF)ならびにPten阻害剤(bpV(HOpic)を用いて先ずはレトロウイルスによるiPS細胞の樹立効率を比較検討した。その結果、Pten-/- MEFを用いた場合(図2)、またPten阻害剤である bpV(HOpic) を一過性に12日間処理した場合(図3)も同様に、コントロールと比較してiPS 細胞樹立効率が上昇するという結果が得られた。Pten阻害により得られたiPS細胞は、in vivoでの多分化能を示すとともに、キメラマウスを作製することができ(図3)、その際の造腫瘍性は高まってはいないことが明らかになり、本方法の安全性を確認することができた(参考文献3)。


参考文献
1) Tahara M, Yanagi Y et al. J. virol. , 20082) Ohno S, Yanagi Y et al. J. Virol. , 2007
3) Liao J,Marumoto T,Miura Y, Tani K et al. Inhibition of PTEN tumor suppressor promotes the generation of induced pluripotent stem cells (submitted)
今年度の展望・最終目標等
現在われわれが開発中である、取り扱いが比較的容易で複数遺伝子搭載が可能な、染色体内遺伝子非組み込み型麻疹ウイルスベクターを用いてヒトiPS細胞の樹立法の至適化、確立を行う。現在使用中の第二世代2分節型新規麻疹ウイルスベクターを用いて樹立に成功した場合、①ヒトiPS細胞の発現プロファイル解析を行うとともに、既に報告されている染色体内遺伝子非組み込み型センダイウイルスベクターにより樹立されたヒトiPS細胞との発現プロファイルについて比較検討する。②樹立したiPS細胞の安全性検討を行う。具体的には、樹立したiPS細胞の感染性麻疹ウイルス残存の有無を確認するために、樹立iPS細胞培養上清と麻疹ウイルス感受性細胞(Vero/SLAM細胞)とを共培養し、N遺伝子をターゲットとしてRT-PCR法を行う。また樹立したiPS細胞の安全性を検討するために、免疫不全マウスを用いたin vivoアッセイにより造腫瘍性の有無を長期的に観察する。さらに臨床応用に向けて安全性をより向上するために、第三世代麻疹ウイルスベクターとしてF遺伝子欠損型麻疹ウイルスベクターを作製していく。センダイウイルスベクターにより樹立されたヒトiPS細胞が内在する問題点の解決を念頭に、麻疹ウイルスベクターの優位性について、必要に応じて外部有識者を招聘し意見を聞くなど検討し、PD、POならびに各拠点と連携しながら、本ウイルスベクターの本事業における広汎な応用の可能性を検討する。

