トピックス
大脳皮質微小回路構造を可視化するための遺伝学的技術を確立
戦略研究推進部 さきがけ
https://www.jst.go.jp/kisoken/presto/
大脳皮質はヒトを含む哺乳類の感覚情報処理、学習、記憶といった脳高次機能を担っています。大脳皮質内に存在する興奮性神経細胞と抑制性神経細胞は、複数の、異なる結合様式を持つ精緻な神経回路を形成し、この神経回路こそが多様な大脳皮質機能の構造的基盤となっています。よって、大脳皮質神経回路の配線図を明らかにすることは、神経科学における1つの大きな課題となっています。
近年の研究から、興奮性神経細胞、抑制性神経細胞にはともに形態、電気生理学的特性が異なる非常に多くのサブタイプが存在することがわかってきました。それぞれのサブタイプは、特有の組み合わせ、結合様式で大脳皮質神経回路の基本単位である微小回路を形成することが示唆されてきました。しかしながら、大脳皮質微小回路の解剖学的詳細を体系的に解析するのは技術的制約から大変困難でした。
今回、マックスプランクフロリダ神経科学研究所の谷口弘樹リサーチグループリーダーを中心とするチームは、特定の興奮性神経細胞に入力を送る抑制性神経細胞をサブタイプごとに標識する信頼性の高い遺伝学的技術を確立し、異なる興奮性神経細胞サブタイプは異なる様式で抑制入力を受けることを示しました。
この成果は、2019年1月28日、英国科学雑誌「Nature Neuroscience」電子版で発表されました。(DOI:10.1038/s41593-018-0322-y)
狂犬病ウイルスは、神経結合のつなぎ目を介し、逆行性に運ばれる性質があるので、ある神経細胞に接続する入力を全て標識するのに利用されてきました。チームは、狂犬病ウイルスにFLPと呼ばれる組み換え酵素を入れ、ある抑制性神経細胞サブタイプのみが別種の組み換え酵素CREを持つ遺伝子改変マウスと組み合わせることにより、特定の興奮性細胞に入力を送る特定の抑制性神経細胞サブタイプのみでFLPとCREが共存する状態を作り出しました。さらに、FLP/CRE共存下でのみ蛍光タンパクを産出するリポーターマウスを利用することにより、入力抑制神経細胞をサブタイプ特異的に標識することに成功しました。
本遺伝学的標識法を用いることにより、今後、大脳皮質微小回路の配線図が体系的に明らかにされ、その発達原理も解明されることが期待されます。また、正常動物と精神疾患モデル動物を比較することにより、微小回路レベルでの変異が同定され、新たな病態、病因の解明につながることが期待されます。
- (図1)
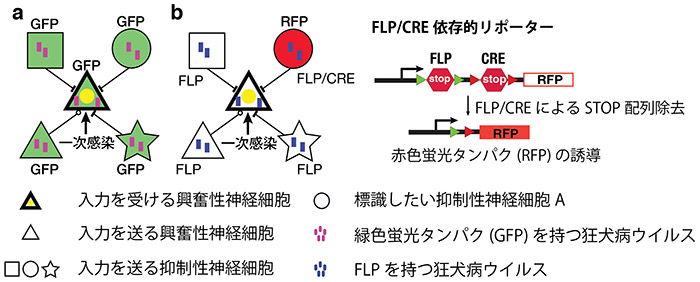
- a) 従来の狂犬病ウイルスによる逆行性入力標識法。ウイルス由来の蛍光タンパクにより全ての入力が標識される。
- b) 今回、開発されたサブタイプ特異的入力標識法。ウイルス由来のFLPと遺伝子改変動物由来のCREが共存することにより、興奮性神経細胞に入力を送る抑制神経細胞Aのみで蛍光タンパクが誘導される。
- (図2)
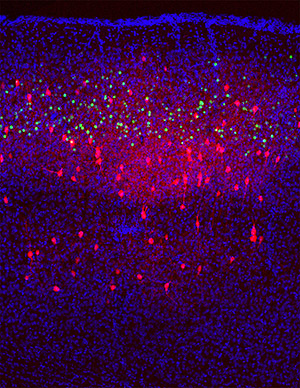
- 本遺伝学的標識法で可視化された、第二層興奮性錐体細胞(緑)に接続するパルブアルブミン陽性抑制性神経細胞(赤)。
