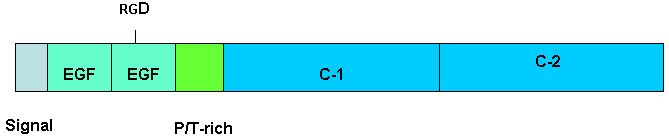
| 私達は、アポトーシス時に活性化されるDNase〔DNA分解酵素、CAD, caspase-activated DNase〕を見いだし、この酵素が死につつある細胞内で活性化され、DNAを崩壊させることを報告した。実際、CAD遺伝子を欠損したマウス(ノックアウトマウス)から調製した細胞を試験管の中(in vitro)で培養し、アポトーシスを起こさせると染色体DNAは分解されず、CADがアポトーシス時の染色体DNA崩壊を引き起こす酵素であることが確認された。ところが、生体内で (in vivo) でアポトーシスを起こしている細胞を観察すると、CAD遺伝子が欠損している細胞でもDNAの分解は正常に起こっていた。しかもその細胞はマクロファージと呼ばれる白血球の中に存在した。このことは、アポトーシスを起こした細胞はマクロファージによって速やかにとりこまれ(貪食)、マクロファージがアポトーシス細胞のDNAを分解する可能性を指摘する。 今回、このことを用いてアポトーシス細胞のマクロファージによる貪食を定量化した。すなわち、CAD遺伝子を欠損したマウスの胸腺にアポトーシスを誘導した後、この細胞をマクロファージと培養し、マクロファージン内でのアポトーシス細胞のDNA切断を測定した。ついで、マウスマクロファージをハムスターに注射し、この細胞を抗原としてマクロファージ表面たんぱく質に対するモノクローナル抗体を作成した。その一つのモノクローナル抗体は、マクロファージによるアポトーシス細胞の貪食に影響を与えた。そこで、この抗体によって認識されるたんぱく質を精製し、そのアミノ酸配列を決定したところMFG-E8であった。MFG-E8は、N-末端からシグナル配列、2個のEGF(epidermal growth factor, 上皮細胞成長因子)に相似した領域、2個の血液凝固因子8(Factor VIII)に相似した領域(C-1 and C-2)からなっている。特に2番目のEGF領域には細胞と細胞の接着に関与しているインテグリンとの結合に必要な3個のアミノ酸 (RGD, Arg-Gly-Asp) が存在する。 MFG-E8はこのたんぱく質のC-末端領域に存在するC-1, C-2 領域を介して、アポトーシスに提示されるホスファチジルセリンに結合した。そして、ホスファチジルセリンと結合したMFG-E8はN-末端側のEGF 領域を介してマクロファージなどのインテグリン発現細胞に結合した。 2番目のEGF領域に存在するRGDモチーフのAsp残基をGlu残基に置換したMFG-E8はアポトーシス細胞に結合したがマクロファージには結合せず、in vitro, in vivo でのマクロファージによるアポトーシス細胞の貪食を抑制した。以上の結果はアポトーシス細胞で提示される"eat me"シグナルの一つはホスファチジルセリンであること、MFG-E8が生体内でアポトーシス細胞の貪食過程に関与していることを示している。 |
|
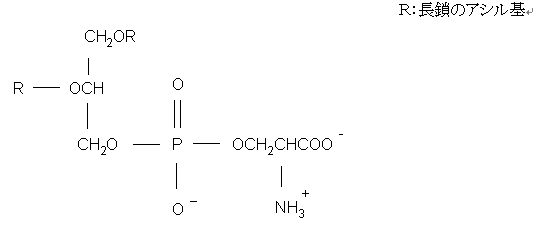
| (1)ホスファチジルセリン セリン残基を持つグリセロリン脂質
|
|
 >
>