ポイント
- たんぱく質に翻訳されないRNA(非コードRNA)の新たな作用を発見
- 非コードRNAにより、急性白血病の原因である細胞の分化異常を回復させることに成功
- 細胞の分化異常が発症の引き金となる白血病の新しい治療法として期待
JST 課題達成型基礎研究の一環として、東海大学 医学部の幸谷 愛(コウタニ アイ) 准教授は、奥山 一生 研究員とともに、急性白血病細胞の分化異常を修復するRNAを発見し、白血病細胞を正常化させる可能性を示しました。
白血病は、未熟な白血球が異常増殖してしまう「血液のがん」です。発症が急激な急性白血病では、遺伝子の働きを調節している転写因子注1)と呼ばれるたんぱく質の異常により未熟な細胞を生じてしまうことが、白血病の発症の引き金になると考えられています。
一方、最近の研究で、たんぱく質に翻訳されない非コードRNA注2)が、生物学的に重要な機能を持つことが分かってきています。細胞の分化にも働くことが報告されていますが、あくまで転写因子を補佐する働きにとどまると考えられてきました。
今回、白血病の中でも非常に予後不良であるMLL-AF4(MLL遺伝子再構成陽性)急性白血病細胞注3)で、発現が低下している特定の非コードRNA「miR-126」に着目し、白血病細胞に導入したところ、MLL-AF4白血病細胞を血液細胞の一種であるB細胞へ分化誘導することを見いだしました。これまで、B細胞への分化には転写因子が必須と考えられてきましたが、転写因子がなくてもmiR-126だけで分化が誘導されました。
今回の結果は、転写因子が中心となって細胞分化が誘導されるとした考え方に、新たに非コードRNAの重要性を加えるとともに、転写因子の異常が発症の引き金となる白血病において、非コードRNAを用いた新たな治療法開発に結びつく可能性を示しました。
本研究成果は、東海大学 教育研究支援センター、理化学研究所 統合生命医科学研究センター 伊川 友括 YCIラボリーダー(兼 さきがけ研究者)をはじめとする複数機関との共同研究で得られ、研究成果は2013年7月22日の週(米国東部時間)に米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「がん細胞由来小分子RNAによる炎症細胞の制御」 |
| 研究者 |
幸谷 愛(東海大学 医学部 基盤診療学系 再生医療科学 造血腫瘍分野 准教授) |
| 研究実施場所 |
同上 |
| 研究期間 |
平成24年10月~平成27年3月 |
JSTはこの領域で、炎症の慢性化機構という現象の実体解明に向けた研究を行い、それに基づき、がん・動脈硬化性疾患・アレルギー・自己免疫疾患などの炎症の慢性化が関与するさまざまな疾患の予防や治療、創薬につながる新たな医療基盤の創出を目指しています。上記研究課題では、がんの発生やがん組織の維持に関する炎症反応の役割について、新しい細胞間コミュニケーターである「分泌性小分子RNA」の作用を中心に解明を試みています。
<研究の背景と経緯>
白血病は、未熟な白血球が異常増殖してしまう「血液のがん」です。発症の仕方によって急性白血病と慢性白血病があります。急性白血病の原因は、遺伝子の異常により、細胞増殖に関わる遺伝子群と、細胞の分化に関わる遺伝子群の両方の制御ができなくなることで発症すると考えられています。白血病は国内でも年間約8,700人が罹患しています。(地域がん登録全国推計によるがん罹患データ1997年~2002年)
一般に、細胞の分化には転写因子と呼ばれるたんぱく質が重要な働きをすると考えられており、血液細胞の分化においても、さまざまな転写因子が同定されています。急性白血病では、転写因子の異常による分化障害が発症の引き金となるため、その異常を修復し、正常化することにより白血病細胞を脱がん化させる可能性があります。
一方、ゲノムプロジェクト注4)によってたんぱく質に翻訳される遺伝子のみでは、ヒトの多様性を説明することができないことが分かってきました。それを説明するための1つの鍵と注目されているものに非コードRNAがあります。非コードRNAは、従来の遺伝子配列とは見なされない、たんぱく質に翻訳されないDNA配列から転写されます。種によってたんぱく質に翻訳される遺伝子領域の数には、大きな差がないことがゲノムプロジェクトによって明らかになり、これまで「ゲノムのごみ」と考えられてきたDNA配列から転写される非コードRNAの多様性に、ヒトらしさを見いだす研究が盛んに行われています。非コードRNAの1つであるmiRNA(マイクロRNA)は、これまで生物学的に重要な機能を持つことが多数報告されてきました。
B細胞は血液細胞の一種で、急性白血病の中にはB細胞の分化障害が原因で発症するものが多く含まれます。造血前駆細胞注5)からB細胞へ分化する際には、EBF1と呼ばれる転写因子が必要と考えられています。また、細胞の分化の過程においても、miRNAの関与は報告されていますが、あくまで、転写因子を補佐する働きにとどまると考えられてきました。
<研究の内容>
miRNAの一種であるmiR-126は、MLL-AF4(MLL遺伝子再構成陽性)急性白血病細胞で発現が低下していることが知られていました。そこで、最初に白血病細胞にmiR-126を導入し、B細胞のマーカーたんぱく質の発現を調べたところ、その白血病細胞がB細胞に分化することが分かりました(図1)。また、miR-126の導入によって、正常な造血細胞もB細胞へ分化誘導されました(図2)。
次に、miR-126が白血病細胞の分化を誘導するメカニズムを調べたところ、miR-126を導入してB細胞に分化する際に、B細胞の分化に必須とされる転写因子EBF1の発現が全く変わらないことが分かりました。これは、miR-126が、従来知られていなかった、転写因子EBF1を介さないメカニズムによってB細胞分化を誘導している可能性を示唆しています。そこで、EBF1が欠損している造血細胞に、miR-126を導入し、B細胞分化に重要な細胞外因子(Kitl、Flt3l、Il7)を含む培地で培養しました。すると、この転写因子欠損造血前駆細胞は、そのままでは全くB細胞に分化できませんが、miR-126によってB細胞関連遺伝子やB細胞マーカーの発現が上昇しました(図3)。この結果は、転写因子とは無関係に、miRNAによってB細胞分化障害が正常化され、B細胞方向への分化誘導が起こり得ること示します(図4)。
<今後の展開>
白血病細胞をB細胞へと分化誘導する非コードRNAを同定しました。従来の転写因子を中心とした細胞運命注6)決定についての考え方に、新たに非コードRNAの重要性を加えられる可能性があります。さらに、白血病においては転写因子の異常による分化障害が発症の引き金となるため、非コードRNAによりその異常を修復し、正常化することは白血病細胞を脱がん化させる可能性があります。
非コードRNAの一種、miRNAは哺乳類では2000年に発見されたばかりの新しい研究分野であり、まだ治療応用で臨床試験が進行しているものはわずかです。しかし、従来の遺伝子と異なり複数の遺伝子を制御する点がユニークであること、生物製剤であるため、比較的毒性が低いことなど、新しい治療標的として魅力的な分野と考えられます。本研究の成果は非コードRNAを用いた新しい治療法の開発の糸口になる可能性があると期待されます(図5)。
<参考図>
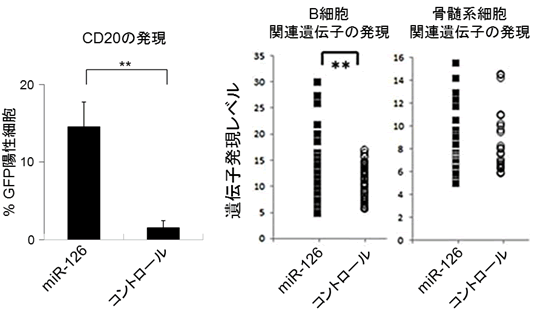
図1 miR-126は白血病細胞をB細胞に分化誘導する
白血病細胞(MLL-AF4急性白血病細胞株 Sem細胞)に、miR-126を導入して8週培養後、B細胞マーカーであるCD20のたんぱく発現や、B細胞関連遺伝子の発現が上昇する。これに対し、骨髄系細胞関連遺伝子の発現は変化しない。**は統計的に差が有意であることを示している。

図2 miR-126は正常造血前駆細胞もB細胞に分化誘導する
正常マウスの造血前駆細胞にmiR-126とコントロールを導入し、同一系統マウスに移植した場合、miR-126導入細胞移植マウスにおいてB細胞が増加し、T細胞、骨髄系細胞は減少する。**は統計的に差が有意であることを示している。
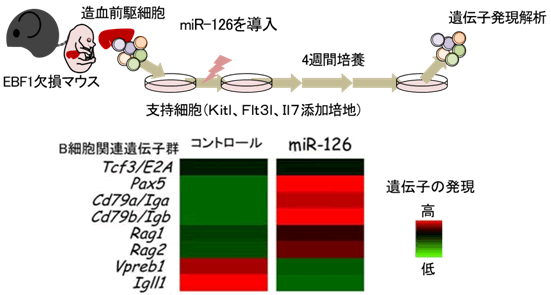
図3 miR-126はEBF欠損造血前駆細胞にB細胞遺伝子群の発現上昇を誘導する
B細胞分化に必要な転写因子であるEBF1を欠損するマウスより作成した造血前駆細胞にmiR-126を導入し、支持細胞の上で、B細胞分化に重要な細胞外因子(Kitl、Flt3l、Il7)を含む培地で培養した時、B細胞分化に関連する遺伝子のうち、Pax5、Cd79a、Cd79b、Rag1、Rag2の発現が上昇した(赤は遺伝子発現量が高く、緑は低い)。この結果から、miR-126は転写因子とは無関係に、造血前駆細胞をB細胞に分化させることが分かった。
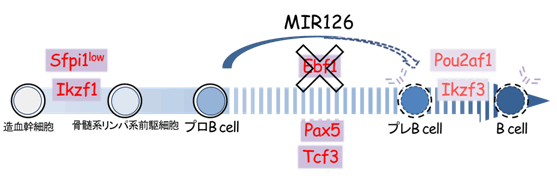
図4 miRNAはB細胞分化の“迂回路”になり得る
B細胞などの白血球は、造血幹細胞から、図のような段階を経て分化する。それぞれの段階で特定の転写因子(赤字)が働くことによってさまざまな遺伝子が誘導され分化が進行する。本研究では、B細胞が成熟する過程のうち、プロB細胞からプレB細胞に分化する段階に必須とされる、Ebf1という転写因子を欠損した細胞を用いて、転写因子とは独立したmiRNA(miR-126)の細胞分化誘導能を検討した。その結果、miR-126が転写因子Ebf1の欠損を補い得ることを見いだした。
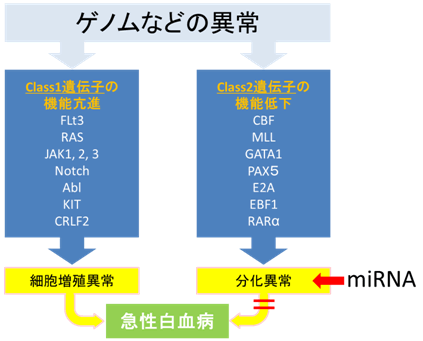
図5 本研究の意義
急性白血病は、細胞増殖に関わるClass1遺伝子群のいずれかと、細胞分化に関わるClass2遺伝子群のどれかが、同時に異常となることによって、はじめて発症すると考えられている。Class1遺伝子の異常では細胞増殖が進み、Class2遺伝子の異常では分化が障害されることが多い。本研究では、Class2遺伝子の1つであるEBF1の異常による分化障害をmiRNAで回復させることを証明した。よって、miRNAを用いて分化障害を回復させることにより、白血病細胞を治療できる可能性がある。
<用語解説>
- 注1) 転写因子
- たんぱく質合成は、DNA上の遺伝子を鋳型としてメッセンジャーRNAが転写され、このメッセンジャーRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わるたんぱく質因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
- 注2) 非コードRNA
- ゲノムのたんぱく質をコードしない領域から転写されるRNA。
- 注3) MLL-AF4(MLL遺伝子再構成陽性)急性白血病細胞
- 乳幼児期に発症することが多い急性白血病で、未熟な造血前駆細胞段階で分化が障害されていると考えられている。極めて予後が不良である。
- 注4) ゲノムプロジェクト
- 2003年に完了宣言された最初のヒトゲノムプロジェクトは、ヒトにおけるの全DNA配列(ゲノム)から、たんぱく質に翻訳される全ての遺伝子を同定しようという試みで、当初100,000個程度と予想されていた遺伝子が、実際には約24,000個でしかなく、その翻訳されるDNA配列はゲノム全体の2%以下であることが判明した。そのため、たんぱく質に翻訳されるDNA配列だけからヒトの多様性を説明できず、その説明を求めて、DNA配列から転写されるがたんぱく質には翻訳されない種々のRNAとその機能に、世界中で精力的な研究が行われている。
- 注5) 造血前駆細胞
- 造血幹細胞から分化し、赤血球・白血球・血小板などに分化する途中の段階にある細胞。
- 注6) 細胞運命
- 一つ一つの細胞がそのもととなる幹細胞から生み出され、組織や臓器になる(分化する)過程で、“どのような細胞になるのか”が決定されること。
<論文タイトル>
“miR-126-mediated control of cell fate in B cell-myeloid progenitors as a potential alternative to transcriptional factors”
(miR-126はB-骨髄系細胞の細胞運命制御に働き、B細胞分化において転写因子の欠損を補う“迂回路”になり得る)
doi: 10.1073/pnas.1220710110
<お問い合わせ先>
<研究に関すること>
幸谷 愛(コウタニ アイ)
東海大学 医学部 基盤診療学系 再生医療科学 造血腫瘍分野 准教授
〒259-1193 神奈川県伊勢原市下糟屋143
Tel:0463-93-1121/2781 Fax:0463-91-7902
E-mail:
研究室URL:http://kotani.med.u-tokai.ac.jp/
<JSTの事業に関すること>
木村 文治(キムラ フミハル)、川口 貴史(カワグチ タカフミ)、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail: