| ■ 研究領域「アクチンフィラメント動態」の概要 |
アクチンフィラメントはたんぱく質から形成される細胞内"装置"の中でも最も重要なもののひとつである。その機能は、細胞内オルガネラやたんぱく質複合体の配置と移動、さらには細胞の変形と運動など多岐にわたる。その構造は、一種類のたんぱく質分子(アクチン単量体)が2本のらせん状に配列した単純なものである。そのため、この構造は"柔軟"で、多くの様式の運動(構造変化)を担う可能性を持っている。他方、アクチンフィラメントには多くのたんぱく質が結合し、それぞれはアクチンフィラメントが特定の機能を発揮する時に使われている。本研究者はこれまでの研究から、アクチンフィラメントの個々の機能には特定の運動様式が対応しており、多数の運動様式の中から特定の運動様式を選択するのがアクチン結合たんぱく質の役割であり、その結果、特定のアクチン結合たんぱく質が特定の機能の発現を助けていると考えている。
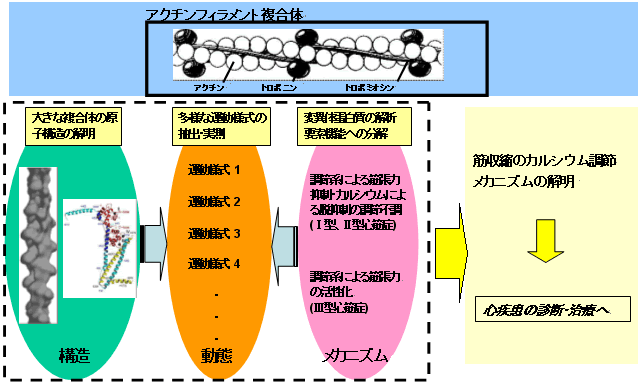
本研究領域では、アクチンフィラメントが発現する機能の中でも「筋収縮のカルシウム調節」をとりあげ、そのメカニズムの解明を目標とする。そして"装置"の機能解明はその原子構造に基づいて初めて可能であるとの立場で研究を進める。筋収縮のカルシウム調節はトロポニンとトロポミオシンが結合したアクチンフィラメント複合体が担う。最近本研究者はトロポニンの結晶構造を解明し、またアクチン重合体の原子模型を得た。これら部分的な複合体の原子構造は重要であるが、それだけではメカニズムの解明に迫ることはできない。本研究領域では、一方でアクチンフィラメント複合体全体の原子構造を得ることをめざす。他方、筋収縮のカルシウム調節はアクチンフィラメントの多様な運動様式の1つに対応するとの考えに基づき、その運動様式を原子構造から予測し、実測すること、運動様式に異常のある変異たんぱく質を用いて運動様式と機能の連関を解明することを目指す。
本研究領域は、たんぱく質"装置"の原子構造の知見をもとにメカニズムの理解にいかに進むか、との世界的にも未解決の問題への挑戦である。我が国には「カルシウムイオンによる信号伝達の発見」と「凝集現象としてのアクチン重合過程の再発見」という独自の優れた研究がある。本研究領域ではこの蓄積を踏まえ、さらにたんぱく質解析に係る多くの生物学的、物理的および理論的手法をあらたに開発、改良し、それらを駆使して研究を進めるものであり、戦略目標「遺伝子情報に基づくたんぱく質解析を通した技術革新」に資することが期待される。 |
 |
| ■ 研究総括 前田雄一郎氏の略歴等 |
| 1. |
氏名(現職) 前田 雄一郎(まえだ ゆういちろう)
(理化学研究所 播磨研究所 主任研究員) 55歳 |
|
| 2. |
略歴
| 1972年3月 | 東京大学理学部物理学科卒業 |
| 1974年3月 | 名古屋大学理学系大学院分子生物学専攻博士前期課程修了 |
| 1977年3月 | 名古屋大学理学系大学院分子生物学専攻博士後期課程修了 |
| 1978年6月 | 理学博士(名古屋大学、指導教官:大澤文夫) |
| 1979年7月 | マックスプランク医科学研究所(ハイデルベルグ)
K.C.Holmes研究室博士研究員 |
| 1984年11月 |
欧州分子生物学研究所(EMBL)スタッフ研究員/グループリーダー |
| 1993年2月 | 松下電器産業中央研究所国際研究所グループリーダー/所長 |
| 1998年4月 | 理化学研究所播磨研究所主任研究員 |
この間
| 1976年4月-1979年3月 |
日本学術振興会博士課程研究員及び博士研究員 |
| 1979年7月-1982年10月 |
マックスプランク財団博士研究員 |
| 1982年11月-1983年10月 |
欧州分子生物学研究機構(EMBO)博士研究員 |
| 1983年11月-1984年10月 |
欧州分子生物学研究所(EMBL)博士研究員 |
| 1986年7月-1989年6月 |
米国筋ジストロフィー財団基礎研究資金受託者 |
| 1999年10月- |
科学技術研究振興調整費総合研究代表者 |
|
| 3. |
研究分野
生物物理学、構造生物学、分子生理学
|
| 4. |
主な学会活動等
| 1995年 |
英国BBSRC(生物学研究審議会)構造生物学研究体制審議会委員 |
| 1995-2000年 |
日本学術会議第4部会構造生物学の将来計画に関する検討小委員会委員 |
| 2001年11月 |
International workshop, "Actin filament, from structure to mechanism", Harima SPring-8, 主催者 |
| 2002年6月 |
Gordon Research Conference, Contractile Proteins, co-chairperson |
|
| 5. |
業績等
筋収縮の研究ではモーター蛋白質であるミオシンに注目するのが普通であるが、その相手であるアクチンフィラメント複合体とそれが担う調節に注目し、ほぼ未着手であったアクチンフィラメント複合体の構造解析を集中的に研究し、初期にはアクチンフィラメント上でのトロポニンの配置の正確な決定 (1979, Nature)、弛緩状態の骨格筋中でのミオシン頭部の位置と形態の解明(1983, Nature)などの成果を得た。1984年から9年間にわたって欧州分子生物学研究所で研究室を主宰しながら、欧州共同利用の小角X線回折用ビームラインの設計と運用を担当し、X線回折を使って分子の構造変化をリアルタイムで追跡する筋生理学の確立を目指した。本研究はHolmes研、Huxley研ら欧州の多数の研究室との共同研究を行い、この期間にX線回折を用いての収縮中のアクチンの構造変化の解析(1986, Biophys.J.)、収縮中のトロポニンの構造変化の発見(1992, Biophys.J.)、収縮中にミオシン頭部が発生する横方向(筋の長さ方向と直角方向)の力の発見(1990, Science)、などの成果を得た。さらに、分子レベルの構造解明のために、生きた筋からのX線回折以外にも着手した。1990年よりアクチンフィラメントを構成する蛋白質分子のX線結晶解析を開始し、全ての蛋白質の大量発現系の確立に着手し、平滑筋ミオシンHMMの発現系の確立 (1995, PNAS)、トロポニンCとトロポニンIの断片の結晶構造の解明(1998, PNAS)、さらにアクチン・キャッピング蛋白質であるトロポモジュリン(C端半分) (2002, Biophys.J) とCapZの結晶構造を決定し (2003, EMBO J)、それぞれのキャッピングのメカニズムを提案した。近年、トロポニン・コアドメインの結晶構造を決定 (2003, Nature) して、カルシウム結合によるトロポニン分子内の構造変化を確立した。
|
|
|