ポイント
- サーチュインはヒストンを介した遺伝子発現メカニズムに関与する酵素であり、その異常はがんや老化につながる。
- サーチュインの標的たんぱく質であるヒストン上の作用部位を新規に発見し、遺伝子発現メカニズムの一端を解明した。
- がんや加齢関連疾患に対する新たな創薬への応用が期待される。
JST 戦略的創造研究推進事業において、東京大学 大学院薬学系研究科の金井 求 教授、川島 茂裕 特任講師、田辺 佳奈 特任研究員らの研究グループは、遺伝子発現注1)に関与する酵素であるサーチュインの標的たんぱく質におけるヒストン上の作用部位注2)を新規に発見しました。
サーチュインは、染色体を構成するたんぱく質であるヒストンの化学修飾注3)を取り除く酵素で、その異常はがんなどの疾患や老化を引き起こすことが知られています。しかしサーチュインが標的とする化学修飾の種類やヒストン上の作用部位について、その詳細な理解は進んでいませんでした。
本研究グループにおいて独自開発した人工化学触媒システムは、ヒストンとDNAの複合体であるヌクレオソーム(ヒストンとDNAの複合体)にさまざまな化学修飾を導入し、ヒストンを介した遺伝子発現メカニズムの検証や解明に利用することができます。そこで早稲田大学の胡桃坂 仁志 教授より試料提供を受けたヌクレオソームにさまざまな化学修飾を導入した上で、ヒトのサーチュインを作用させました。高速液体クロマトグラフィータンデム型質量分析計(LC-MS/MS)注4)を用いた解析により、その作用部位を網羅的に探索した結果、サーチュインの標的となるヒストンの作用部位を新規に発見しました。
本研究成果はサーチュインによる遺伝子発現の新たな制御メカニズムの存在を示唆し、サーチュイン機能の異常が原因と考えられる疾患に対する新たな治療薬の開発に応用できると期待されます。
本研究成果は、2018年2月8日(英国時間)に「Scientific Reports」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
「金井触媒分子生命プロジェクト」 |
| 研究総括 |
金井 求(東京大学 大学院薬学系研究科 教授) |
| 研究期間 |
平成23年8月~平成29年3月 |
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
<研究の背景と経緯>
1つの受精卵からヒトの身体を構成する機能の異なる多種多様な細胞が作り出されるためには、精巧かつ多彩な遺伝子発現の制御メカニズムが必要となります。染色体を構成する主なたんぱく質であるヒストンは、さまざまな化学修飾を受けることにより、クロマチン構造の変化などを経て、多彩な遺伝子発現パターンを生み出します。中でもアセチル化注5)は最も古くから知られているヒストン修飾の1つで、ヒストンアセチル化酵素(HAT)とヒストン脱アセチル化酵素(HDAC)と呼ばれる2つの拮抗した酵素により精密に制御されています。
サーチュインはヒストン脱アセチル化酵素の一種で、その異常はがんや加齢関連疾患などさまざまな疾患を引き起こすことが知られています。ヒトではSirt1からSirt7の7種類のサーチュインが存在し、それぞれ標的が異なります(図1)。各サーチュインについて、それぞれヒストンに対してどのような形で化学修飾を取り除くかなど、具体的な働き方は明らかではありませんでした。そこで、本研究ではヒトのサーチュインが標的とするヒストン上の作用部位について網羅的に探索しました。
<研究の内容>
これまで本研究グループは、ヒストンにさまざまな化学修飾を導入する独自の人工化学触媒システムを開発してきました。その1つであるSynCAcシステムはヌクレオソームに直接結合し、ヒストンの末端に存在するテール領域に化学修飾を導入することが可能です。このシステムを利用してさまざまな化学修飾を導入したヌクレオソームに対し、ヒトのサーチュインを作用させた後のヒストンの化学修飾パターンについて、高速液体クロマトグラフィータンデム型質量分析計(LC-MS/MS)を用いて網羅的に解析しました(図2)。その結果、ヒトのサーチュイン(Sirt1~7)について、それぞれが標的とする化学修飾の種類、およびヒストン上の作用部位についての網羅的知見を得ることに成功しました。特に、がん化との関連がよく知られているSirt7は自身のカルボキシ末端に存在する塩基性アミノ酸に富んだ領域を介してヌクレオソームに直接結合し、ヒストンに作用することを見いだしました。ヒストン上の作用部位は先行研究の報告とは異なるもので、しかも数倍も活性が高いことが明らかとなりました(図3)。
<今後の展開>
本研究成果はサーチュイン機能の全体像に迫ることから、ヒストン修飾を介した精巧な遺伝子発現制御メカニズムの解明につながると期待されます。さらに、今回明らかになった知見を元にサーチュイン機能とがんや老化との関連を詳細に追究することにより、がんや加齢関連疾患に対する新たな治療法の開発への応用が期待されます。
ヒストンアセチル化の減少は、がんをはじめとしたさまざまな疾患に関与することが示唆されています。そのため、ヒストン脱アセチル化酵素を阻害する低分子化合物は創薬の候補として注目されており、既に抗がん薬として使用されているものもあります。本研究の成果は、各サーチュインを選択的に阻害する低分子化合物の開発にも有用と考えられ、将来の創薬に貢献することが期待されます。
<参考図>
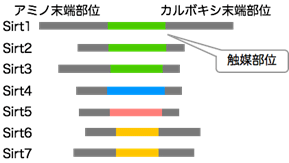
図1 今回解析したヒトが持つ7種類のサーチュイン
サーチュインはヒストン脱アセチル化酵素(HDAC)ファミリーの1つであり、ヒトが持つ7種類のサーチュインSirt1~7は中央領域に触媒部位を持つ。中でもアミノ酸配列が似ているものは同じ色で示している。
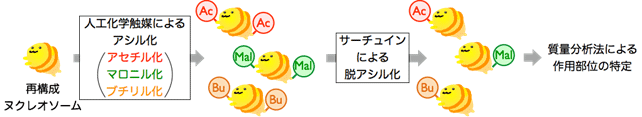
図2 サーチュインのヒストンにおける作用部位の同定法
人工化学触媒システムを用いて、さまざまなアシル化注6)修飾(Ac:アセチル化、Mal:マロニル化注7)、Bu:ブチリル化注8))を導入したヌクレオソームを調製する。次に、修飾ヌクレオソームに対してサーチュインたんぱく質を作用させ、脱アシル化反応を行う。反応後のヌクレオソームをLC-MS/MSを用いて解析し、作用部位を特定した。
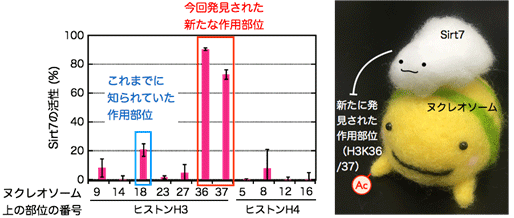
図3 今回の研究で発見されたSirt7の新たな作用部位
グラフはSirt7の作用部位の解析結果を示す。Sirt7はこれまでヒストンH3の18番目のリジン残基が作用部位として報告されていたが、本研究により、ヒストンH3の36番目および37番目のリジン残基(H3K36/37)が最も活性の高い新たな作用部位として同定された。Sirt7はヌクレオソームに直接結合することにより、H3K36/37に作用する。
<用語解説>
- 注1)遺伝子発現
- 遺伝情報であるDNAからたんぱく質や機能性RNAが合成されること。
- 注2)作用部位
- 基質となるたんぱく質の中で、酵素が化学修飾を付加または除去する標的となるアミノ酸部位のこと。一般的に酵素は各基質において特異的な作用部位を持つことが知られている。
- 注3)化学修飾
- たんぱく質などの生体高分子や高分子に含まれる特定の置換基を化学反応によって変化させること。
- 注4)高速液体クロマトグラフィータンデム型質量分析計(LC-MS/MS)
- 高速液体クロマトグラフ(HPLC)と質量分析計(MS)を結合させたもので、ペプチドや有機化合物の同定や定量を行う装置。
- 注5)アセチル化
- アセチル基-C(=O)-CH3を有機化合物(この場合はたんぱく質表面の置換基)に導入する反応のこと。
- 注6)アシル化
- アシル基-C(=O)-R(Rは任意の官能基)を有機化合物(この場合はたんぱく質表面の置換基)に導入する反応のこと。アセチル化、マロニル化、ブチリル化はいずれもアシル化に含まれる。
- 注7)マロニル化
- マロニル基-C(=O)-CH2-C(=O)-OHを有機化合物(この場合はたんぱく質表面の置換基)に導入する反応のこと。
- 注8)ブチリル化
- ブチリル基-C(=O)-CH2-CH2-CH3を有機化合物(この場合はたんぱく質表面の置換基)に導入する反応のこと。
<論文タイトル>
“LC–MS/MS-based quantitative study for acyl group- and site-selectivity of human sirtuins on acylated nucleosomes.”
(ヒトのサーチュインのアシル化ヌクレオソームに対するアシル基および残基選択性のLC-MS/MSを用いた定量解析)
著者:Kana Tanabe, Jiaan Liu, Daiki Kato, Hitoshi Kurumizaka, Kenzo Yamatsugu, Motomu Kanai and Shigehiro A. Kawashima.
doi:10.1038/s41598-018-21060-2
<お問い合わせ先>
<研究に関すること>
東京大学 大学院薬学系研究科 特任講師
川島 茂裕(カワシマ シゲヒロ)
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4775 Fax:03-5684-5206
E-mail:
<JST事業に関すること>
科学技術振興機構 研究プロジェクト推進部
大山 健志(オオヤマ タケシ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: