ポイント
- アルツハイマー病の発症にはアミロイドβペプチド(Aβ)の凝集(塊)が神経細胞を傷つけることが関与しているとされ、凝集を抑える治療法の開発が盛んに進められている。
- Aβ凝集体に特有の構造のみを区別して酸素化し、凝集を抑える光触媒を開発した。
- 触媒反応を用いる新しいアルツハイマー病治療法の確立につながることが期待される。
JST 戦略的創造研究推進事業において、東京大学 大学院薬学系研究科 金井 求 教授、ERATO 金井触媒分子生命プロジェクト 相馬 洋平 グループリーダー(講師相当)、谷口 敦彦 特任研究員らの研究グループは、アルツハイマー病の発症に関与するとされるアミロイドβペプチド(Aβ)の凝集注1)体が持つアミロイド構造注2)のみを区別して酸素化注3)する光触媒注4)を開発し、Aβの凝集と細胞毒性を抑えることに成功しました。
アルツハイマー病の発症には、Aβ凝集体が神経細胞を傷つけることが関与していると考えられています。そのため、Aβの凝集を抑える治療法の開発が盛んに進められてきました。本研究グループは、触媒反応注5)を用いる新しいアルツハイマー病治療法の確立を目指しており、これまでにもAβを酸素化することで凝集を抑える光触媒の開発に成功しています。しかし、Aβだけでなく、生体内で重要な役割を果たしている他の生体分子注6)も同時に酸素化してしまうという問題点がありました。
他の生体分子を酸素化させないためには、Aβに結合したときのみ酸素化を起こす選択性の強い光触媒が必要であると考え、Aβ凝集体に特有なアミロイド構造のみを区別して酸素化する光触媒(低分子有機化合物)を開発しました。本触媒を用いてAβを酸素化すると、Aβ凝集体のさらなる凝集が抑えられます。また、本触媒にAβを認識するペプチドを結合させると、細胞存在下でもアミロイド構造を区別したAβの酸素化が進行し、Aβ凝集体による細胞毒性が軽減されることが明らかとなりました。
今後、本触媒を、エネルギーの小さい光でも酸素化を起こせるようにし、さらに生体に適合したものへと改良することで、触媒反応を用いた新しいアルツハイマー病治療法の確立につながるものと期待されます。
本研究成果は、2016年6月27日(英国時間)に英国科学誌「Nature Chemistry」のオンライン速報版で公開されます。
本成果は、以下の事業・プロジェクトによって得られました。
戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
「金井触媒分子生命プロジェクト」 |
| 研究総括 |
金井 求(東京大学 大学院薬学系研究科 教授) |
| 研究期間 |
平成23年8月~平成29年3月 |
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
<研究の背景と経緯>
アルツハイマー病は認知障害を主な症状とする難治性疾患です。超高齢社会である日本の患者数は、発症前の予備軍も含めると800万人を超えるといわれ、アルツハイマー病の克服は世界的にも極めて重要な課題です。これまでの研究から、アルツハイマー病患者の脳には、老人斑と呼ばれるたんぱく質の沈着が認められ、この主成分はアミロイドβ(Aβ)と呼ばれるペプチドであることが知られています。アルツハイマー病は、この老人斑が形成される際に生じるAβの凝集体が神経細胞を傷つけることで発症し、症状が進行すると考えられているため、Aβの凝集を抑える治療法の開発が盛んに進められています。
本研究グループは、触媒反応を用いた新しいアルツハイマー病治療法の確立を目指しており、これまでにもAβを酸素化することで凝集を抑える光触媒(ビタミン骨格とペプチドの複合体)の開発に成功しています(図1)。この光触媒に光を当てると、ビタミン骨格が結合しやすい酸素を持続的に発生し、Aβを認識するペプチドがAβの近くに導かれることで、Aβを酸素化する仕組みです。しかし、Aβだけではなく、生体内で重要な役割を果たしている他の生体分子も同時に酸素化してしまうという問題があります。そこで、本研究グループは、生体内で他の生体分子に作用しない光触媒の開発を進めてきました。
<研究の内容>
本研究グループは、光触媒が他の生体分子に作用しないためには、Aβに結合したときのみ酸素化を起こす光触媒が必要であると考えました。一般に、Aβ凝集体には、クロスβシート構造と呼ばれる、Aβをはじめとするアミロイドたんぱく質に特有な構造(アミロイド構造)を持っています。この点に着目し、アミロイド構造を区別して結合する化合物をもとに酸素化を起こす光触媒を独自で設計、合成することとしました。
アミロイド構造を区別する化合物として、チオフラビンがよく知られています。しかし、この化合物は、アミロイド構造に非常によく結合するものの、光触媒として酸素化を起こす機能はほとんどありません。酸素化を起こすためには、結合しやすい酸素を発生させる必要があります。結合しやすい酸素は、光を当てることで、励起注7)された光触媒中の電子が酸素に作用して生まれます。
そこで、電子が励起しやすくなるようにチオフラビンの骨格を改変することで、アミロイド構造への優れた結合能力を保ちつつ、Aβの酸素化を起こす独自の光触媒を開発しました(図2(a))。本触媒とAβ凝集体の混合液に、生体内に近い環境(酸素下、中性溶液下、37度)で可視光注8)を当てると、Aβ凝集体が酸素化されます。一方で、生体内で重要な役割を果たす他の生理活性ペプチド(アンギオテンシン4注9)、メトエンケファリン注10)、デスアシルグレリン注11)、ソマトスタチン注12))は酸素化されておらず、本触媒がアミロイド構造のみを区別して酸素化することが分かりました(図2(b)、図3(a))。
本研究グループが以前開発した光触媒(ビタミン骨格とペプチドの複合体)は、他の生理活性ペプチドも酸素化してしまうことから(図3(a))、本触媒は以前開発した光触媒より、生体に適合したものであるといえます。さらに、本触媒は、糖尿病に関連するアミリンやパーキンソン病に関連するα-シヌクレインなど、Aβ以外のアミロイドたんぱく質のアミロイド構造も区別して酸素化することが分かっており、これらの疾患の治療にも有効であると考えられます。
また、酸素化されていないAβでは凝集体が線維のように観測されますが、本触媒を用いて酸素化したAβでは線維集合体が観察されませんでした(図3(b))。これは、Aβ凝集体が酸素化されることで、凝集体のさらなる凝集の進行が抑えられたためと考えられます。さらに、Aβを認識するペプチドを結合させた本触媒を細胞存在下で用いた場合、アミロイド構造を区別してAβの酸素化が進行し、Aβ凝集体による細胞毒性が軽減されることも明らかとなりました(図3(c))。
<今後の展開>
今後、本触媒を、可視光よりエネルギーの小さい光(長波長の光)でもAβ凝集体を酸素化し、凝集を抑えることのできる、さらに生体に適合したものへと改良を進めます。また、本触媒を用いて、実際の動物生体内でもAβの凝集と細胞毒性を抑えられるかを明らかにしていきます。将来、触媒反応を用いた新しいアルツハイマー病治療法へと展開できれば、触媒自体を医薬として利用するという新しい治療法を難治性疾患に提供できると期待されます。
<参考図>
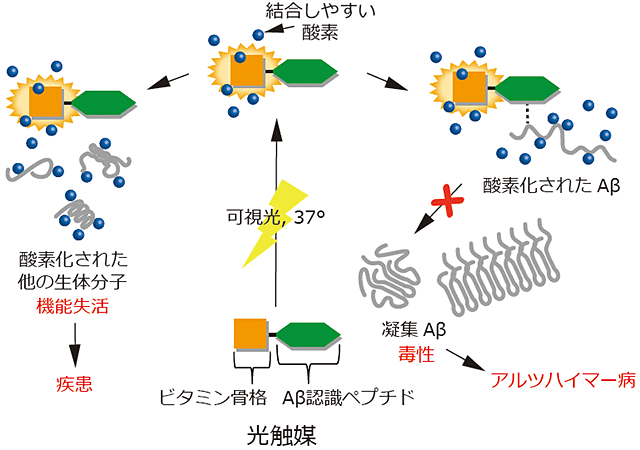
図1 以前開発した光触媒(ビタミン骨格とペプチドの複合体)の酸素化の仕組み
光触媒に可視光を当てると、ビタミン骨格から結合しやすい酸素が発生する。Aβを認識するペプチドがAβ近くに導かれ(点線で示す)、Aβを酸素化し、毒性を持つ凝集Aβの生成を防ぐことによりアルツハイマー病の発症と進行を抑える。しかし、生体内で重要な役割を果たしている他の生体分子も同時に酸素化するため、これらの分子の機能が失われることにより疾患の発症が懸念される。
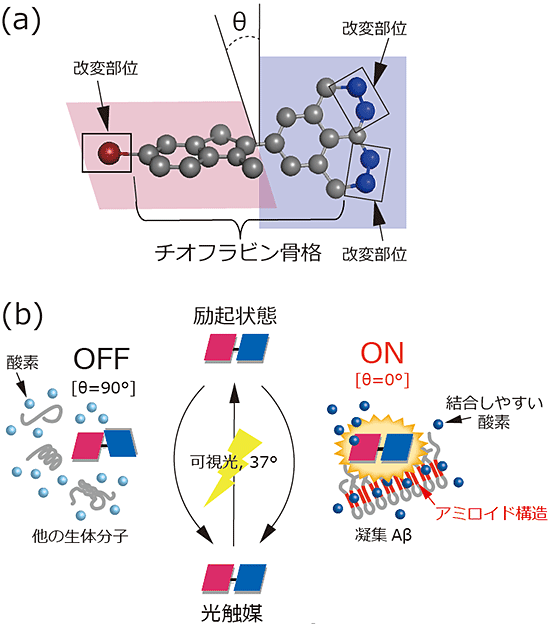
図2 今回開発した光触媒の化学構造と酸素化の仕組み
- (a)今回開発した光触媒の化学構造
-
光触媒は赤と青で示した2つの面で構成され、二面角Θ(シータ)が0度付近に固定されたときのみ、結合しやすい酸素を発生させることができる。チオフラビン骨格(灰球)に、四角で囲んだ臭素原子(赤球)と炭素原子(青球)を追加で導入することで、電子の励起を起こしやすく改変した。二面角とは、ある面ともう1つの面とのねじれを示す角度。一般にΘで表される。
- (b)光触媒が凝集Aβを区別して酸素化する仕組み
-
光触媒に可視光を当てると励起状態となる。光触媒がこの状態から元の状態に戻る際に、赤で示した凝集Aβのアミロイド構造に結合し、光触媒の二面角Θが0度付近に固定されたときのみ、結合しやすい酸素を発生し、凝集Aβを酸素化する。他の生体分子にはアミロイド構造がないため酸素化は起こらない。
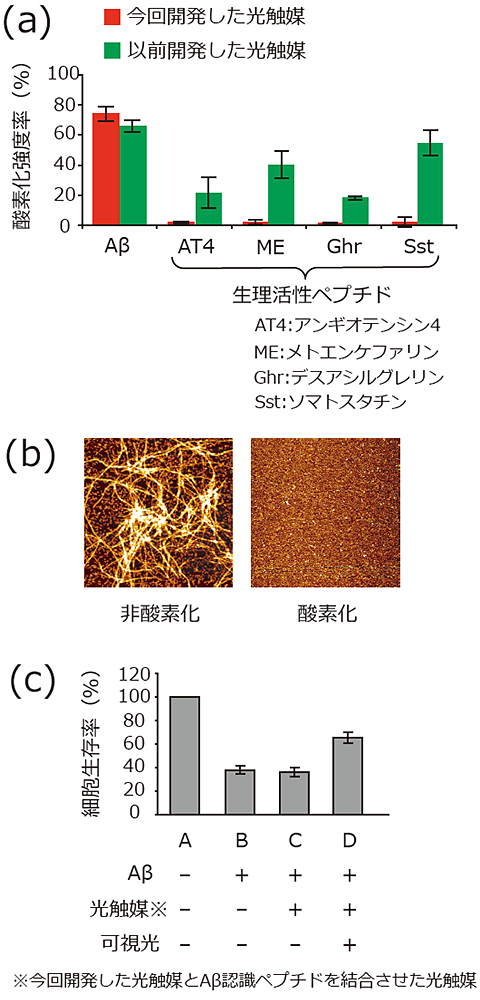
図3 今回開発した光触媒の酸素化、凝集阻害、および細胞毒性試験
- (a)光触媒によるAβの酸素化
-
光触媒は、凝集Aβを酸素化するが生理活性ペプチドは酸素化しない。一方、以前開発した光触媒は、凝集Aβを酸素化するが生理活性ペプチドも酸素化してしまう。(AT4:アンギオテンシン4、ME:メトエンケファリン、Ghr:デスアシルグレリン、Sst:ソマトスタチン)
- (b)酸素化されていないAβ(左)と酸素化されたAβ(右)の原子間力顕微鏡の画像
-
酸素化されていない場合はAβの凝集体が線維のように観測されるが、Aβが酸素化されると線維は観測されないことから、酸素化されたAβは凝集しないと考えられる。
- (c)光触媒にAβを認識するペプチドを結合させた触媒によるAβの細胞毒性軽減
-
酸素化されていないAβを神経細胞と混ぜると、Aβの毒性により細胞生存率は下がる(AとBを比較)が、光触媒にAβを認識するペプチドを結合させた触媒に可視光を当てることで、Aβが酸素化されるとAβの毒性が下がり、細胞生存率が上がる(BとCとDを比較)。
<用語解説>
- 注1) 凝集
- 分子が集合して1つに固まること。
- 注2) アミロイド構造
- アミロイドたんぱく質に特有に含まれる構造。クロスβシート構造とも呼ばれる。
- 注3) 酸素化
- 物質が酸素と結合する化学反応の一種。
- 注4) 光触媒
- 光を当てることによって特定の反応を進行させやすくする分子。
- 注5) 触媒反応
- 特定の反応を進行させやすくする分子(触媒)の作用によって進行する化学反応。
- 注6) 生体分子
- 生体内に含まれ生命活動に重要な働きを持つ分子の総称。たんぱく質、脂質、核酸、ホルモン、アミノ酸など。
- 注7) 励起
- 分子が外からエネルギーを与えられエネルギーの高い状態へと移ること。
- 注8) 可視光
- 人間の目で見える波長の光。
- 注9) アンギオテンシン4(AT4)
- 心臓の収縮力を高め、血圧を調整する生理活性ペプチド。
- 注10) メトエンケファリン(ME)
- 脳内で痛みの知覚を妨げる働きを持つ生理活性ペプチド。
- 注11) デスアシルグレリン(Ghr)
- 摂食行動や胃の空腹期運動を抑制する生理活性ペプチド。
- 注12) ソマトスタチン(Sst)
- 胃液、胃酸の分泌を抑制する生理活性ペプチド。
<論文タイトル>
“Switchable photooxygenation catalysts that sense higher-order amyloid structures”
(アミロイド高次構造を識別し切換え可能な光酸素化触媒)
doi :10.1038/nchem.2550
<お問い合わせ先>
<研究に関すること>
金井 求(カナイ モトム)
ERATO 金井触媒分子生命プロジェクト 研究総括
東京大学 大学院薬学系研究科 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4830 Fax:03-5684-5206
E-mail:
相馬 洋平(ソウマ ヨウヘイ)
ERATO 金井触媒分子生命プロジェクト グループリーダー(講師相当)
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-1805 Fax:03-5684-5206
E-mail:
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: