京都大学 大学院生命科学研究科 今吉 格 特定准教授と同 山田 真弓 特定助教らの研究グループは、哺乳類細胞において、「青色光」により遺伝子のスイッチ(遺伝子発現)を効率良くオン/オフできる新しいテトラサイクリン誘導系(Tet)システム注1)を世界で初めて開発しました。
これまで酵母細胞などでは、光もしくは薬剤を用いて遺伝子発現を制御する技術は知られていましたが、哺乳類細胞ではその効率が必ずしも満足いくものではありませんでした。そこで本研究者らは、シロイヌナズナ由来の光受容体に着目し、それを従来のTetシステムと組み合わせることにより、遺伝子発現のオン/オフを「青色光」と「薬剤」で制御できる新しい技術の開発に成功しました。この技術(PA-Tetシステム)を用いることにより、マウスの脳の神経幹細胞や神経細胞あるいは皮膚中に存在する細胞など、さまざまな哺乳類細胞において、それらの遺伝子発現を光と薬剤で効率良く制御できることが示されました。
本技術を用いることによって、幹細胞の細胞増殖や細胞分化に関与する遺伝子のダイナミックな発現パターンを「光」と「薬剤」によって人工的に操作することが可能となり、発生・幹細胞・神経科学研究への貢献が期待されます。
本研究成果は、2018年10月10日に米国の国際学術誌「Cell reports」にオンライン掲載されます。
本研究は、「光応答性転写因子の脳神経回路研究への応用」(挑戦的萌芽研究、課題番号:26640011、代表者:今吉 格)、「生後脳神経新生を介した「個性」創発機構」(新学術領域研究、課題番号:16H06529、代表者:今吉 格)、「成体脳のニューロン新生に関与する新規遺伝子の探索」(若手研究(B)、課題番号:17K14950、代表者:山田 真弓)、および科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ「統合1細胞解析のための革新的技術基盤」(研究総括:浜地 格 京都大学 教授)における「三次元組織中における単一細胞レベルでの遺伝子発現動態操作法の開発と応用」(研究者:今吉 格、グラントナンバーJPMJPR14F3)の支援を受けて行われました。
<背景>
脳を構成するニューロン(神経細胞)注2)やグリア細胞注3)であるアストロサイト、オリゴデンドロサイトは、神経幹細胞から生み出されます。京都大学 大学院生命科学研究科 今吉 格 特定准教授らの研究グループでは、神経幹細胞に発現する転写因子注4)に着目し、神経幹細胞の細胞増殖や細胞分化の過程で、これらの転写因子がダイナミックな遺伝子発現パターンの変化を示すことを見いだしてきました。しかし、この複雑な遺伝子発現変動の機能的な意義の多くは未だ明らかになっていません。そこで、このような複雑な遺伝子発現パターンを人工的に制御し、その機能的意義を検証できる技術の開発が必要であると考えてきました。
これまでの研究では、光照射によって遺伝子発現のオン/オフを制御するシステムとして、光感受性の人工転写因子GAVPOを用いたGal4/UASシステム注5)が知られていました。しかしながら、このシステムでは光照射しない暗所においても遺伝子発現の誘導活性が見られたり、光照射を止めても遺伝子発現のオンの状態が残っている、といった欠点がありました。一方、最近さまざまな光感受性の遺伝子発現制御システムが開発されつつありますが、主に酵母細胞を用いて最適化が進められており、ヒトやマウスなどの哺乳類細胞では機能しない場合が多く存在しました。
また、「光」による遺伝子発現の制御法とは別に、「薬剤」であるテトラサイクリンやドキシサイクリン(Dox)という低分子化合物によって遺伝子発現を制御するテトラサイクリン誘導系(Tet)システムが哺乳類細胞で使用されてきました。Tetシステムには、「薬剤」を添加することにより遺伝子発現をオンにするTet-ONシステムと、「薬剤」存在下では遺伝子発現がオフではあるが「薬剤」を除去することにより遺伝子発現をオンにするTet-OFFシステムがあります。それらのシステムでは、「薬剤」と結合するタンパク質(TetRなど)が遺伝子発現を調節する遺伝子配列(TRE配列)に結合すると、その下流にある遺伝子の発現をオンにすることができます。そのためTRE配列の後に配置する遺伝子を変えることによって、その遺伝子発現のオン/オフを薬剤の投与/非投与によって制御することができます。しかし、Tetシステムでは、培養細胞あるいは生体内における「薬剤」の残留時間が長く、任意のタイミングで完全に除去することが難しいため、厳密な遺伝子発現制御が困難でした。さらに、Doxは細胞培地内や体内で拡散するため、Tetシステムが機能する生体内での領域を空間的に制御することも困難でした。
本研究者らは、光の持つ時間的・空間的分解能の良さに着目し、「光」によって活性制御が可能なTetシステムを開発できれば、より厳密な遺伝子発現の制御が可能になると考えました。そこで、シロイヌナズナ由来の光受容体であるCry2と、その結合パートナーであるCIB1に着目しました。これらは青色光照射によってヘテロ二量体(異なる2種の単量体が結合した分子)を形成します。すでに、哺乳類細胞において、Cry2-CIB1システム注6)を利用して「青色光」により内在性の遺伝子発現を制御できるLITEsという手法が開発されていましたが、この手法は遺伝子発現を制御したい遺伝子ごとに特別な因子(転写活性因子(TALEs))を調製しなければならず、一般的には汎用性が低い手法でした。また、フィトクロムタンパク質を利用して、「赤色光」により制御可能なTetシステムが報告されていますが、長時間の光照射を必要とするため、短時間で遺伝子発現を制御することは困難でした。そのため、本研究チームでは、Cry2-CIB1とTetシステムを組み合わせて、幅広い遺伝子に対してより簡便に使用できるような遺伝子発現の光制御システムの開発に取り組んできました。
<研究手法・成果>
本研究者らは、ヒト由来のHEK293T細胞を用いて、「青色光」により効率良く駆動するTetシステムの開発を試みました。まず、これまでに報告されていて光依存的に二量体の形成が誘導されるさまざまな2種類のタンパク質(Cry2とCIB1、TULIPs、Magnet、oLIDとiLIDの組み合わせなどの光作動性モジュール)とTetシステムを組み合わせることを検討しました。例えば、CIB1と転写因子(TetR)のDNA結合ドメインとの融合タンパク質をコードする遺伝子発現カセット(コンストラクト)を作製し、一方でCry2とp65タンパク質由来の転写活性化ドメイン(p65 AD)との融合タンパク質をコードする遺伝子発現カセット(コンストラクト)を作製しました。光照射により両者の結合がうまくいくと、TetRはTRE配列に結合し、TRE配列の下流に人工的に配置した遺伝子(ホタルの発光タンパク質ルシフェラーゼなど)の発現がオンになる状態を観察できるような実験系を利用しました。また、光作動性モジュールの配置や組み合わせを変えて、多数のスクリーニングを繰り返した結果、哺乳類細胞で機能したのは、Cry2-CIB1を使用した場合のみでした。さらに、Cry2とCIB1あるいはそれぞれの変異体の配置、安定性、細胞内局在、リンカー配列、アミノ酸置換などを詳細に検討して最適化しました。
このうち、最も効率良く機能するものを、PA-Tet(Photo-activatable-Tet)システムと名付けました。このシステムでは、Cry2の変異体であるCry2 PHR(L348F)(Cry2のPHRドメイン中の348番目のアミノ酸に置換があるもの)と、CIB1の変異体であるCIBN(CIB1を部分的に欠失させた上で、核移行ドメインに変異導入を行ったもの)を使用しています。この新たに開発したPA-Tetシステムは、従来の光感受性Gal4/UASシステムと比較して、暗所における遺伝子発現誘導が起きにくく、かつ、光に応答して誘導される遺伝子発現レベルは大幅に増加しました。また、従来のTetシステムと同じく、低分子化合物Doxによって活性制御できる性質も保持されていました。
そこで、PA-Tetシステムの特性を調べるために、このシステムを一過性あるいは安定的に発現させた培養細胞を用いて、光強度(光量)やDox濃度依存的な遺伝子発現誘導の変化を観察した結果、光量依存的に遺伝子発現を制御できることが分かりました(PA-Tet-OFFシステム)。さらに、光量とDox濃度の両者の条件を調整して遺伝子発現レベルをより精密に制御できるシステムも構築することができました(図2A、PA-Tet-ONシステム)。
このシステムでは、光照射の間隔やTRE配列の下流で発現する遺伝子の安定性を変化させることにより、人工的にさまざまな発現パターンを誘導することができました(図2B)。また、光が持つ空間分解能の良さを利用して、単一細胞レベルで光照射を行ったところ、標的とした細胞の遺伝子発現のみを制御することにも成功しました(図2C)。
さらに、培養細胞だけではなく、動物の生体内でもPA-Tetシステムは作動することが分かりました。マウス脳内の神経幹細胞(図3A-D)や神経細胞(図3E-H)に対して、エレクトロポレーション法(電気穿孔法)注7)やウイルスベクターを用いて脳細胞にPA-Tetシステムを導入し、光ファイバーなどにより局所的に光照射を行っても本システムは作動しました。また、PA-Tetシステムを持つ細胞をマウスの皮膚に移殖した場合(図3I)でも、「光」により遺伝子発現を制御することに成功しました。
以上の結果より、本研究で開発したPA-Tetシステムを使用すれば、さまざまな遺伝子発現パターンを創生あるいは操作できることが明らかとなりました。この技術を使用すれば、脳の発生や神経再生の過程で転写因子が示す複雑な遺伝子発現パターンを人工的に操作することができ、その機能的意義を検証できると考えています。将来的にはモデル動物の脳内の神経幹細胞にPA-Tetシステムを適応して、発生・幹細胞研究や神経科学研究への貢献を期待しています。
<波及効果、今後の予定>
さまざまな細胞の遺伝子発現を「光」や「薬剤」により制御できる技術は、脳内での神経幹細胞の分化制御メカニズムの解明に有用です。また、この技術を用いることで、神経幹細胞の自己複製やニューロンあるいはグリア細胞への分化誘導を光で操作することが可能になるので、脳損傷や神経変性疾患に対する再生医療研究に貢献することが期待されます(図4)。さらに、本研究では、皮膚細胞においてもPA-Tetシステムが使用できることが明らかとなりました。このことから、PA-Tetシステムは、神経幹細胞だけではなく、多能性幹細胞(ES細胞・iPS細胞)や造血幹細胞・皮膚幹細胞などの幹細胞でも使用できると期待され、幹細胞研究全体への幅広い波及効果が予想されます。
<参考図>
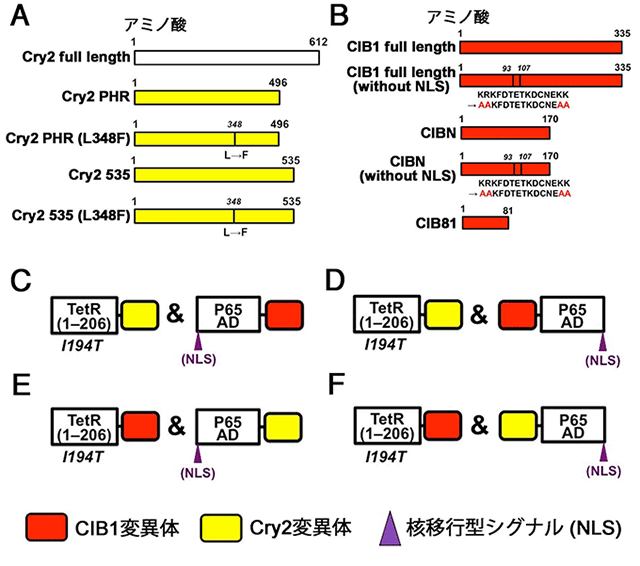
図1
Cry2(A)とCIB1(B)の変異体と、Cry2-CIB1を用いたPA-Tetシステムのスクリーニング(C-F)。低分子化合物Dox非存在下で作用するPA-Tet-OFFとDox存在下で作用するPA-Tet-ONシステムの2種類を開発した(2種類をまとめてPA-Tetシステムと呼ぶ)。
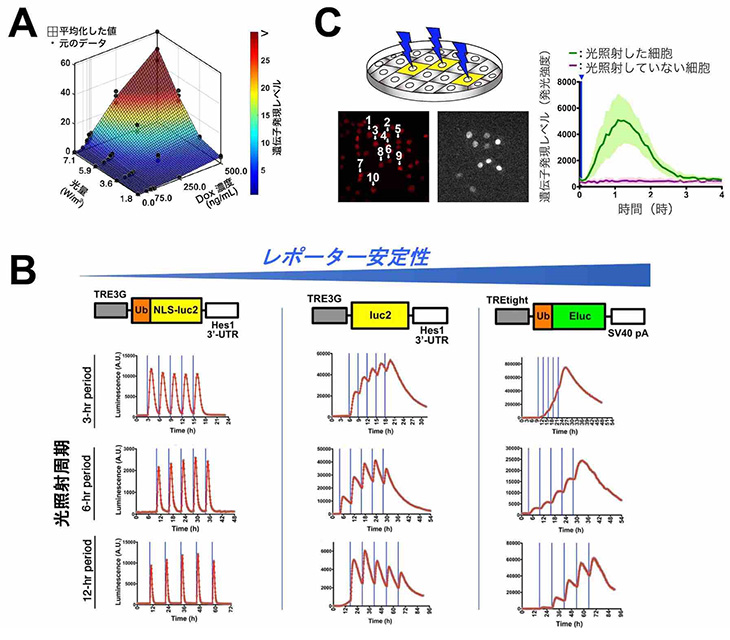
図2
- (A)PA-Tet-ONシステムでは、光量とDox濃度を調整することにより、遺伝子発現レベルを精密に制御することができる。
- (B)光照射周期とTRE配列の下流に配置したレポーター遺伝子の安定性を変えることで、さまざまな遺伝子発現パターンを創生する、あるいは、操作することができる。
- (C)単一細胞レベルにおいて、PA-Tetシステムにより遺伝子発現を制御することができる。
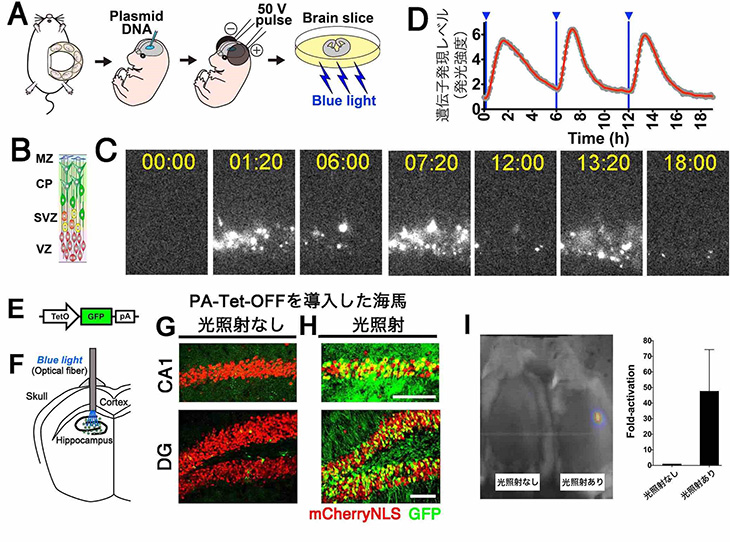
図3
マウスの神経幹細胞・神経細胞・皮膚細胞において、PA-Tetシステムにより遺伝子発現を制御できる。
- (A)エレクトロポレーション法により、マウス胎児脳の神経幹細胞にPA-Tetシステムを導入する。
- (B)マウス胎児脳の模式図。MZ, marginal zone、辺縁帯; CP, cortical plate、皮質プレート; SVZ, subventricular zone、脳室下帯; VZ, ventricular zone、脳室帯。
- (C)VZにおいて、PA-Tetシステムが発現し、光応答が見られる。
- (D)(C)の遺伝子発現の定量結果。青線の時間に青色光照射を実施。
- (E)TRE-GFPレポーターマウスの模式図。
- (F)TRE-GFPマウスの海馬神経細胞にPA-Tet-OFFシステムを発現させ、光ファイバーにより光照射を実施。
- (G)暗条件下では、GFPはほとんど発現が見られない。
- (H)明条件下では、光応答した多数のGFP陽性細胞が見られる。PA-Tet-OFFシステムを発現する細胞はmCherryNLS(赤色)で標識される。
- (I)マウス皮膚細胞においても、PA-Tetシステムにより遺伝子発現を制御することができる。
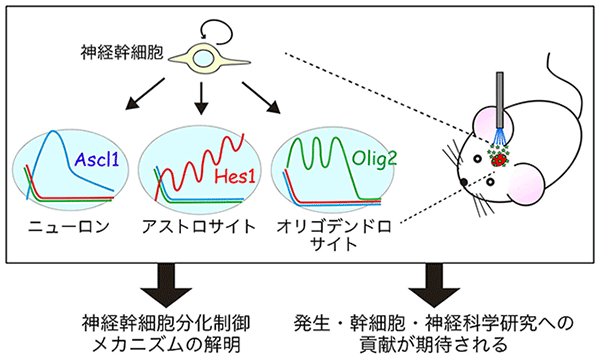
図4
PA-Tetシステムを用いることにより、神経幹細胞の分化制御メカニズムの解明、および、発生・幹細胞・神経科学研究への貢献が期待される。
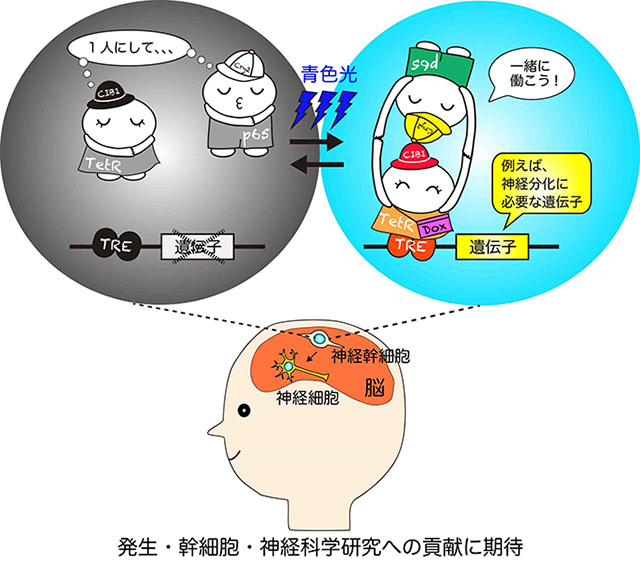
図5
<用語解説>
- 注1)テトラサイクリン誘導系(Tet)システム
- 大腸菌由来のTetR転写因子と、その結合配列であるTRE(TetO)配列を用いた遺伝子発現制御システムである。抗生物質テトラサイクリンの誘導体であるドキシサイクリン(Dox)非存在下で、TetRのDNA結合と転写機能を抑制できるTet-OFFシステムが初めに開発された。その後、TetRへの変異導入により、Dox非存在下ではTRE配列に結合できず、Dox存在下でTRE配列に結合して転写活性を持つようになるTet-ONシステムが開発された。
- 注2)ニューロン(神経細胞)
- 神経系を構成する細胞であり、細胞体・樹状突起・軸索を持つ。脳と脊髄を含む中枢神経系では、ニューロンは軸索末端を介して他のニューロンの樹状突起へと情報を伝達し、神経ネットワークを形成する。
- 注3)グリア細胞
- 神経系を構成するニューロンではない細胞の総称。グリア細胞は脳環境の恒常性の維持に寄与していると考えられてきたが、近年ニューロンの活動にも関与していることが示唆されてきた。
- 注4)転写因子
- DNAに特異的に結合するタンパク質の一群。DNA上の転写を制御する領域に結合し、DNAの遺伝情報をRNAに転写する過程を制御する。
- 注5)Gal4/UASシステム
- 酵母由来のGal4転写因子と、その結合配列であるUAS(Upstream Activating Sequence)を用いた遺伝子発現制御システムである。転写を活性化させるGal4タンパク質によって、UAS配列下に導入した遺伝子の発現を制御することができる。
- 注6)Cry2-CIB1システム
- Cry2はシロイヌナズナ(Arabidopsis thaliana)が持つクリプトクロムと呼ばれる光受容体。Cry2は青色光照射依存的に構造変化し、同じくシロイヌナズナ由来のタンパク質CIB1タンパク質に結合できるようになる。Cry2-CIB1システムは、この性質を使用した、光依存的な二量体形成システムである。
- 注7)エレクトロポレーション法(電気穿孔法)
- 電気パルスで細胞膜の透過性を上げて、DNA(プラスミドなど)などの分子を細胞内に導入する手法である。
<論文情報>
| タイトル |
“Light control of the Tet-gene expression system in mammalian cells”
(哺乳類細胞における、光作動性Tet遺伝子発現制御システムの開発) |
| 著者名 |
Mayumi Yamada, Yusuke Suzuki, Shinji C. Nagasaki, Hiroyuki Okuno, and Itaru Imayoshi
|
| DOI |
10.1016/j.celrep.2018.09.026 |
<お問い合わせ先>
<研究に関すること>
今吉 格(イマヨシ イタル)
京都大学 大学院生命科学研究科 特定准教授
Tel:075-751-3977 Fax:075-751-4807
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道に関すること>
京都大学 総務部広報課 国際広報室
Tel:075-753-5729 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: