岡山大学 大学院環境生命科学研究科(農)の能年 義輝 准教授と理化学研究所 環境資源科学研究センターの香西 雄介 基礎科学特別研究員、持田 恵一 チームリーダーらの共同研究グループは、作物病害である紋枯病(もんがれびょう)注1)に対し、植物が植物ホルモンの一つであるサリチル酸注2)を介した免疫機構によって抵抗性を発揮する能力を持つことを突き止めました。本研究成果は英国時間10月19日、英国のオンライン科学雑誌「New Phytologist」に掲載されます。
紋枯病はイネやバイオマス作物に甚大な被害をもたらす重要病害ですが、その感染の仕組みやそれに対して植物が身を守る機構はよくわかっていませんでした。本成果により、これまで殺菌剤のみが唯一の防除手段であった紋枯病に対して、新たな手段を適用できる可能性が示され、今後の作物やバイオマス資源の収量増加が期待されます。
<研究の背景>
紋枯病はイネ栽培においていもち病注3)に次ぐ二大病害に数えられ、アジアや米国で猛威を奮っています(図1)。本病は土壌に生息するRhizoctonia solaniという植物病原糸状菌が原因となって起こります。本菌の宿主範囲は広く、200以上の植物種に紋枯病、根腐病、立枯病といった農業上問題となる数多くの病気も引き起こします。紋枯病菌は高温多湿を好むため、地球環境変動に伴う今後の被害拡大も懸念されています。
現在、紋枯病は殺菌剤を唯一の手段として防除されていますが、一部では農薬が効かない耐性菌が現れはじめており、新たな防除策の開発が急務となっています。一般に、植物は活物寄生菌注4)を認識するセンサーに相当する抵抗性遺伝子を持っており、交配や遺伝子組み換えによってそれらを導入した抵抗性作物品種が防除手段として使われます。しかし栽培イネには紋枯病抵抗性品種がなく、抵抗性遺伝子資源が存在しません。また、いもち病菌は感染時に活物寄生段階を経るので、植物のサリチル酸経路を活性化する薬剤である抵抗性誘導剤が優れた防除手段になっていますが、いもち病用に開発された既存剤は紋枯病には効きません。
これらの事象は本菌の殺生菌としての性質を支持していました。ただ本菌の遺伝子操作や遺伝学的解析は難しいため、その病原性機構は実際にはよくわかっていませんでした。
<研究の内容>
能年准教授らの共同研究グループは、JST戦略的創造研究推進事業 先端的低炭素化技術開発(ALCA)において、モデル植物であるイネとミナトカモジグサに植物ホルモン注5)のサリチル酸を投与すると紋枯病への抵抗性を示すこと(図1、2)、サリチル酸を欠乏させたイネは紋枯病の症状が悪化すること、またミナトカモジグサの野生系統の多くは紋枯病に罹病性を示すものの、紋枯病感染を認識すると自らサリチル酸経路を活性化して抵抗性を発揮する二つの系統が存在することを明らかにしました。すなわち、植物はサリチル酸とその下流のシグナルを経由した植物免疫機構によって紋枯病を抑制する能力を持つことを突き止めました。
植物病原菌には、毒素などで殺した植物細胞から栄養を摂取する殺生菌と、生きた植物細胞に寄生して栄養をかすめ取る活物寄生菌がいます。植物は主にホルモンであるジャスモン酸とエチレンによって殺生菌に、サリチル酸によって活物寄生菌に対して有効となる防御をそれぞれ誘導します。紋枯病菌は殺生菌に分類されますが、今回定説に反して紋枯病抵抗性にサリチル酸を介した植物免疫が重要な役割を果たすことを見いだしました。今回の解明は、紋枯病菌が実は感染初期に活物寄生段階を経るという感染様式の新たな一面も示唆しており、活物寄生菌に対して長年培われてきた病害防除策を紋枯病に援用できる可能性が示されました。
本研究では、イネやバイオマス作物の減収を引き起こす紋枯病(図3)の克服に向けた基礎的知見を得るため、まず単子葉植物のモデルであるミナトカモジグサ(Brachypodium distachyon)を利用した紋枯病モデル感染系を確立しました。日本各地から分離されたさまざまなR.solaniの各菌株をミナトカモジグサの標準系統Bd21に感染させたところ、複数の菌株が感染性を持ち、イネ紋枯病から分離された菌株が最も強い病徴を示しました。つまり、ミナトカモジグサはイネ紋枯病研究のモデルに成り得ることがわかりました。
次に、防御応答に関わる植物ホルモンであるサリチル酸、ジャスモン酸、エチレンがミナトカモジグサの紋枯病抵抗性に与える影響を調べました。紋枯病菌は殺生菌として広く認知されていたため、ジャスモン酸やエチレンが防除効果を発揮すると予測しましたが、驚いたことにサリチル酸処理によって紋枯病抵抗性が誘導されることを見いだしました(図4)。確認実験としてイネにもサリチル酸処理を行いましたが、やはり紋枯病抵抗性が誘導されました。つまり、紋枯病菌は単なる殺生菌ではなく、感染初期においてはサリチル酸処理が有効に作用する活物寄生のステップを経ている可能性が示されました。
紋枯病菌感染過程を顕微鏡で観察すると、接種40時間後には葉内の菌糸量が増加し、葉表面に感染座と呼ばれる侵入菌糸の伸長起点が形成され始め、さらに60時間後には菌糸量と感染座数が激増することがわかりました(図5)。一方、サリチル酸処理葉では菌糸量の増大や感染座の形成が共に認められず、初期段階で感染が食い止められていました(図5)。そこで、バクテリア由来のサリチル酸分解酵素(NahG)遺伝子を導入して、体内のサリチル酸を枯渇させた遺伝子組換えイネの紋枯病抵抗性を調べたところ、野生型よりも罹病性が増していることがわかり、紋枯病抵抗性へのサリチル酸の寄与が裏付けられました(図6)。
イネいもち病の防除には、サリチル酸経路を活性化する抵抗性誘導剤のプロベナゾールやチアジニルが実用化剤として用いられていますが、それらは紋枯病には効果を示しません。そこで改めてミナトカモジグサにそれらの薬剤を投与しましたが、やはり紋枯病抵抗性は誘導されませんでした(図7左)。サリチル酸にその分子構造が類似したアセチルサリチル酸は紋枯病抵抗性を誘導しましたが、さまざまな植物科学研究で利用されてきたサリチル酸を模倣する薬剤であるジクロロアントラニル酸(DCA)、イソニコチン酸(INA)、アシベンゾラル-S-メチル(BTH)は紋枯病抵抗性を誘導しないかその活性が弱いことがわかりました(図7右)。サリチル酸とBTHのミナトカモジグサにおける応答性の違いを調べるため、ミナトカモジグサを各薬剤で処理し、24時間後に発現が誘導される遺伝子と抑制される遺伝子とを網羅的に同定し、その種類と数を比べました(図8)。その結果、BTHはサリチル酸が誘導、または抑制する遺伝子群のうち、およそ80%を同様に制御しますが、サリチル酸とは独立に多くの遺伝子群の発現変動も引き起こしていることがわかりました(図8)。双子葉植物のモデルであるシロイヌナズナにおいて、BTHとサリチル酸は極めて類似した遺伝子発現変動パターンを示しますが、単子葉植物のミナトカモジグサではその応答性が大きく異なっていました。このことから、紋枯病抵抗性には、1.サリチル酸のみが誘導しうる遺伝子群(図8左の89個に相当し細胞壁強化に関わる遺伝子群を含む)が必要である可能性、または、2.BTHのみに影響を受ける多くの遺伝子群がサリチル酸誘導性の紋枯病抵抗性を乱してしまう可能性が考えられました。植物はサリチル酸を即座に代謝しますので、サリチル酸自身を抵抗性誘導剤として利用することは難しい状況です。紋枯病に有効となる抵抗性誘導剤を開発するには、サリチル酸が誘導する遺伝子群をある程度忠実に模倣する薬剤を選抜することが重要と考えられます。
次に、世界各地から採集されたミナトカモジグサの野生系統(アクセッション)の紋枯病抵抗性を比較しました。その結果、Bd3-1とGaz-4という両系統が紋枯病抵抗性を示しました(図9)。それらは感染後24時間以内にサリチル酸で制御される防御関連遺伝子を発現誘導していました(図10)。つまり、これらの系統は紋枯病菌を認識して防御反応を誘導するためのセンサーをコードする抵抗性遺伝子を保有していることを意味しています。この一連の反応は活物寄生菌に有効な防御応答であることから、この結果も、紋枯病菌が活物寄生段階を経ており、その段階をサリチル酸経路の免疫応答が効率的にブロックするという説明を支持しています。
非常に宿主範囲が広いこと、栽培イネに紋枯病抵抗性品種が存在しないこと、既存の抵抗性誘導剤が効果を発揮しないことなどから、紋枯病は単なる殺生菌と認識されてきました。しかし、ミナトカモジグサという非常に扱いやすいモデル植物を用いた詳細な研究により、紋枯病に対して有効となる植物の免疫機構が明らかとなり、そのことで紋枯病菌の病原性機構の新たな側面が示されました。
<今後の期待>
ミナトカモジグサが保有する紋枯病抵抗性遺伝子が同定できれば、それらはさまざまな作物種に導入する形で紋枯病抵抗性品種の作出に利用できます。また、サリチル酸の働きを持つ化合物は、紋枯病に効果を持つ抵抗性誘導剤の開発シーズになる可能性もあります。今後、防除策の開発が進み紋枯病被害が軽減されることで、作物やバイオマス資源の収量増加のほか、食糧安全保証の強化やバイオマス資源に立脚した低炭素社会の実現への貢献が期待されます。
今回の紋枯病菌の新たな感染戦略の発見は、植物免疫を撹乱する目的で紋枯病菌が放出する武器となるタンパク質群(エフェクター)とそれを認識する宿主植物のセンサータンパク質を同定する研究へと展開されることで、植物-微生物間の攻防の詳細が分子レベルで明らかになることも期待されます。
<参考図>

図1 各種植物ホルモンを処理したミナトカモジグサ葉の紋枯病感染度合い

図2 サリチル酸処理した葉の表面における紋枯病菌糸の様子
紫色に見えるのが菌糸。無処理では感染座と呼ばれる感染器官が形成されるが、サリチル酸処理葉では感染座が観察されない。

図3 水稲に発生した紋枯病の初期病斑
水面に浮かんだ菌糸の塊(菌核)が稲の葉鞘に付着して感染し、紋型の病斑を形成する。次第に菌糸は上方や周辺に拡がり、最終的には倒伏や枯死を招く。
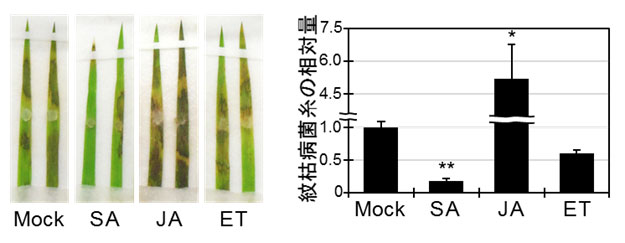
図4 各種植物ホルモンを処理したミナトカモジグサ葉に対する紋枯病菌の接種試験
- 左:3日後の病斑
- 右:感染葉内における紋枯病菌糸の相対量
(Mock,対照区(植物ホルモン処理無し);SA,サリチル酸;JA,ジャスモン酸;ET,エチレン)
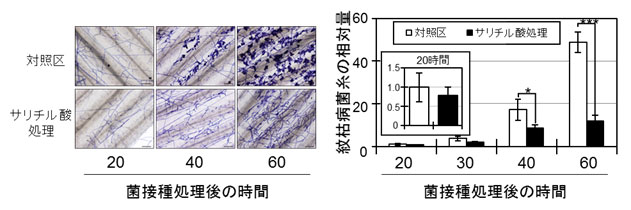
図5 サリチル酸を処理したミナトカモジグサ葉での紋枯病菌の感染
- 左:葉上での紋枯病菌糸(紫色)の顕微鏡写真(40、60時間に観察される塊が感染座)
- 右:感染葉内における紋枯病菌糸の相対量の経時変化
(枠内は感染後20時間の拡大図)
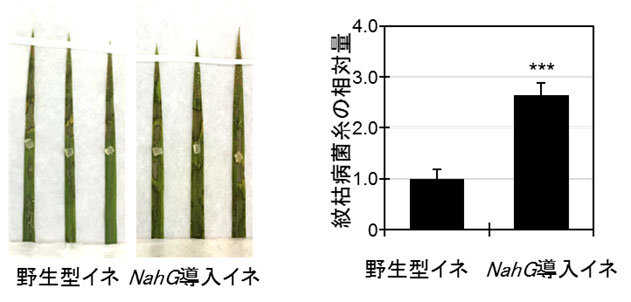
図6 サリチル酸分解酵素遺伝子NahGを導入したイネにおける紋枯病感染
- 左:菌接種3日後の病斑
- 右:菌接種3日後の葉内における紋枯病菌体量の相対比較
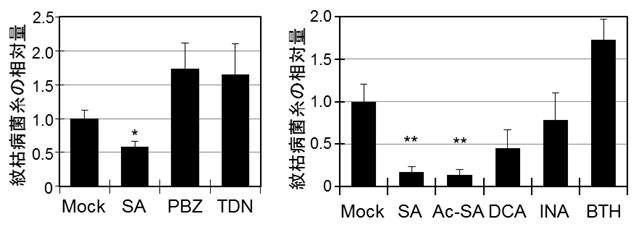
図7 各種薬剤を処理したミナトカモジグサ葉に対する紋枯病菌の接種試験
- 左:サリチル酸といもち病に対する実用抵抗性誘導剤をミナトカモジグサ葉に処理し、紋枯病菌を接種して3日後の葉内の紋枯病菌体量を相対比較した結果
- 右:サリチル酸、およびサリチル酸の構造的・機能的アナログをミナトカモジグサ葉に処理し、紋枯病菌を接種して3日後の葉内の紋枯病菌体量を相対比較した結果
(Mock,対照区;SA,サリチル酸;PBZ,プロベナゾール;TDN,チアジニル;Ac-SA,アセチルサリチル酸;DCA,ジクロロアントラニル酸,INA,イソニコチン酸;BTH,アシベンゾラル-S-メチル)
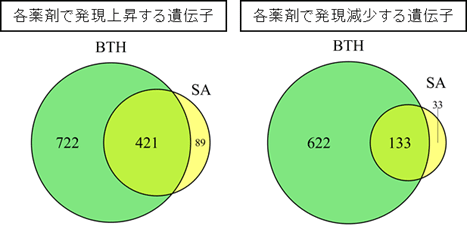
図8 サリチル酸(SA)とアシベンゾラル-S-メチル(BTH)をそれぞれ処理したミナトカモジグサ葉において、
24時間後に発現が上昇(左)、または減少(右)する遺伝子群の種類と数の比較

図9 ミナトカモジグサの各種野生系統(Bd21,Bd3-1,Gaz-4)に対する紋枯病菌の接種試験
- 左:菌接種3日後の病斑
- 右:菌接種3日後の葉内における紋枯病菌体量の相対比較(Bd21,標準系統)
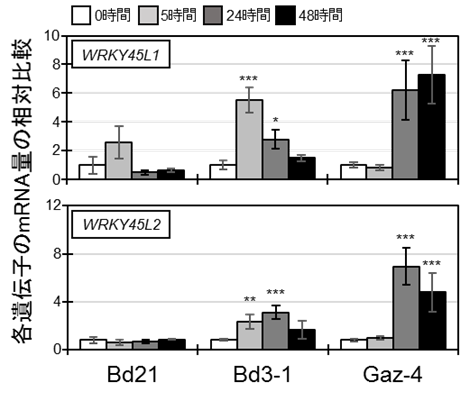
図10 紋枯病菌を接種したミナトカモジグサの各種野生系統における、
サリチル酸応答の指標となる遺伝子(WRKY45L1およびL2)の発現量の経時変化
<用語解説>
- 注1) 紋枯病(もんがれびょう)
- 水稲や飼料イネの重要病害であり、トウモロコシ、ソルガム、ネピアグラスといったバイオマス作物にも発生する。Rhizotonia solaniの菌糸が塊となって土中で越冬し、それが翌年水に浮かび上がってイネ葉鞘に触れて感染が始まる。感染部位やその周辺には楕円形の紋型病斑が形成される(図3)。気温と湿度の上昇に伴って菌糸はさらに上方や周囲の植物体へと拡がり、植物体の倒伏、枯死、米粒の品質低下を引き起こす。
- 注2) サリチル酸
- 2-ヒドロキシ安息香酸。植物ホルモンの一つであり、植物の活物寄生菌に対する免疫応答、老化、環境適応などを制御する働きを持つ。
- 注3) いもち病(稲熱病)
- イネ栽培において最も被害が大きい重要病害であり、糸状菌であるPyricularia oryzaeが原因となって引き起こされる。本菌は半活物寄生菌に分類される。殺菌性農薬、抵抗性品種、抵抗性誘導剤といったさまざまな手段によって防除されているが、冷夏などにより被害が拡大すると収穫に大きく影響する。
- 注4) 活物寄生菌
- 植物病原菌は宿主となる植物の傷口や気孔などの開口部から、また溶かした細胞壁を通って内部へと侵入する。植物は病原菌を含む自然界に存在する種々の微生物を認識し、それらを排除するための防御応答を誘導するので、病原菌は化学物質やタンパク質(エフェクター)を宿主へと放出しながら身を隠して感知されるのを防いだり、防御応答の誘導を邪魔したりする。そして、最終的には栄養を摂取するための器官を作ったり、また細胞の中や細胞間に存在する養分を吸収して増殖する。この一連の巧妙な感染過程では、宿主の細胞構造や養分調達といった営み自体を利用するため、宿主細胞は生きている必要がある。このように生きた植物体を利用することでのみ生活できる植物病原菌を活物寄生菌と呼ぶ。一方、通常は死んだ生物や植物遺体などから養分を得る腐生生活を送るが、条件によっては毒素などで生きた植物細胞を殺して養分を得る植物病原菌も存在し、それらは殺生菌と呼ばれる。感染初期は活物寄生様式を経るが、後に植物細胞を殺す段階へと移行するものも存在し、それらは半活物寄生菌と呼ばれる。移行するタイミングや方法については病原菌の種類によって異なる。
- 注5) 植物ホルモン
- 生長や発達、各種環境応答などを制御するために植物自らが作り出す化学物質。オーキシン、ジベレリン、サイトカイニン、エチレン、アブシシン酸、ブラシノステロイド、ジャスモン酸、サリチル酸、ストリゴラクトンの9種が知られている。これらの働きは、合成、輸送、代謝の調節によって厳密に制御されている。ペプチド性の生理活性物質は「ペプチドホルモン」として区別される。
<論文情報>
| タイトル |
“Salicyclic acid-dependent immunity contributes to resistance against Rhizoctonia solani, a necrotrophic fungal agent of sheath blight, in rice and Brachypodium distachyon.”
(殺生菌であるリゾクトニアソラニが引き起こす紋枯病に対し、イネおよびミナトカモジグサでは、サリチル酸依存的な免疫が抵抗性に寄与する) |
| 著者名 |
Yusuke Kouzai, Mamiko Kimura, Megumi Watanabe, Kazuki Kusunoki, Daiki Osaka, Tomoko Suzuki, Hidenori Matsui, Mikihiro Yamamoto, Yuki Ichinose, Kazuhiro Toyoda, Takakazu Matsuura, Izumi C. Mori, Takashi Hirayama, Eiichi Minami, Yoko Nishizawa, Komaki Inoue, Yoshihiko Onda, Keiichi Mochida, and Yoshiteru Noutoshi |
| 掲載誌 |
New Phytologist |
| doi |
10.1111/nph.14849 |
<お問い合わせ先>
<研究に関すること>
能年 義輝(ノウトシ ヨシテル)
岡山大学 大学院環境生命科学研究科(農) 准教授
Tel:086-251-8311 Fax:086-251-8311
E-mail:
香西 雄介(コウザイ ユウスケ)
理化学研究所 環境資源科学研究センター バイオマス工学研究部門セルロース生産研究チーム 基礎科学特別研究員
Tel:045-820-2443 Fax:045-820-1901
E-mail:
持田 恵一(モチダ ケイイチ)
理化学研究所 環境資源科学研究センター バイオマス工学研究部門セルロース生産研究チーム チームリーダー
Tel:045-503-9186 Fax:045-503-9182
E-mail:
<JST事業に関すること>
江森 正憲(エモリ マサノリ)
環境エネルギー研究開発推進部 ALCAグループ
Tel:03-3512-3543 Fax:03-3512-3533
E-mail:
<報道担当>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: