ポイント
- 細菌の生存に重要な役割を果たす球状の膜構造体MVメンブレンベシクルが、外側を厚い細胞壁に覆われた細菌(グラム陽性細菌)の細胞壁を通過して細胞外にどのようにして放出されるのかという、MV形成における最大の謎を解明しました。
- 細胞壁に「穴が空く」ことで、MVが形成・放出されることを明らかにしました。
- MVを形成する仕組みの解明は、ワクチン開発や有用物質生産へとつながり、細菌が病原性を発揮することの理解にも関わるので、医学・産業分野に貢献することが期待されます。
筑波大学 生命環境系 豊福 雅典 助教(チューリッヒ大学 客員研究員兼任)、山本 達也 研究員、野村 暢彦 教授らの研究グループは、スイスのチューリッヒ大学、スイス連邦工科大学チューリッヒ校(ETH)との共同研究により、外側を厚い細胞壁に覆われた細菌(グラム陽性細菌注1))において、袋状の膜構造体(MV;メンブレンベシクル)注2)が細胞壁を通って形成・放出される仕組みを世界で初めて解明しました。
多くのグラム陽性細菌が細胞外にMVを放出することは明らかとなっていました。しかし、MVがどのように形成・放出されるのかは、MV研究の最大の謎となっていました。グラム陽性細菌の厚い細胞壁は、構造上、2nm程度の物質しか通しません。ところが、MVは直径20~400nm程度の大きさで、細胞壁を通過するには明らかに大きすぎるからです。
本研究グループは、細胞壁に穴を空ける酵素(エンドリシン)注3)によって細胞壁に穴が空くことで、膜が押し出され、MVが形成・放出される仕組みを発見しました。穴を通してMVが形成される仕組みは、例えるならシャボン玉を形成する方法と似ています。
MV形成過程で細胞壁に穴が空いた細胞は死ぬこともわかりました。これまで、MVを形成した細胞は死ぬことなく,その後も生存すると考えられてきましたが、本研究では、この説を一度捨てることで、新しい発見が得られました。
さらに興味深いことに、MV生産が細胞の間で連鎖することが観察されました。これは、エンドリシンがMVと共に細胞外に放出されて、周囲の細胞の細胞壁に穴を空けることでMV形成を誘導するからだと考えられます。
エンドリシンは多くの細菌が保有しているため、本研究で見つかった仕組みは細菌に共通するものと考えられ、なぜ多くの細菌がMVを形成できるのかの解明につながると期待されます。
MVの機能は未知な部分もありますが、MVを形成する仕組みの解明は、細菌を利用したワクチンや有用物質生産にも役立ち、細菌の病原性にもMVが関わることから、医学・産業分野など幅広い分野に貢献することが期待されます。
本研究の成果は、2017年9月7日(英国時間)付「Nature Communications」で公開される予定です。
本研究は、科学研究費若手研究(A)(豊福)の助成によって実施され、科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究(ERATO) 「野村集団微生物制御プロジェクト」(野村)の一環で行われました。
<研究の背景>
細菌は医療・食料・環境問題を含めて、私たちの生活と密接に関係しています。多くの細菌は、自身の細胞膜で構成された球状の構造物であるMVを環境中に放出します。MVは、細菌間においては、情報伝達やタンパク質の輸送、遺伝子の水平伝播に関与し、抗生物質やファージ(細菌に感染するウィルス)への「おとり」としても働くことで,細菌の生存に関与します。さらに、細菌感染する動植物との相互作用においては、毒素因子の運搬など、細菌の病原性に関わっています。ただしMVは海洋などの環境中からも発見されており、その機能の全容は未だ明らかになっていません。その一方で、有用な酵素をMVに内包させたナノ反応工場としての利用が検討されたり、国外では髄膜炎菌ワクチンとしての利用が認可されたりするなど、応用面でも高い潜在能力を秘めています。
MVが細菌やヒト、環境に与える影響については徐々に明らかとなりつつありますが、MVがどのようにして形成されるかについてはよく分かっていません。特に、細胞膜の外側が厚い細胞壁で覆われているグラム陽性細菌においては、MV形成機構の理解が全く進んでいませんでした。
細菌の構造は、グラム陰性細菌とグラム陽性細菌で大きく二分されます。グラム陰性細菌は外側に細胞膜が露出しているのに対し、グラム陽性細菌の細胞膜は厚い細胞壁で覆われています(図1)。この細胞壁は網目構造をとっており、2nm程度の物質しか通過できないため、直径が20~400nm程度のMVがどのようにして通過できるのかが、MV形成機構における最大の謎となっていました。
<研究内容と成果>
本研究では、グラム陽性細菌で最も研究が進んでいる枯草菌を用いて、MVは細胞壁に穴が空くことで形成されることを発見し、世界で初めて、グラム陽性細菌におけるMV形成機構を解明しました(図1、2)。
これまで、MVを形成した細胞は死ぬことなく,そのまま生き続けると考えられてきました。しかし本研究グループは、この説を一度捨てたことで、新しい発見につながりました。ことの発端は、グラム陰性細菌において、細胞が破裂することで、MVが形成されることを発見した成果にまで遡ります(Turnbull et al., 2016)。実は、この細胞破裂に関わる酵素(エンドリシン)は細胞壁分解酵素であり、多くの細菌が保有しています。グラム陽性細菌もエンドリシンを保有しているため、そのMV形成にも細胞破裂が関与しているのではないかと予想しました。
共焦点顕微鏡を用いてエンドリシンによる枯草菌のMV形成過程を動画撮影したところ、当初の予想とは異なり、細胞は破裂せずに、形を保ったまま、MVを細胞外に放出しました。MVを放出した細胞を詳しく調べてみると、その細胞は中身の大部分を失っており、細胞壁だけを残した「抜け殻」の状態となっていました。その原因の1つとしては、エンドリシンの作用により、細胞壁が部分的に分解された可能性が考えられました。この説を検証するために、電子顕微鏡を用いて細胞壁の微細構造を観察したところ、細胞壁に穴が空いていることが明らかとなりました。細胞では、細胞膜を細胞壁に押し付ける圧力が働いています。従って、細胞壁に穴が空くと、吹きかけた息でシャボン玉が形成されるように、穴から膜が押し出され、やがて細胞外にシャボン玉状のMVが放出されます。そのようにしてMVが細胞壁の穴から形成されている瞬間を、元の構造をほぼ完全に保存したまま4nmの分解能で3次元観察ができる最先端の電子顕微鏡(クライオ電子線トモグラフィ)によって捉えることに成功しました(図2)。エンドリシンは、細胞内で形成されたファージが細胞外に出ていく際に、細胞を壊すために使用されている酵素として元々知られています。つまり、本研究の成果は、MVとファージの生産は連動していることを示しています。今回の観察では、ファージ様粒子を含んでいるMVも初めて観察されています。今後、ファージ感染におけるMVの新たな役割が見つかることも期待されます。
エンドリシンによってMVを生産した枯草菌は、そのまま死んでしまいます。興味深いことに、MV生産が集団中で始まると、まるでドミノ倒しのように、集団中で次々と枯草菌が死滅しMV形成が誘導されていくことが観察されました。しかし、通常、エンドリシンを発現する細胞は枯草菌集団中のごく一部です。このMV形成の連鎖反応は、MVと共に細胞外に放出されたエンドリシンが、周囲の細胞の外側から細胞壁に穴を開けてMV形成を誘導するからだと考えられます。この仮説を検証するために、エンドリシンを誘導した枯草菌の培養液に新鮮な枯草菌をさらしたところ、MVが形成されることが確認できました。エンドリシンによるMV形成は細胞死を伴いますが、エンドリシンは枯草菌の生存戦略に深く関わるタンパク質によってその発現が調節されているため、エンドリシンによるMVの誘導は、集団全体の生存戦略上、重要な役割を担っていると考えられます。
本研究では、グラム陽性細菌におけるMV形成機構を初めて明らかにしました。本成果は、構造が異なるグラム陰性細菌でもグラム陽性細菌でも、エンドリシンがMV形成に関わる因子であることを示しています。このように、2種類の細菌の両者のMV形成に関わる因子としては、エンドリシン以外の報告はありません。構造の異なる細菌が共通の因子によってMV形成を誘導していることは、従来の説を覆す、驚きの結果となりました。その一方で、細胞構造の違いによるMV形成過程の違いも確認されました。すなわち、グラム陰性細菌ではエンドリシンの作用で細胞が破裂してMVが形成されるのに対して、グラム陽性細菌では、細胞壁に空いた穴からシャボン玉のようにMVが形成されます。エンドリシンは多くの細菌が共通して持っているタンパク質なので、本研究により、なぜ多くの細菌がMVを生産するのかの解明につながると期待されます。
<今後の展開>
MVは細菌間の物質のやり取りにも関与しており、動物や植物に作用することも明らかとなっています。まだ発見されていない機能があることも考えられ、その潜在能力は未知数です。MVを形成する仕組みを明らかにすることで、どのような細菌がどのような環境でMVを形成するのかを推定できるようになります。これは、MVがヒトも含めた自然界にどれほどの影響を及ぼしているのかを把握していく上で役立ちます。また、MV形成因子を標的とした新たな応用微生物学の手法の開発につながることが期待されます。例えば、MVはワクチンとしてすでに国外で利用され始めていますが、本研究で得られた知見を応用することで、MVの大量生産が可能となります。最後に、医療において抗生物質耐性菌の出現は世界中で問題となっており、新薬の開発が進められています。エンドリシンは抗菌剤としての利用が長い間検討されてきましたが、抗生物質に代わる薬剤として再び注目が集まっています。本研究は、医療において、エンドリシンの細菌に対する作用をより正確に理解し、副次的効果を予測することにも貢献します。
<参考図>
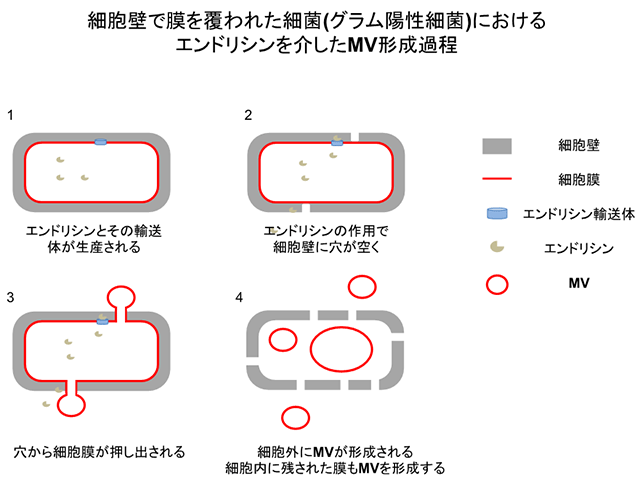
図1
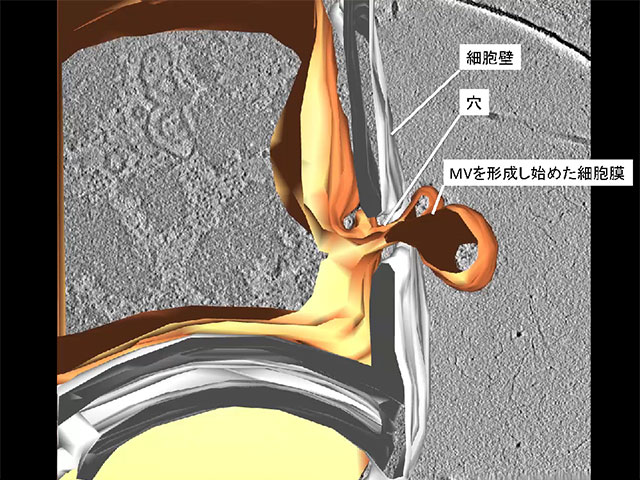
図2
枯草菌の細胞壁に穴が空いて、MVが形成されている様子の電子顕微鏡画像及び、 顕微鏡画像から構築された3次元モデル図の重ね合わせ画像。
<用語解説>
- 注1) グラム陽性細菌
- 細胞膜の外側を厚い細胞壁で覆われた細菌。これに対して、外膜を持つ細菌はグラム陰性細菌と呼ばれ、細胞構造の上では、細菌はこの2つのグループに大別される。枯草菌(Bacillus subtilis)はグラム陽性細菌の代表格として研究によく用いられ、そのグループの一種には、納豆菌(Bacillus subtilis var.natto)が存在する。他のグラム陽性細菌としては、乳酸菌や黄色ブドウ球菌などが挙げられる。
- 注2) メンブレンベシクル(MV)
- 多くの細菌が放出する、直径およそ20~400nmの球状の膜構造体。細菌間の相互作用のみならず、細菌と動植物間の相互作用にも関わることが明らかになってきている。
- 注3) エンドリシン
- 主にファージ(細菌に感染するウイルス)に由来する細胞壁分解酵素。ファージが細菌を破壊して外に出ていくために利用することがよく知られている。細菌を溶かすため、抗菌剤としても利用される。
<参考文献>
Turnbull et al.. Explosive cell lysis is a novel mechanism for the biogenesis of bacterial membrane vesicles and biofilm. NATURE COMMUNICATIONS 7,11220 (2016).
https://www.tsukuba.ac.jp/wp-content/uploads/20160414toyofuku1.pdf
<論文情報>
| タイトル |
“Prophage-triggered membrane vesicle formation through peptidoglycan damage in Bacillus subtilis”
(潜在型ファージによる細胞壁損傷を介した枯草菌のメンブレンベシクル誘導) |
| 著者名 |
Masanori Toyofuku, Gerardo Cárcamo-Oyarce, Tatsuya Yamamoto, Fabian Eisenstein, Chien-chi Hsiao, Masaharu Kurosawa, Karl Gademann, Martin Pilhofer, Nobuhiko Nomura, Leo Eberl. |
| doi |
10.1038/s41467-017-00492-w |
<お問い合わせ先>
<研究内容に関すること>
豊福 雅典(トヨフク マサノリ)
筑波大学 生命環境系 国際テニュアトラック助教(チューリッヒ大学 客員研究員兼任)
E-mail:
野村 暢彦(ノムラ ノブヒコ)
筑波大学 生命環境系 教授
Tel:029-853-6627
E-mail:
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
Tel:03-3512-3528
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: