ポイント
- 酵素の実用化には大量生産技術が必要だが、遺伝子組み換えで他の微生物や動植物の酵素を生産する場合、たんぱく質が沈殿して目的の酵素を生産できないことが多かった。
- 沈殿してしまうたんぱく質のアミノ酸配列の一部を、特定のアミノ酸に置き換えると、沈殿を形成せずに可溶性たんぱく質として合成でき、生産量が向上した。アミノ酸の置換部位と種類の関係性を見つけ、コンピューターの予測プログラムを開発した。
- 優れた機能や性質を持つにもかかわらず、大量生産が困難であった動植物由来の酵素の研究や特性解明、それらの産業利用の発展につながる。
JST 戦略的創造研究推進事業において、ERATO 浅野酵素活性分子プロジェクトの浅野 泰久 研究総括(富山県立大学 教授)、松井 大亮 グループリーダー(富山県立大学 助教)、中野 祥吾 研究員(静岡県立大学 助教)らは、沈殿して不溶化する酵素のアミノ酸配列の一部を別のアミノ酸に置き換えることで可溶化させ、目的の酵素を効率よく生産する方法を見いだしました。さらに置換部位をコンピューターで予測できるプログラムを開発しました。
優れた機能や性質を持つ酵素を実用化するには、大量生産技術が必要です。遺伝子組み換え技術が発展し、他の微生物や動植物由来の酵素の遺伝子を微生物に組み込むことで大量生産できるようになりました。しかし、合成されたたんぱく質は、酵素活性を持たない不溶性の沈殿物になる確率が高く、酵素の産業利用の拡大を阻んできました。
本研究グループでは、遺伝子配列に無作為に変異を加えるランダム変異導入法を用いて可溶化する変異体酵素注1)を多数作製し、不溶化した酵素を可溶化させるアミノ酸変異導入のデータを網羅的に集めました。その解析結果から不溶化の原因となっている構造情報を突き止めることに成功しました。さらに、不溶化した酵素のアミノ酸配列と類似している可溶性酵素とを比較して、アミノ酸の置換部位と種類を予測できるプログラムを作成しました。
本研究成果は、動植物由来の酵素を微生物で発現させる際にも有用であり、これまで生産が困難であった多くの酵素の特性解明注2)や、それらの産業利用につながると期待されています。本研究成果は、2017年8月25日(英国時間)に「Scientific Reports」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
浅野酵素活性分子プロジェクト |
| 研究総括 |
浅野 泰久(富山県立大学 生物工学研究センター 教授) |
| 研究期間 |
平成23年10月~平成29年3月 |
上記研究課題では、微生物のみならず、植物や動物などから高い酵素活性を持つ酵素分子を探索し、新規の有用物質生産法や健康診断法などを創出することを目標としています。
<研究の背景と経緯>
酵素は、生物の生命活動の源となる、あらゆる化学反応を促進する触媒として働くたんぱく質です。金属などを触媒に用いた物質生産では、高温や高圧の条件が必要であり、有害物質が排出されることが多くあります。しかし酵素は、生物が活動できる穏やかな温度やpHの環境で、特定あるいは類似の物質だけに作用することが大きな特徴です。従って、酵素を利用すれば、低コストで環境にやさしい有用物質生産が実現できます。これまでに実用化されている酵素の多くは細菌や酵母、カビなどの微生物由来であり、生育が速く、省スペースで培養生産されてきました。
一方で、動植物にも有用な酵素があり、いくつか実用化されていますが、まだ多くの有用な未知酵素が存在すると予想されます。例えば2015年に本研究グループは、医農薬の中間体を合成できる有用な酵素であるヒドロキシニトリルリアーゼ注3)をヤスデから発見しています。新しく発見した動植物由来の酵素を実用化するには、大量かつ安定した酵素の供給を可能にすることが必要です。そのためには、酵素のアミノ酸配列を特定して遺伝子を解明し、その遺伝子を微生物に組み込んで目的の酵素を作らせる「異種発現」という方法があります。この異種発現を実現させて初めて、産業利用への道が拓けます。
しかし、微生物にとっては、自分のものとは全く異なる種類のたんぱく質を作り出すことになるため、「異種発現」によって実際に機能する酵素を作らせるには、さまざまな問題が発生します。例えば合成された酵素が、酵素活性を持たない不溶性の沈殿物になることが高い割合で発生します(図1)。このような不溶化したたんぱく質を可溶化する方法として、これまでは宿主注4)の変更や宿主の培養条件の検討、遺伝子に無作為に変異を導入して可溶性の状態で発現する変異体を探索する方法(ランダム変異導入法)、他の可溶性たんぱく質に結合させて生産する方法などが行われていました。しかし、これらの方法は試行錯誤の手間が必要であり、時間がかかるため、より簡便な方法が望まれていました。
<研究の内容>
本研究グループは以前から、酵素のアミノ酸配列の一部を別のアミノ酸に置き換えることで、酵素の性質を変化させる「変異導入」を研究してきました。そして、沈殿する問題があった植物由来酵素のアミノ酸配列を変えると、機能する可溶性酵素の生産量が大幅に上昇することを発見しました(図2)。そこで、異種発現させた酵素が不溶性となる問題は、アミノ酸の配列の一部を変えれば解決できるのではないかと考えました。
遺伝子配列に無作為に変異を導入して、本来の酵素活性を維持しつつ可溶化する変異体を多数作製し、そのアミノ酸配列を解析することで、可溶化につながるアミノ酸変異のデータを網羅的に集めました。一般的に、酵素の立体構造を形成しているらせん状構造(αへリックス)の片側の領域が親水性で、もう片側の領域が疎水性というように、相反する性質から成る部分に区分けされていると、可溶化しやすいことが知られています。解析の結果、不溶化した酵素は、らせん状構造の親水性領域に疎水性アミノ酸が存在している、もしくは疎水性領域に親水性アミノ酸が存在していることを突き止め、これらのアミノ酸がたんぱく質の不溶化の要因になっていると推定できました。
そこで、類似酵素注5)のアミノ酸配列と比較し、特定の部位のアミノ酸を他のどのアミノ酸に置き換えれば可溶性酵素となるかを、アミノ酸配列から予測するプログラム(INTMSAlign:イントエムエスアライン)を編み出しました(図3)。実際に不溶化した酵素を上記の方法で改変し、大腸菌に発現させたところ、実験した酵素の約50パーセントを可溶性の状態で発現させることができました。
<今後の展開>
動植物由来の酵素を異種発現させた場合、約80~90パーセントが不溶化するといわれています。今回実験した酵素の半分を可溶性の状態で発現できたことは、従来の知見に比べかなり高い確率であり、本技術の有用性を示しています。またコンピューターでアミノ酸の置換部位と種類を、10分程度で予測することが可能なため、簡便性にも優れます。本技術により、これまで異種発現が困難であった多くの酵素の発現が可能となり、その特性の解明につながります。ひいては、高性能な酵素を見いだし、化学工業や医療など産業で広く利用されることに貢献すると期待されます。今後はさらに多くの酵素を用いて本技術の実用性を実証する研究を進める予定で、特許も出願中です。
<参考図>
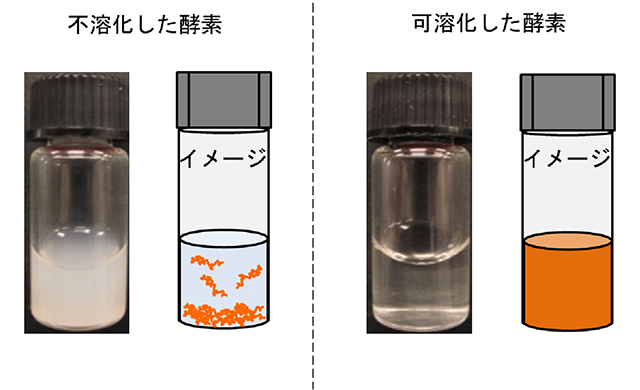
図1 不溶化した酵素と可溶化した酵素のイメージ
不溶化した酵素の状態では酵素活性を持たないため、可溶化する必要があります。
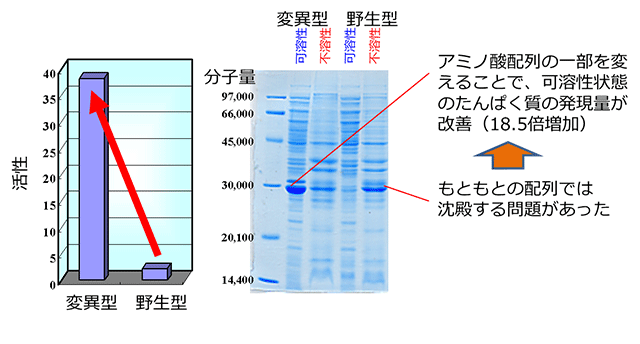
図2 植物由来酵素のアミノ酸配列の一部置換による可溶性発現の例
微生物で発現させると大部分が不溶化する植物由来酵素について、アミノ酸配列の一部を変えると可溶性の状態で大量生産できることを発見しました。生命科学、バイオテクノロジーの研究と実用化における重大障壁の1つである、遺伝子組み換え生物によるたんぱく質生産時の不溶性発現を抑制し、従来の遺伝子組み換え方法では生産できなかったたんぱく質の生産を可能とする技術のきっかけとなる研究です。
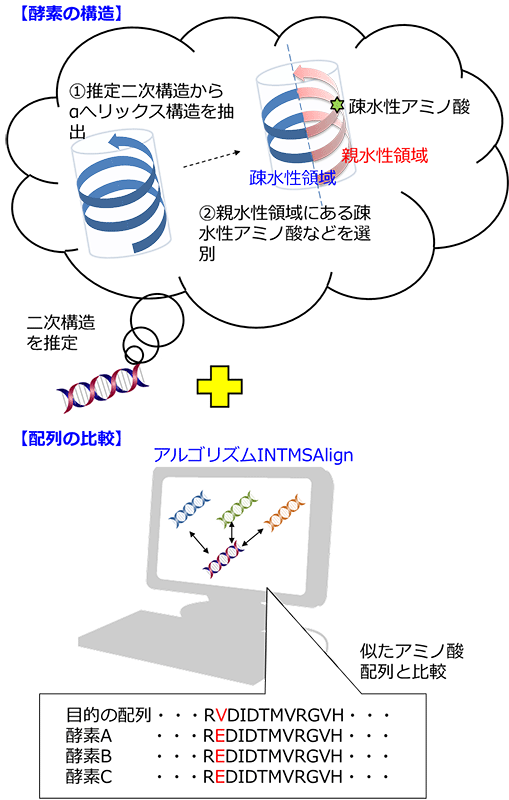
図3 可溶性発現技術
不溶化した酵素を調べたところ、らせん状構造の親水性領域に、可溶性の類似酵素では見られない疎水性アミノ酸が存在することが分かりました。この疎水性アミノ酸が要因でたんぱく質が不溶化すると推定されたため、その部位のアミノ酸配列を類似酵素でよく見られるアミノ酸に置換しました。例えば、疎水性のバリン(V)を親水性のあるグルタミン酸(E)に置換したところ、大腸菌で可溶性に発現しました。
<用語解説>
- 注1) 変異体酵素
- アミノ酸配列の内、一部のアミノ酸を別のアミノ酸に置換した酵素。機能や安定性が向上することもあり、酵素の特性解明や産業化に用いられる。
- 注2) 特性解明
- 酵素の機能に対する温度やpHの影響、酵素機能への金属などの影響、酵素が作用する化合物などを検討して酵素の性質を明らかにすること。
- 注3) ヒドロキシニトリルリアーゼ
- マンデロニトリルなどのシアノヒドリン化合物に作用し、アルデヒド化合物と青酸が生じる反応を触媒する酵素。青酸からシアノヒドリン化合物を合成する逆の反応も触媒することから、シアノヒドリン化合物の生産にも使用されている。これまでは、主に植物から見つかっており、2015年に本研究グループはヤスデから本酵素を発見した。
- 注4) 宿主
- 遺伝子組み換え実験において、目的とする遺伝子断片を細胞に導入するために連結する遺伝子をベクターと呼ぶ。そのベクターにより組み換え体が移入される細胞を宿主という。
- 注5) 類似酵素
- 機能や性質、構造が似ている酵素を示す。ここでは特にアミノ酸配列が似ている酵素のことを示している。
<論文タイトル>
“Rational identification of aggregation hotspots based on secondary structure and amino acid hydrophobicity”
(二次構造とアミノ酸残基の疎水性度に着目した不溶化に関与するホットスポットの合理的な特定方法)
doi: 10.1038/s41598-017-09749-2
<お問い合わせ先>
<研究に関すること>
浅野 泰久(アサノ ヤスヒサ)
ERATO 浅野酵素活性分子プロジェクト 研究総括
富山県立大学 生物工学研究センター 教授
〒939-0398 富山県射水市黒河5180
Tel:0766-56-7500 Fax:0766-56-2498
E-mail:
<JST事業に関すること>
古川 雅士(フルカワ マサシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
富山県立大学 教務課情報研究係
〒939-0398 富山県射水市黒河5180
Tel:0766-56-7500(内線229) Fax:0766-56-6182
E-mail: