ポイント
- これまで、どのように効率よく不良品たんぱく質中のジスルフィド結合を還元し、分解を促進するのか分かっていなかった。
- 一分子レベルでの観察により、ERdj5のC末端側クラスターの自由度が、誤って形成されたジスルフィド結合の還元に必要であることを明らかにした。
- 構造異常たんぱく質を速やかに分解するための還元経路に関する理解がさらに深まることが期待される。
JST 戦略的創造研究推進事業において、東北大学の稲葉 謙次 教授、熊本大学の小椋 光 教授、京都産業大学の永田 和宏 教授らのグループは、X線結晶構造解析注1)により、ジスルフィド結合注2)開裂酵素ERdj5のクラスターの配向が異なる2つの結晶構造を解明しました。
細胞内には、正常なたんぱく質の高次構造形成反応を促進する仕組みがある一方で、構造異常のたんぱく質を速やかに分解・除去するための巧妙な品質管理システムも存在します。Protein Disulfide Isomerase(PDI)ファミリーたんぱく質注3)の1つであるERdj5は、哺乳動物細胞の小胞体中で誤って形成されたジスルフィド結合を還元し、小胞体関連分解注4)と呼ばれる分解機構を促進させる役割を担っています。ERdj5の全体構造はそれぞれが複数のドメインから構成されている2つのクラスター(N末端側クラスターとC末端側クラスター)に分けることができます。両クラスターは、フレキシブルなリンカー領域注5)で連結されていることから、動きに富むことが示唆されていました。しかし、この動きがERdj5の機能発現にどう関わるか不明だったため、詳細な分子機構の解明が求められていました。
さらに高速原子間力顕微鏡注6)により、ERdj5のC末端側クラスターがダイナミックに動いている様子を一分子レベルで観察することに世界で初めて成功しました。さらに細胞を用いた実験により、ERdj5のC末端側クラスターの動きが、構造異常たんぱく質中のジスルフィド結合の還元および分解促進に重要な役割をもつことが強く示唆されました。
本研究の成果は、2017年5月4日(米国東部時間)に「Structure」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長) |
| 1)研究課題名 |
「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」 |
| 研究代表者 |
永田 和宏(京都産業大学 総合生命科学部 教授) |
| 研究期間 |
平成25年10月~平成31年3月 |
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライスサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、ERdj5を中心として、タンパク質恒常性(ホメオスタシス)・レドックス(酸化還元)恒常性・カルシウム恒常性の3つの主要な恒常性のクロストーク分子基盤を、静的(X線結晶構造解析)および動的(FRET解析)な構造解析によって解明します。
| 2)研究課題名 |
「ATP/GTP が駆動するタンパク質マシナリーの動的構造生命科学」 |
| 研究代表者 |
安藤 敏夫(金沢大学 理工研究域バイオAFM先端研究センター 特任教授) |
| 研究期間 |
平成25年10月~平成31年3月 |
上記研究課題では、ATP/GTPで駆動される多彩なタンパク質マシナリーが働いている現場を直に観る、時には分子を操作する新しい手法により、機能発現機序、複数のサブユニット間の協調メカニズムと作用、化学・力学エネルギー変換の本質の解明研究を推進し、新しい構造生命科学を開拓します。
<研究の背景>
小胞体は分泌たんぱく質や膜たんぱく質の合成の場であり、そこにはジスルフィド結合形成因子や分子シャペロン注7)など、高次構造形成反応を促進するさまざまな因子が存在しています。中でもジスルフィド結合の形成、組み換えは正しい高次構造を獲得するために非常に重要であると考えられています。一方で、ジスルフィド結合は誤ったシステイン間で形成されることもあります。そのような結合は、たんぱく質の構造異常を誘起するため、小胞体内にはジスルフィド結合の修復システムが備えられています。しかし、最終的に誤った構造をとってしまった不良品たんぱく質は、細胞の品質管理のため、小胞体関連分解によって分解されます。この時、誤ったジスルフィド結合はたんぱく質が分解されやすいように還元されます。ジスルフィド結合開裂酵素ERdj5は、小胞体中で生じた不良品たんぱく質のジスルフィド結合を切断することで構造を解きほぐし、サイトゾル注8)への逆輸送やプロテアソーム注9)による分解を促進する上で重要な役割を果たします。
これまでERdj5について、小胞体に存在するEDEM1注10)やBiP注11)などと協同してたんぱく質分解を促進すること、全体構造がN末端側クラスターとC末端側クラスターに分割されること、ジスルフィド結合開裂に関わる活性部位はC末端側クラスターに存在することなどが、本研究グループによって明らかにされました(Hagiwara et al., Mol.Cell 2011)。しかし、大きさやジスルフィド結合の数が多様な構造異常たんぱく質に対して、どのようにして効率よくジスルフィド結合を還元し、分解を促進するかはこれまで分かっていませんでした。
<研究の内容と成果>
研究グループでは、X線結晶構造解析という手法により、ERdj5がN末端側クラスターとC末端側クラスターの配向が大きく異なる、2つのコンフォメーションをとることを明らかにしました(図1)。さらに高速原子間力顕微鏡(高速AFM)という分子の動きを一分子レベルで観察する技術を用いることよって、ERdj5のC末端側クラスターがN末端側クラスターに対して高速に動いている様子を世界で初めて観察しました(図2)。このクラスターの動きを抑制したERdj5変異体を作製し、誤ったジスルフィド結合に対する還元活性と構造異常たんぱく質に対する分解促進活性について、野生型ERdj5と比較したところ、変異体ではこれら2つの活性がいずれも低下していることが分かりました。その結果、ERdj5変異体を発現した細胞中では、野生型ERdj5を発現した細胞中と比べ、より多くの構造異常たんぱく質が蓄積することが判明しました。
以上の結果から、ERdj5のC末端側クラスターの動きが、サイズやジスルフィド結合の数が異なるさまざまな不良品たんぱく質のジスルフィド結合を効率的に還元し、下流の因子BiPに受け渡すという一連のメカニズムで重要な役割をしていることが示されました(図3)。
<今後の展開>
ジスルフィド結合を切断するには還元力が必要ですが、ERdj5の還元力の源について、現在までに還元型のグルタチオンや新生ポリペプチド鎖中のシステインなどが候補に挙げられています。しかしながら、まだ具体的な解明には至っていません。これを解明できれば、構造異常たんぱく質を速やかに分解するための還元経路に関する理解がさらに深まることが期待されます。
パーキンソン病やアルツハイマー病など種々の神経変性疾患注12)は体内で不良品たんぱく質が過剰に蓄積することで引き起こされることが知られています。本研究で得られた知見は、神経変性疾患や2型糖尿病などに対する分子構造レベルでの原因解明につながる可能性があります。
<参考図>
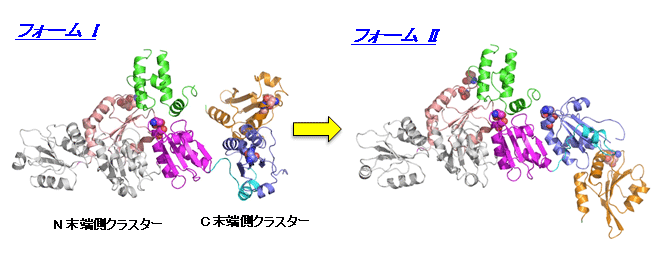
図1 ERdj5の2つのコンフォメーション
2011年に本研究グループが報告したオリジナルな構造(フォームI:左図)に比べ、新しい構造(フォームII:右図)はC末端側クラスターが約110度回転し、クラスターの配向が大きく異なる。
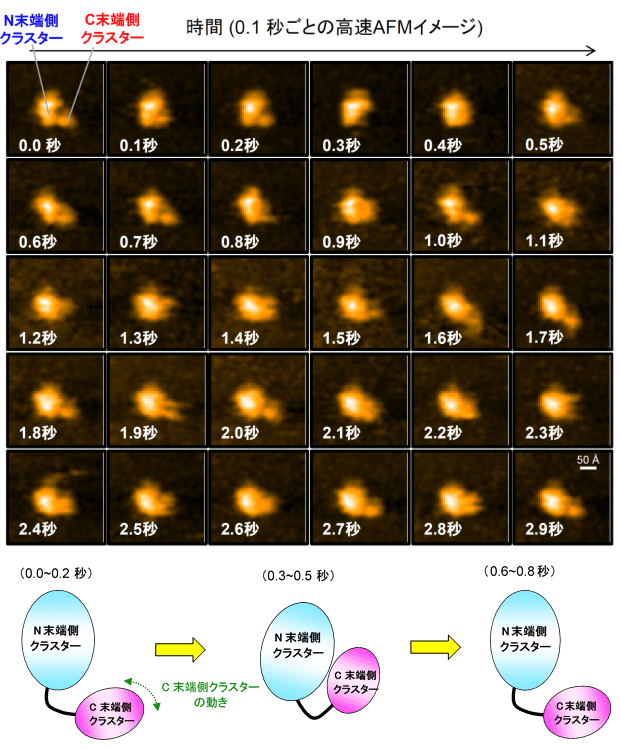
図2 高速原子間力顕微鏡(高速AFM)により観察したERdj5のクラスターの動き(上)とその経時変化の模式図(下)
C末端クラスターがN末端側クラスターに対し高速に動いている様子が観察される。0.0~0.2秒のイメージではC末端クラスターが開き、0.3~0.5秒のイメージではC末端クラスターが閉じ、0.6~0.8秒のイメージではC末端クラスターがまた開く様子を表している。
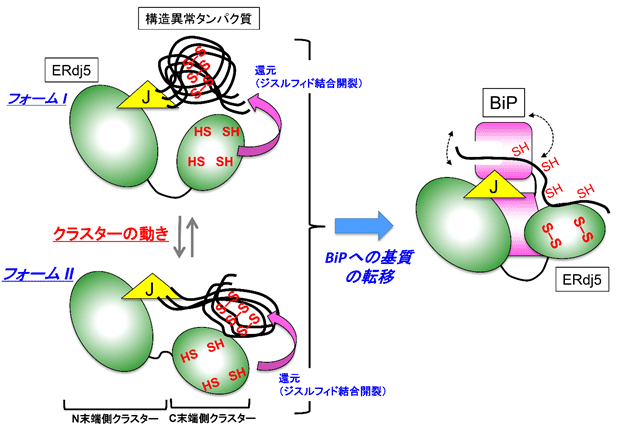
図3 ERdj5を介した構造異常たんぱく質の効率的なジスルフィド結合の開裂とBiPへの転移
ERdj5が促進する小胞体関連分解の経路において、まずERdj5のC末端側クラスターに存在する活性部位によって誤ったジスルフィド結合が還元される。その結果構造が解きほぐされた分解基質は分子シャペロンBiPへ受け渡され、その後サイトゾルに輸送される。この過程において、クラスターの動きにより、サイズやジスルフィド結合の数が異なるさまざまな分解基質の誤ったジスルフィド結合が効率よく還元され、速やかにBiPへ基質が受け渡されることが示された。
<用語解説>
- 注1) X線結晶構造解析
- 分子の構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折という現象が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
- 注2) ジスルフィド結合
- 近接する2つのシステイン上のチオール基(-SH)が酸化され、硫黄原子間で架橋される共有結合。
- 注3) Protein Disulfide Isomerase(PDI)ファミリーたんぱく質
- ジスルフィド結合の形成、組み換え、還元を担う小胞体中に存在する酵素群のこと。ヒト細胞の小胞体中では20種類以上のPDIファミリーたんぱく質が存在する。
- 注4) 小胞体関連分解
- 小胞体内腔中で生じた不良品たんぱく質がサイトゾル中に送り返され、ユビキチンプロテアソーム系によって分解される機構。小胞体の品質管理において不可欠な機構。
- 注5) リンカー領域
- たんぱく質分子中で、2つのドメインをつなぐ柔軟性に富んだ数個から数十個のアミノ酸からなる領域のこと。
- 注6) 高速原子間力顕微鏡
- 基板に固定した分子を、先が極めて細い針で触れながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに観測するナノテクノロジー。
- 注7) 分子シャペロン
- たんぱく質の折り畳み(フォールディング)を助ける総称。「シャペロン」とはフランス語で若い女性が社交界デビューする際、付き添う介添人の意味があり、成熟するのを助ける。
- 注8) サイトゾル
- 細胞内の細胞質から核やミトコンドリア、小胞体、ゴルジ体などの細胞小器官を除いた部分のこと。別称、細胞質ゾル。
- 注9) プロテアソーム
- サイトゾルと核内に存在し、異常たんぱく質を分解する巨大な酵素複合体のこと。細胞内のたんぱく質品質管理において中心的な役割を果たし、免疫応答やシグナル伝達などさまざまな機構に関わる。
- 注10) EDEM1
- 構造異常たんぱく質の糖鎖部分を認識し、小胞体関連分解を促進する因子として見つけられた。ERdj5と協同的にはたらく。
- 注11) BiP
- immunoglobulin heavy chain-binding proteinの略で、免疫グロブリンの重鎖と細胞内で結合するたんぱく質として単離されたことから命名された。小胞体に存在する代表的分子シャペロンの1つ。ERdj5と協同的にはたらく。
- 注12) 神経変性疾患
- 中枢神経の中の特定の神経細胞群が死ぬために発症する脳神経疾患の1つ。構造異常たんぱく質の蓄積や沈着が神経細胞群の死の要因の1つと考えられている。
<論文情報>
| タイトル |
“The highly dynamic nature of ERdj5 is key to efficient elimination of aberrant protein oligomers through ER-associated degradation”
(ERdj5の高い動的性質は小胞体関連分解を介した異常タンパク質オリゴマーの効率的な分解に重要である) |
| 著者名 |
Ken-ichi Maegawa, Satoshi Watanabe, Kentaro Noi, Masaki Okumura, Yuta Amagai, Michio Inoue, Ryo Ushioda, Kazuhiro Nagata, Teru Ogura, and Kenji Inaba |
| 掲載誌 |
Structure,USA |
| doi |
10.1016/j.str.2017.04.001 |
<お問い合わせ先>
<研究に関すること>
稲葉 謙次(イナバ ケンジ)
東北大学 多元物質科学研究所 教授
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel:022-217-5604
E-mail:
小椋 光(オグラ テル)
熊本大学 発生医学研究所 教授
〒860-0811 熊本県熊本市中央区本荘2丁目2−1
Tel: 096-373-6578
E-mail:
永田 和宏(ナガタ カズヒロ)
京都産業大学 総合生命科学部 教授/タンパク質動態研究所 所長
〒603-8555 京都府京都市北区上賀茂本山
Tel:075-705-3090
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
東北大学 多元物質科学研究所 広報情報室
伊藤 智恵(イトウ トモエ)
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5866
E-mail:
熊本大学 マーケティング推進部 広報戦略室
早川 和明(ハヤカワ カズアキ)
〒860-8555 熊本市中央区黒髪2丁目39番1号
Tel: 096-342-3122
E-mail:
京都産業大学 広報部
増村 尚人(マスムラ ナオト)
〒603-8555 京都市北区上賀茂本山
Tel: 075-705-1411
E-mail: