ポイント
- サル始原生殖細胞注1)は初期羊膜にて形成されることを発見。
- サル生殖細胞形成に重要なシグナル分子の発現分布を解明。
- サル始原生殖細胞の形成から前精原細胞分化に至るまでを包括的に動態解析。
- 形成初期から生殖巣に移動するまでのサル始原生殖細胞の網羅的遺伝子発現動態を解明。
京都大学 大学院医学研究科の斎藤 通紀 教授 [兼 科学技術振興機構(JST) ERATO斎藤全能性エピゲノムプロジェクト 研究総括、京都大学 物質-細胞統合システム拠点(iCeMS=アイセムス) 主任研究者、京都大学 iPS細胞研究所 研究員]と同研究科の佐々木 恒太郎 特定研究員らは、カニクイザル着床後胚を用いた研究で生殖細胞の起源が初期羊膜注2)に由来することを発見しました。
これまでマウスを用いた研究で、哺乳類の生殖細胞は胚体外胚葉(エピブラスト)注3)から誘導されることが知られてきました。この過程は哺乳類で共通と考えられてきましたが、哺乳類の初期発生機構には多様な部分もあり、霊長類で実際にどのように生殖細胞が形成されるかは不明でした。本研究では、カニクイザルを霊長類のモデルとして用いて生殖細胞の形成機構を解析しました。その結果、驚いたことに、カニクイザルでは、生殖細胞はエピブラストではなく、初期の羊膜から誘導されることがわかりました。また、ヒトiPS細胞注4)から誘導したヒト始原生殖細胞様細胞注5)は、カニクイザルの初期始原生殖細胞と類似することがわかりました。ヒトとカニクイザルではその初期発生機構が非常に良く似ていることから、ヒトでも生殖細胞は初期の羊膜から誘導されることが示唆されます。本研究は、霊長類における生殖細胞の形成機構を初めて明らかにすると同時に、ヒト多能性幹細胞から生殖細胞を誘導する研究の発展に重要な知見をもたらす研究です。
本研究成果は、JST 戦略的創造研究推進事業の一環として行われ、2016年10月6日正午(米国東部時間)に米国科学誌「Developmental Cell」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
「斎藤全能性エピゲノムプロジェクト」 |
| 研究総括 |
斎藤 通紀(京都大学 大学院医学研究科 教授) |
| 研究期間 |
平成23年度~平成28年度 |
<研究の背景>
生殖細胞とは精子や卵子に分化し、受精を通じて新しい個体を生み出し、遺伝情報を次世代に継承することができる細胞群を指します。生殖細胞がどのように形成されるかという問いは生命サイクルの永続性にかかわる本質的な問題であり、過去100年以上にわたって活発に議論がなされてきました。近年のマウスを用いた研究で、生殖細胞は胚体外外胚葉注6)から分泌されるBMP4タンパク質の刺激を受けることにより、エピブラストから誘導されることがわかってきました。しかし、哺乳類における初期発生機構は多様性に富んでおり、マウス初期胚でみられる一部の組織(例えば胚体外外胚葉)はヒトを含めた他の種では存在しないことが知られています。マウス以外の哺乳類における生殖細胞形成機構の解明は非常に遅れており、特に霊長類でどのように生殖細胞が形成されるかは技術的、倫理的な困難さから全くわかっていませんでした。
<研究手法と成果>
妊娠初期(胎齢2~3週)におけるヒト胚の解析は倫理的にきわめて困難であることから、本研究グループはカニクイザルを霊長類のモデルとして用いました。まず、技術的に単離が比較的容易なサルの胎児期の生殖巣(精巣・卵巣)を用いて免疫蛍光染色注7)を行い、生殖細胞に特異的に発現するマーカーを複数同定しました。次にそれらのマーカーを用いて、着床後間もない胚(胎齢11日)における生殖細胞の動態を解析しました。その結果、驚くべきことに、カニクイザルでは、生殖細胞はエピブラストではなく胎齢11日胚の初期の羊膜から誘導されることが判明しました(図1左、図2)。またこの際、羊膜自体が生殖細胞誘導因子であるBMP4遺伝子を強く発現しており、胚体外外胚葉由来のBMP4タンパク質に反応して誘導されるマウス生殖細胞とは異なるメカニズムでサル生殖細胞が形成されることがわかりました(図1右、図2)。さらに本研究グループは生殖細胞が形成後に羊膜から卵黄嚢内胚葉に移動し(胎齢11~17日)、そこから後腸注8)を経て生殖巣に移動(胎齢36日)するまで、さらにオスについてはその後、前精原細胞注9)に分化する(胎齢100日)までの包括的な始原生殖細胞の動態を詳細に追跡することに初めて成功しました。さらに、これらの生殖細胞の遺伝子発現を単一細胞遺伝子発現解析法注10)にて網羅的に解析することで、初期、及び後期の始原生殖細胞を特徴づける遺伝子セットの同定に成功しました。これらの遺伝子発現をヒトiPS細胞から試験管内誘導したヒト始原生殖細胞様細胞(hPGCLCs)と比較することで、hPGCLCsはカニクイザルの初期始原生殖細胞と類似することが明らかになりました(図3)。ヒトとカニクイザルではその初期発生機構が非常に類似していることから、ヒトでも生殖細胞は初期の羊膜から誘導されることが示唆されます。
<波及効果、今後の予定>
本研究は、霊長類における生殖細胞の形成機構を初めて明らかにすると同時に、過去半世紀以上にわたってブラックボックスであった霊長類の初期発生機構の一端に切り込んだきわめて革新的な研究です。また、本研究で得られた生殖細胞形成に関する知見はヒト多能性幹細胞から人工的に生殖細胞を誘導する際の重要な基盤となると考えられます。
<参考図>
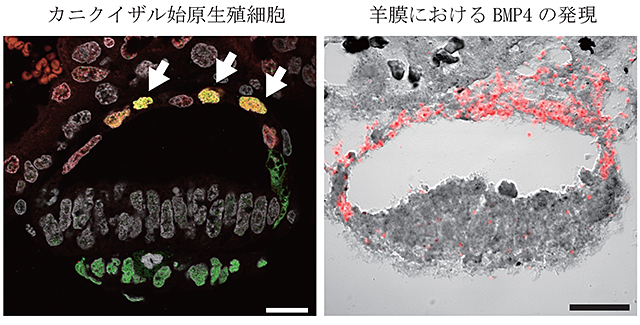
図1 初期羊膜に形成された始原生殖細胞
カニクイザル胎齢11日胚における形成された直後の始原生殖細胞(図左、矢印)。生殖細胞マーカーであるTFAP2C(赤い蛍光)とSOX17(緑の蛍光)を両方発現する始原生殖細胞(黄色の蛍光、図左、矢印)が羊膜に分布している。羊膜は始原生殖細胞誘導因子であるBMP4遺伝子を強く発現している(図右、赤い蛍光)。スケールバーは20μm。
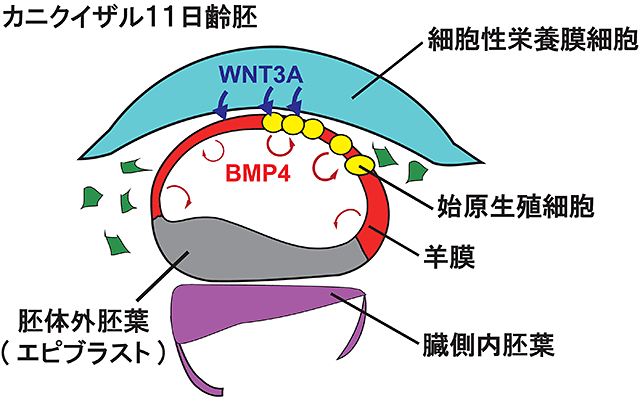
図2 始原生殖細胞形成のモデル図
対齢11日胚において、羊膜はBMP4遺伝子を発現し、またWNT3A遺伝子を発現する細胞性栄養膜細胞注11)と近接していることから、これらの因子が羊膜における始原生殖細胞形成に重要な役割を担っている可能性が示唆される。
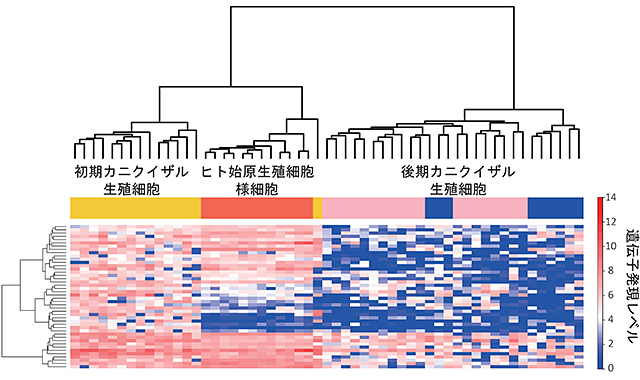
図3 カニクイザルの初期(胎齢13~20日胚由来)及び
後期(胎齢36~55日の胎児生殖巣由来)生殖細胞と
ヒト始原生殖細胞様細胞の遺伝子発現の比較
試験管内でヒトiPS細胞から誘導したヒト始原生殖細胞様細胞はカニクイザルにおける初期の生殖細胞に近い遺伝子発現パターンを有している。
<用語解説>
- 注1) 始原生殖細胞
- 精子及び卵子の源となる細胞。マウスにおいては胚齢6.5日前後にBMP4タンパク質の作用を受けてエピブラストから分化する。その後、生殖巣へ移動し、生殖巣内の体細胞からのシグナルを受け、精子、もしくは卵子へ分化していく。霊長類において、始原生殖細胞がいつ、どのように形成されるかは全くわかっていない。
- 注2) 羊膜
- 胎児と羊水を包む胚膜の最も内層を構成する膜。マウスにおいては三胚葉形成(エピブラストから中胚葉や内胚葉が発生する現象)に伴って胎齢7日頃よりエピブラストより形成される。カニクイザルにおいてはマウスと異なり、三胚葉形成より前の着床後間もない時期(胎齢10日)にエピブラスト中央部に空洞が形成されることによりエピブラストより分離し、エピブラストの背側に形成される。
- 注3) 胚体外胚葉(エピブラスト)
- 胚体外胚葉(エピブラスト)とは胚盤胞の内部細胞塊に由来する多能性上皮細胞であり、すべての体細胞や羊膜の源となる。マウスにおいて、生殖細胞は近位胚体外胚葉より直接的に分化する。
- 注4) iPS細胞
- 人工多能性幹細胞(induced Pluripotent Stem Cells)のこと。体細胞に数種類の遺伝子を導入することにより作製される。ES細胞と同様に自己複製しつつ、生殖細胞を含めた、体を構成するほぼすべての細胞に分化することができる。
- 注5) 始原生殖細胞様細胞
- iPS細胞やES細胞から特定の成長因子や薬物によって人工的に誘導される生殖細胞に似た細胞。マウスにおいては、胎児の始原生殖細胞に遺伝子発現は酷似しており、マウスの精巣や卵巣に移植することで実際に精子や卵子に分化することが知られている。本研究グループの最近の研究で、サルやヒトの胎児期の生殖細胞に遺伝子発現パターンにおいて類似する細胞が、ヒトiPS細胞からも誘導可能であることがわかっている。
- 注6) 胚体外外胚葉
- マウス着床後胚においてエピブラストに隣接して存在する将来胎盤へと分化する組織。BMP4タンパク質を分泌し、隣接するエピブラストから生殖細胞を形成させる重要な役割を担っている。
- 注7) 免疫蛍光染色
- 細胞や組織におけるタンパク質を検出するために用いられる手法。固定した細胞や組織に検出したいタンパク質に特異的に結合する抗体を反応させ、さらにその抗体を認識する抗体に蛍光色素でラベルしておくことで、蛍光を顕微鏡下で観察し、タンパク質の発現の局在を検出できる。
- 注8) 後腸
- 胎児のより遠位部(肛門側)に位置する腸管で、将来、下行結腸~直腸になる部位。胎齢4週における胚の内側への折れ込みに伴って、卵黄嚢内胚葉の一部が胚内部に取り込まれることにより形成される。この際、卵黄嚢内胚葉後部に存在する始原生殖細胞も同時に後腸へと(おそらく受動的に)移動すると考えられる。
- 注9) 前精原細胞
- オスの胎児精巣において、周囲の体細胞から刺激を受け、始原生殖細胞より分化する細胞群。この間、始原生殖細胞は分裂を停止し、将来精子を形成するために必要なゲノム修飾を行う。出生後にこれらの細胞は精原幹細胞へとさらに分化し、自己複製しつつ精子を形成する。
- 注10) 単一細胞遺伝子発現解析法
- 1細胞由来の転写産物を増幅し、発現している遺伝子をマイクロアレイや次世代シークエンサーを用いて全ゲノムレベルで解析する手法。従来の全遺伝子発現解析では数十万個以上の細胞数が必要であったが、近年の目覚ましい技術発展により単一細胞においても全遺伝子レベルで解析可能になった。
- 注11) 細胞性栄養膜細胞
- ヒトやサルにおいて、将来胎盤の一部を構成する胎児由来の細胞。母体―胎児間の栄養交換や受精卵の着床において重要な役割を果たすと考えられている。
<論文情報>
“The Germ Cell Fate of Cynomolgus Monkeys Is Specified in the Nascent Amnion”
(カニクイザル生殖細胞は初期羊膜で形成される)
佐々木 恒太郎、中村 友紀、岡本 郁弘、薮田 幸宏、岩谷 千鶴、土屋 英明、清田 弥寿成、中村 紳一朗、白木 直人、高桑 徹也、山本 拓也、斎藤 通紀
doi :10.1016/j.devcel.2016.09.007
<お問い合わせ先>
<研究に関すること>
斎藤 通紀(サイトウ ミチノリ)
京都大学 大学院医学研究科 生体構造医学講座(機能微細形態学) 教授
Tel:075-753-4335(直通) Fax:075-751-7286
E-mail:
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
京都大学 企画・情報部広報課 国際広報室
Tel:075-753-5727 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: