ポイント
- EGFの拡散とNotchによる側方抑制を組み合わせることによってProneuralWaveの数理モデルを構築し、数理科学と生命科学の異分野融合研究を可能にしました。
- Notchによる側方抑制はEGFの拡散作用と組み合わさることで、波の進行速度を制御するという新しい機能を果たすことを明らかにしました。
- Notchによる波の伝播速度の制御とゴマシオパターン形成は異なるメカニズムによって制御されていることを明らかにしました。
金沢大学 新学術創成研究機構の佐藤 純 教授、北海道大学 電子科学研究所の長山 雅晴 教授、九州大学 大学院医学研究院の三浦 岳 教授らの共同研究グループは、脳の形成過程において長距離性の情報伝達因子であるEGF注1)と短距離性の情報伝達因子Notch注2)の協調作用に注目し、数理モデリングを活用したコンピューターシミュレーションの結果を実験的に検証することによって、Notchの働きがEGF存在下では大きく変化することを見出しました。
細胞と細胞が情報のやりとりをする時、長距離性の情報伝達は拡散性のタンパク質によって、短距離性の情報伝達は細胞膜上のタンパク質によって隣接する細胞に伝達されます。EGFは長距離性の、Notchは短距離性の情報伝達を担う中心的な因子として知られています。しかし、この両者が協調して働いた時にどのような効果を示すのか、通常の生命科学実験によって調べることは困難であり、ほとんど理解が進んでいませんでした。
今回、EGFとNotchの協調作用を調べるにあたり、ショウジョウバエ脳の神経幹細胞注3)形成過程において見られるProneuralWaveと呼ばれる「分化の波注4)」に注目しました。類似した分化の波はほかの生物においても存在します。Notchの短距離作用が働いた場合、一般的にはいわゆるゴマシオパターン(図1)を形成しますが、ProneuralWaveにおいてそのようなパターンは見られません。そこで、数理モデルに基づいたコンピューターシミュレーションを行ったところ、EGFの産生を減少させるとゴマシオパターンが現れることが予測されました。実際にEGFの産生量を減少させたところ、脳において明らかなゴマシオパターンが現れたことから、ProneuralWaveにはNotchによる短距離性作用が確かに組み込まれており、EGFとの協調作用によって波の伝播速度を制御するという新たな役割を果たすことが明らかとなりました。EGFとNotchの協調作用は大脳皮質の形成過程における神経幹細胞の分化や、肺がん・乳がんの発症過程においても重要な役割を果たしていると考えられることから、本研究によって明らかとなった遺伝子ネットワークの動作機構、およびその正確なシミュレーションを実現する数理モデルは今後それらのさまざまな生命現象の研究に対しても応用できると期待されます。
本研究成果は、米国科学誌Proceedings of the National Academy of Sciencesのオンライン版で2016年8月15-19日の週に掲載される予定です。
なお、本成果は、科学技術振興機構(JST) CREST「生命現象における時空間パターンを支配する普遍的数理モデル導出に向けた数学理論の構築」(研究代表者:栄 伸一郎)、JST さきがけ、科学研究費補助金、物質・デバイス領域共同研究拠点、積水化学「自然に学ぶものづくり」、旭硝子財団などの援助によって得られました。
<研究の背景>
細胞と細胞が情報のやりとりをする時、長距離性の情報伝達は拡散性のタンパク質によって、短距離性の情報伝達は細胞膜上のタンパク質によって隣接する細胞に伝達されます。EGFは長距離性の、Notchは短距離性の情報伝達を担う中心的な因子として知られています。Notchの短距離作用は側方抑制注5)と呼ばれ、例えば図1aにおいて四角い細胞が丸い細胞に変化(分化)する時、丸い細胞は隣り合う細胞に対して抑制性のシグナルを送り、それによって丸い細胞の隣りには必ず四角い細胞が存在するようなゴマシオパターンを形成します。一方EGFは拡散性因子であり、産生された領域から離れた場所において長距離作用を及ぼします(図1b)。NotchとEGFはどちらもさまざまな生命現象において重要な役割を果たしますが、Notchによる側方抑制とEGFの拡散効果が協調して働いた時にどのような効果をもたらすのか、明らかにされていませんでした。
本研究ではこのような協調作用の働きを研究するためにショウジョウバエの脳において見られるProneuralWaveという現象に着目しました。形成過程のハエの脳においてはまず四角い上皮細胞のみが存在していますが、これが1列ずつ順番に丸い神経幹細胞に変化します(図1c)。このような「分化の波」ProneuralWaveの進行はEGFによって促進され、Notchによって抑制されることが知られていました。類似した分化の波はほかのさまざまな生物においても存在することが知られています。
Notchによる側方抑制はあらゆる動物において見られる現象であり、ProneuralWaveにおいてもNotchが側方抑制を引き起こすための条件は揃っています。Notchによる側方抑制が働けば図1aのようなゴマシオパターンが生じるはずですが、実際にはProneuralWaveにおいてはそのようなパターンは見られません(図1c)。果たしてNotchは側方抑制を引き起こしているのでしょうか?もしそうだとすれば、なぜNotchはゴマシオパターンを形成せずに波の進行を制御できるのでしょうか?
通常の生命科学実験のみではこのような疑問に答えることはできません。そこで、本研究ではNotchとEGFによるProneuralWaveの制御についての数理モデルを構築しコンピューターシミュレーションと生命科学実験を組み合わせることによってNotchとEGFによる遺伝子ネットワークの働きを明らかにしました(図1d)。
<研究成果の概要>
我々はまずProneuralWaveがNotchによる側方抑制を含んでいると仮定し、EGFの拡散とNotchによる側方抑制を組み合わせたProneuralWaveの数理モデルを構築しました。興味深いことに、この数理モデルは生体内で見られるProneuralWaveと非常に近い挙動を示しました(図2a、c)。つまり、通常はゴマシオパターンを示さずに分化の波が進行する上、EGFの活性をなくしたEGF変異体においては波が消失し、Notchの活性をなくしたNotch変異体では波の進行が加速するなど、さまざまな変異体の状況も的確に再現したのです。EGFの拡散とNotchの側方抑制だけでProneuralWaveの挙動を全く矛盾無く説明できたと言えます。
では、ゴマシオパターンは一体どこに行ってしまったのでしょうか?EGFは拡散性因子であり、Notchがゴマシオ状に活性化していたとしても、EGFの拡散効果によってそれが隠されてしまう可能性が考えられました。そこでシミュレーション上でEGFの拡散もしくは産生量を減少させたところ、そのような状況下ではゴマシオパターンが現れることが予測されました(図2b)。EGFの活性が完全に無くなってしまうとそもそも波が消失してしまうため、我々はRNAiと呼ばれる技術によってEGFの活性を中程度に減少させることを試みました。その結果、Notchの活性および神経幹細胞の形成パターンがゴマシオ状に変化し、生体内においてもシミュレーション上と、同じような互い違いのパターンが観察されました(図2d)。これらの結果から我々の数理モデルが正しいこと、そしてNotchによる側方抑制が確かに生体内においてProneuralWaveに含まれていることが示されました。
私たちはこの数理モデルを用いてさらにもう1つの問題を解決しようと試みました。Notchの活性が失われたNotch変異領域では波の進行が加速しますが、この時EGFの活性が失われることが知られていました。EGFは波の進行において必須な因子であり、EGFが失われると波も失われるはずです。Notch変異領域ではEGFが失われているにもかかわらずなぜ波が消失せずにむしろ加速するのか、これまでの研究において解決されていない疑問点でした。
私たちは上記の数理モデルにおいてNotch変異領域を設定し(図3a点線内)、どのようなことが起きているか観察しました。興味深いことに、Notch変異領域において波が加速する際、一過的にEGFが活性上昇し、その後減衰することが分かりました。Notch自体は神経幹細胞の形成を阻害するので、EGFが活性化し、かつNotchが失われた状況では神経幹細胞の形成は加速するはずであり、これがNotch変異領域において波の進行が加速する原因であると考えられました。これと同じことが生体内でも起きているか調べたところ、シミュレーションと同様、EGFの活性が一過的に上昇していることが確認されました(図3b)。このように、数理モデルを用いることによって従来の生命科学実験だけでは解決できない問題が解決されたのです。
<研究成果の意義>
生命科学と数理科学の融合研究は世界的な潮流となっていますが、生命科学実験とシミュレーションを1対1に対応させて研究を推進する真の異分野融合研究はいまだ困難です。本研究では実際の生命現象に合致した数理モデルを構築し、その正しさを実験によって検証しました。さらに、EGFの減弱によってゴマシオパターンを再現する、Notch変異領域において波が消失せずにむしろ加速するメカニズムを明らかにするなど、数理モデルによる予測を実験的に検証することにより、NotchとEGFの協調作用のメカニズムを明らかにしました。
EGFとNotchの協調作用は哺乳類大脳皮質の形成過程における神経幹細胞の分化、肺がん・乳がんの発症過程においても重要な役割を果たしていると考えられています。本研究によって明らかとなった遺伝子ネットワークの動作機構、およびその正確なシミュレーションを実現する数理モデルはヒトの脳の形成機構の解明、がんの進行をコントロールする技術の創出など、従来の生命科学研究だけでは解決できないような複雑な問題の解明に役立つと期待されます。
<参考図>
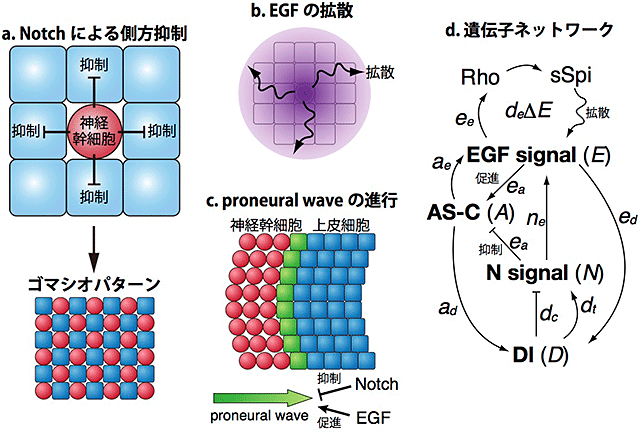
図1
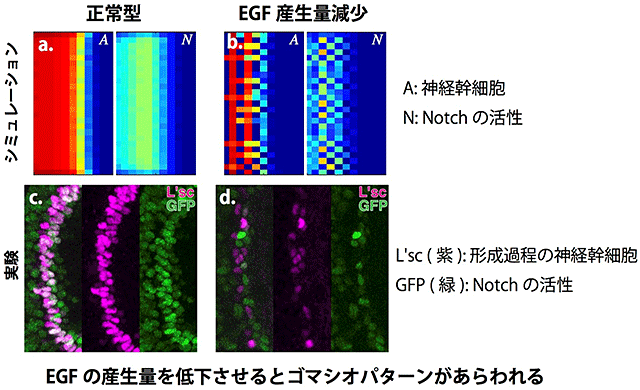
図2
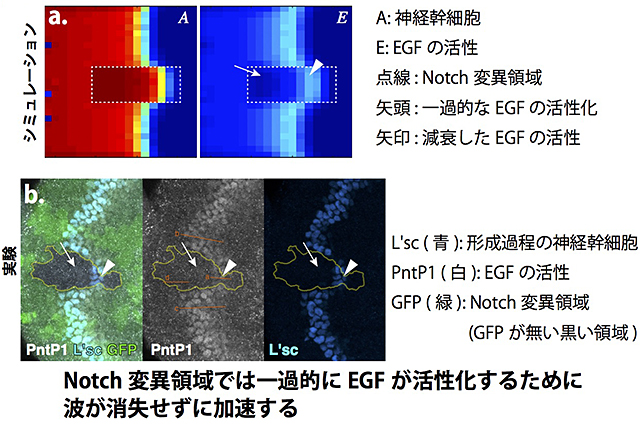
図3
<用語解説>
- 注1) EGF(上皮成長因子)
- 分泌性・拡散性のタンパク質で、産生された領域から離れた場所においてさまざまな作用を及ぼす。
- 注2) Notch
- 側方抑制のシグナルを受け取る受容体(タンパク質)であり、分化細胞に隣接する細胞の分化を抑制する効果を持つ。
- 注3) 神経幹細胞
- 脳において多数の神経細胞を生み出す特殊な細胞で、上皮細胞から分化する。
- 注4) 分化の波
- 細胞が何らかの特徴的な性質を獲得する過程を「分化」という。神経幹細胞は上皮細胞から分化するが、平面上に配置された上皮細胞があたかも波が伝播するように一列ずつ順番に分化するため「分化の波」と呼ばれる。
- 注5) 側方抑制
- 分化しつつある細胞が隣接する細胞に抑制性のシグナルを送り、分化した細胞の数および配置を制御する現象で、多くの場合Notchによって制御される。
<論文情報>
| タイトル |
“Notch-mediated lateral inhibition regulates proneural wave propagation when combined with EGF-mediated reaction diffusion”
(Notchによる側方抑制はEGFによる反応拡散と協調してプロニューラルウェーブの進行を制御する) |
| 著者名 |
Makoto Sato, Tetsuo Yasugi, Yoshiaki Minami, Takashi Miura and Masaharu Nagayama
(佐藤 純、八杉 徹雄、南 佳晃、三浦 岳、長山 雅晴) |
| 掲載誌 |
Proceedings of the National Academy of Sciences |
| doi |
10.1073/pnas.1602739113 |
<お問い合わせ先>
<研究に関すること>
佐藤 純(サトウ マコト)
金沢大学 新学術創成研究機構 革新的統合バイオ研究コア 数理神経科学ユニット 教授
Tel:076-265-2843(直通) Fax:076-234-4239
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)
科学技術振興機構 戦略研究推進部 ICTグループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3526 Fax:03-3222-2066
E-mail:
<報道担当>
金沢大学 総務部 広報室 戦略企画係
桶作 彩華
Tel:076-264-5024
E-mail:
金沢大学 研究推進部 研究推進課 機構支援係
高田 将史
Tel:076-264-6186
E-mail:
北海道大学 総務企画部 広報課
Tel:011-706-2610
E-mail:
九州大学 広報室
Tel:092-802-2130
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: