ポイント
- タンパク質に蛍光の目印をつける手法により、受容体の構造を把握することなく薬剤探索が可能に
- 開発した探索手法を用いて新規の薬剤候補2種を発見
- 向精神薬だけではなく、細胞膜受容体をターゲットとした他の薬剤探索へと応用できる
京都大学 大学院工学研究科の浜地 格 教授らは、γ-アミノ酪酸(以下、GABA)注1)を識別し情報を伝達するタンパク質GABAA受容体を蛍光センサーに改変し、特定の受容体に作用する薬剤を探索する新たな手法を開発しました。
GABAA受容体は抗うつ剤や抗不安薬といった向精神薬の標的であり、創薬標的として注目を集めています。これまでに開発されたGABAA受容体へ選択的に作用する薬剤の多くは偶然発見されたものでした。その主な要因は、GABAA受容体の構造が複雑であり十分に把握した上での合理的な薬剤設計が難しいこと、多種多様な化合物を効率的に探索する方法論の確立が困難だったことの2点です。
我々は、独自に開発した、タンパク質の狙った部位に蛍光の目印をつける手法を使い、その蛍光強度の変化を手がかりに、タンパク質に結合する新たな薬剤を探索する手法を開発しました。また、本手法を用いることで、1280種類に及ぶ化合物の中から新たなアロステリック作用薬注2)を見いだすことにも成功しました。現在用いられている向精神薬は依存性や眠気などの副作用が問題となっていますが、本手法を用いて新たな候補物質を見つけることで、副作用のない創薬開発につながることが期待されます。
なお本研究成果は、福岡大学 医学部 沼田 朋大 講師、井上 隆司 教授との共同研究の成果であり、JST 戦略的創造研究推進事業として行われました。論文は2016年8月16日午前0時(日本時間)に英国科学雑誌Nature Chemical Biologyのオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
<研究の背景>
GABAを認識して情報を伝達するGABAA受容体は神経伝達の制御において必要不可欠なものであり、その異常が不安障害や睡眠障害、うつ病や統合失調症などの多くの精神疾患に深く関係していることがわかっています。このことから、GABAA受容体は向精神薬の創薬標的として着目されています。実際に、GABAA受容体作用薬の臨床応用も報告されています。
しかしながら、現在用いられている薬剤は複数種類のGABAA受容体に作用してしまうことによる副作用の問題が指摘されており、特定のGABAA受容体にしか作用しない薬剤の開発が求められてきました。新規薬剤の開発では、受容体の構造を基にした創薬探索法が用いられます。GABAA受容体の場合は複数のタンパク質からなる複合体を形成するという構造の複雑さから、創薬探索法の構築自体が困難な状況でした。
<研究手法・成果>
(1)GABAA受容体の2つの薬剤結合部位の蛍光センサー化
GABAA受容体は前述の通り、複数のタンパク質が複合体を形成することで機能します。複合体を形成したGABAA受容体には、GABA結合部位やベンゾジアゼピン注3)結合部位など多くの薬剤結合部位が存在します(図1a)。本研究では、GABAA受容体の薬剤結合部位を蛍光センサー化することで、創薬探索法を構築できると考えました。具体的には、著者らが独自に開発した特定のタンパク質に蛍光の目印をつけられる手法を用いて、GABAA受容体の薬剤結合部位であるGABA結合部位、ベンゾジアゼピン結合部位に対する蛍光センサー化を行いました。図1bには、ベンゾジアゼピン結合部位に対する蛍光センサー化の結果を示します。この場合は、ベンゾジアゼピン結合部位に対するラベル化剤と呼ばれる有機化合物を細胞にふりかけることで、GABAA受容体のベンゾジアゼピン結合部位のみに蛍光色素を修飾することに成功しました(ステップ1)。続いて目印の蛍光を弱くする薬剤(以下、消光剤)を加えることで、Förster共鳴エネルギー移動(FRET)機構注4)により、その蛍光は弱められました(ステップ2)。その状態において、ベンゾジアゼピン結合部位に作用する薬剤を添加すると、消光剤が追い出されて蛍光回復が見られました(ステップ3)。次に、各種GABAA受容体作用薬を加えた際の蛍光変化を評価したところ、ベンゾジアゼピン結合部位に結合する作用薬を加えた際にのみ、その作用薬の親和性に対応した蛍光変化を示しました。このことから、蛍光回復を手がかりに、結合部位に親和性を持つ薬剤を探索できる可能性が示されました。GABA結合部位を標的とした蛍光センサー構築においても、同様の結果が得られています。すなわちベンゾジアゼピン結合部位およびGABA結合部位に対する作用薬の蛍光センサーを構築できたことを意味します。
(2)広範囲な薬剤探索による新たなアロステリック作用薬の発見
次に、本研究で開発したベンゾジアゼピン結合部位の蛍光センサーを創薬探索法へと展開しました(図2)。我々のセンサーを用いて1280個の化合物群から蛍光回復を手がかりに作用薬の探索を行った結果、4つの化合物が候補に残りました。その中の2つの化合物は、GABAA受容体に作用することが既に知られていましたが、残りの2つの化合物(4,4',4''-(4-propyl-[1H]-pyrazole-1,3,5-triyl)trisphenol (PPT)および4,5,6,7-tetrabromo-2-azabenzimidazole(TBB))に関しては、GABAA受容体に作用することが報告されていない新たなGABAA受容体の作用薬でした。
さらに、PPTとTBBに関して、GABAA受容体に対する作用を詳細に調べてみたところ、これらの化合物が確かにGABAA受容体の活性を阻害すること、既存の作用薬とは異なる仕組みで活性を阻害していることが明らかになりました。すなわち、PPTおよびTBBが新たなタイプのGABAA受容体作用薬であることを意味します。
(3)それぞれのGABAA受容体に対して選択的な作用薬の蛍光センサーを構築できる
脳などの中枢神経系に発現しているGABAA受容体には、鎮静、不安、認識などそれぞれの生理機能に関与する複数種類のGABAA受容体の存在が知られています。しかし、GABAA受容体を標的とした既存の向精神薬のほとんどが複数種類のGABAA受容体に対して作用してしまうため、記憶障害や作用の持ち越しといった副作用が問題となっています。そこで、特定の種類のGABAA受容体のみに作用する化合物の同定を目指して、蛍光センサー構築の拡張を行いました。具体的には、鎮静に関わるGABAA受容体、不安に関わるGABAA受容体、認知に関わるGABAA受容体に対して、それぞれの受容体を蛍光センサー化することに成功しました。今回行った実験をこれらの受容体に対しても行うことにより、選択的な作用薬の広範囲な探索へと展開できると考えられます。
<今後の予定>
本発表で報告したGABAA受容体作用薬に対する蛍光センサーの構築は、副作用のないGABAA受容体作用薬の開発につながると期待されます。また、本研究で見いだした2つのGABAA受容体作用薬(PPTおよびTBB)は、今後新たな向精神薬候補になると期待されます。加えて本研究手法は、構造情報が不十分で合理的な薬剤設計が難しかった他の細胞膜受容体を標的とした薬剤探索においても幅広く応用できると期待されます。
<参考図>
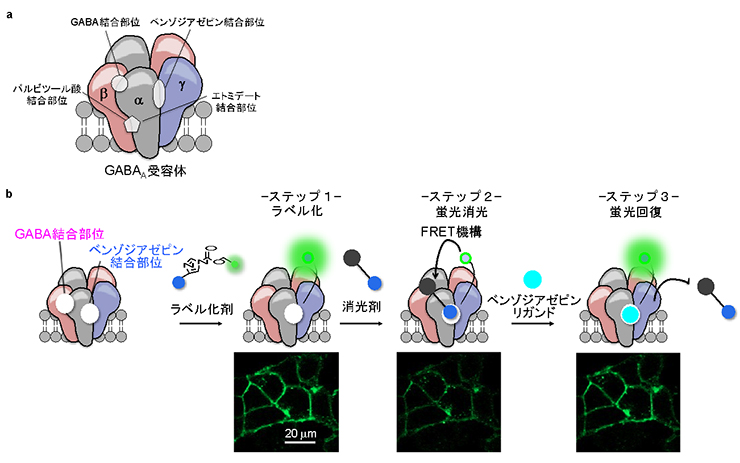
図1 GABAA受容体の薬剤結合部位の蛍光センサー化
- a:GABAA受容体の構造とその薬剤結合部位。GABAA受容体には抗うつ剤、抗不安薬、麻酔薬、睡眠薬など様々な薬剤が結合する。
- b:ベンゾジアゼピン結合部位の蛍光センサー化および共焦点顕微鏡観察結果。1.ラベル化剤添加によって薬剤結合部位に目印(蛍光団、綠丸)をつける。2.消光剤添加によって目印の蛍光を弱められる。3.ベンゾジアゼピン結合部位に作用する薬剤(ベンゾジアゼピンリガンド)の添加によって消光剤が追い出され、目印の蛍光が回復する。
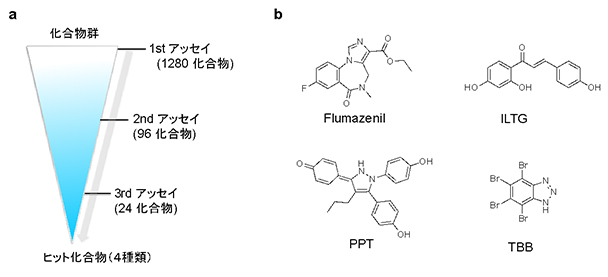
図2 広範囲な創薬探索とそのヒット化合物
- a:広範囲な創薬探索法の模式図。
- b:広範囲な創薬探索で得られたヒット化合物の構造。Flumazenil、ILTGはGABAA受容体に作用することが知られていたが、PPT、TBBがGABAA受容体に作用することは今まで知られていなかった。
<用語解説>
- 注1) γ-アミノ酪酸、GABA
- 脳などの中枢神経で機能する主要な抑制性の神経伝達物質。
- 注2) アロステリック作用薬
- あるタンパク質に本来結合する分子とは異なる場所に結合し、タンパク質の機能を変化させる薬剤のこと。アロステリック部位はそれぞれのタンパク質において固有であるため、選択性が高く副作用の少ない薬剤標的部位として着目されている。
- 注3) ベンゾジアゼピン
- GABAA受容体におけるGABAの作用を強める薬剤の一種。鎮静、睡眠導入、抗不安、抗けいれん、筋弛緩の特性が知られる。
- 注4) Förster共鳴エネルギー移動(FRET)機構
- 2つの蛍光分子がごく近接して存在する場合、蛍光分子からもう1つの蛍光分子へエネルギーが移行する。もう1つの分子が蛍光消光剤であった場合は、その蛍光は減弱する。
<論文情報>
| タイトル |
“Discovery of allosteric modulators for GABAA receptors by ligand-directed chemistry”
|
| 著者名 |
山浦 圭、清中 茂樹、沼田 朋大、井上 隆司、浜地 格
|
| 掲載誌 |
Nature Chemical Biology |
| doi |
10.1038/nchembio.2150 |
<お問い合わせ先>
<研究に関すること>
浜地 格(ハマチ イタル)
京都大学 大学院工学研究科 合成・生物化学専攻 教授
〒615-8510 京都府京都市西京区京都大学桂 A4-330
E-mail:
清中 茂樹(キヨナカ シゲキ)
京都大学 大学院工学研究科 合成・生物化学専攻 准教授
〒615-8510 京都府京都市西京区京都大学桂 A4-332
Tel:075-383-2755 Fax:075-383-2759
E-mail:
<JST事業に関すること>
鈴木 ソフィア 沙織(スズキ ソフィア サオリ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail:
<報道担当>
京都大学 広報課 国際広報室
Tel:075-753-5727 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: