ポイント
- 選択的オートファジーが標的とするたんぱく質凝集体の立体構造を原子レベルで解明し、これまで不明だった不要なたんぱく質の凝集メカニズムと、受容体が凝集体を認識するメカニズムを明らかにした。
- 凝集体表面に結合した受容体が、目印になると同時に凝集体のサイズを調節し、オートファジーによる認識、隔離を促していた。
- パーキンソン病などの原因となる、たんぱく質凝集体が分解されずに蓄積するメカニズムを解明し、予防・治療方法を確立する足掛かりになると期待される。
選択的オートファジー注1)が、不要となった特定のたんぱく質や細胞内小器官、病原性細菌などを選択的に分解することで、細胞の恒常性注2)は維持されています。選択的オートファジーが破綻すると、不要なミトコンドリアやたんぱく質凝集体が分解されず、パーキンソン病やアルツハイマー病などの神経変性疾患の原因にもなります。そのため、このメカニズムの理解が、これらの病気の克服への足掛かりになると期待されています。
微生物化学研究会 野田 展生 主席研究員、山崎 章徳 博士研究員らを中心とした研究グループは、出芽酵母注3)で凝集性たんぱく質アミノペプチダーゼⅠ(Ape1)が選択的オートファジーで分解される現象に着目しました。Ape1凝集体の立体構造と凝集体形成メカニズムを原子レベルで明らかにしました。さらに、Atg19受容体が凝集体に結合してオートファゴソーム注4)に取り込ませるメカニズムを解明しました。本研究結果は、Atg19受容体の分解対象の目印としての従来の機能の理解を深めるとともに、新たな機能として、凝集体のサイズを制御する役割を初めて示すものです。
本研究の成果は、米国東部時間の平成28年6月16日正午付のCell Reports誌(Cell Press社)のオンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長) |
| 研究課題 |
「オートファジーの膜動態解明を志向した構造生命科学」 |
| 研究代表者 |
野田 展生(微生物化学研究会 微生物化学研究所 主席研究員) |
| 研究期間 |
平成25年4月~平成31年3月 |
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライスサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、オートファゴソーム形成に働くたんぱく質群が膜の上で繰り広げる相互作用を構造生物学的に明らかにすることで、オートファゴソーム形成機構の分子論的解明を目指します。
<研究の背景>
オートファジーは、飢餓により誘導される細胞内分解メカニズムで、オートファゴソームと呼ばれる脂質二重膜の袋内に非選択的にたんぱく質や細胞内小器官を取り込んで、リソソーム注5)や液胞注6)へ輸送し、分解します。オートファジーによる分解は通常は非選択的ですが、細胞が不必要と判断したものだけを選択的にオートファゴソームに取り込ませる選択的オートファジーと呼ばれるメカニズムも存在します。この選択的オートファジーは細胞の恒常性維持に深く関わっていると考えられており、選択的オートファジーの破綻は神経変性疾患につながることが示唆されています。例えば、不要なミトコンドリアの分解不全がパーキンソン病を引き起こすことや、たんぱく質凝集体の分解不全がアルツハイマー病やハンチントン病などの原因となることが示唆されています。
選択的オートファジーには、分解対象を特異的に認識し、オートファゴソームに取り込ませる受容体が必要です。近年、分解対象に対応した受容体が相次いで見つかっています。しかし、詳細な認識メカニズムについては、これまでほとんど明らかになっていませんでした。
オートファジー研究に最も活用されてきた出芽酵母では、アミノペプチダーゼⅠ(Ape1)という凝集性のたんぱく質が選択的オートファジー受容体Atg19に認識され、Cvt小胞注7)と呼ばれる特殊なオートファゴソームに隔離され、液胞へ輸送されることが分かっていました。そこでApe1とAtg19に着目し、選択的オートファジー受容体が凝集体を認識するメカニズムについて、X線結晶構造解析法注8)により原子レベルで明らかにすることを目的として研究を始めました。
<研究の内容と成果>
Ape1はプロペプチド注9)と酵素本体からなるたんぱく質で、選択的オートファジーで液胞へ輸送されます。これまでに、Ape1は酵素本体で12量体を形成すること、プロペプチドを介して12量体同士がつながり凝集体が形成されることが分かっていました。また、受容体Atg19は自身のコイルドコイル注10)領域を介してApe1のプロペプチド部分と結合することも分かっていました。
本研究ではX線結晶構造解析法により、Ape1の全体構造、Ape1のプロペプチド部分同士の結合構造、プロペプチドとAtg19のコイルドコイル領域の結合構造をそれぞれ明らかにしました。その結果、Ape1の12量体は正四面体型の構造を持ち、表面に12本のプロペプチドが突き出ていることが明らかになりました。また、12量体同士の凝集は、プロペプチドが自己結合して3量体構造をとることで行われること、受容体Atg19によるApe1凝集体の認識は、Atg19コイルドコイル2分子がプロペプチド1分子と3量体を形成することで行われることが明らかになりました(図1)。
凝集体形成と受容体認識は互いに極めて類似した構造で行われていたため、Atg19の結合がプロペプチド同士の3量体構造を壊す可能性が考えられました。溶液中でのApe1凝集体の粒子径を計測した結果、Atg19コイルドコイル断片を加えると顕著に小さくなることが分かりました。つまり、Atg19はプロペプチドの自己結合を壊すように結合することで、凝集体形成を阻害することが分かりました。
次に酵母内でApe1凝集体のサイズとその液胞輸送との関係を調べた結果、凝集体のサイズは大きすぎても小さすぎても液胞輸送には適さないことが分かりました。また酵母内でのAtg19の局在を調べた結果、Atg19は凝集体の表面を覆うように結合することが明らかになりました。これらの結果から、Atg19はApe1凝集体の表面を覆うように結合することでCvt小胞が認識する目印となっていること、同時にApe1の過度の凝集を阻害し、Cvt小胞が包み込むのに適したサイズに調節していることが明らかになりました(図2)。
<今後の展開>
本研究から、選択的オートファジー受容体が、従来考えられていた分解対象の目印としての機能のみならず、分解対象のサイズを適切に制御するという新たな機能を持つことを見いだしました。今回の研究対象は出芽酵母でしたが、ヒトなどの高等生物において見られるたんぱく質凝集体の選択的オートファジーでも、同様のメカニズムが使われている可能性があります。本研究の結果を足掛かりとして、多くの神経変性疾患で見られるたんぱく質凝集体の分解不全のメカニズムの解明が進展し、将来的には予防・治療方法の確立につながることが期待されます。
<参考図>
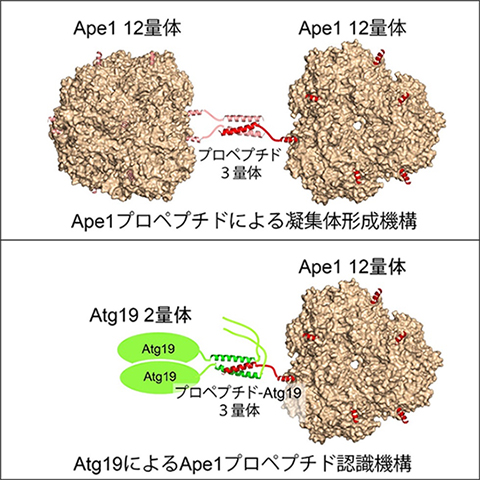
図1 Ape1の凝集体形成機構とAtg19による認識機構
Ape1の12量体同士はプロペプチドを介して自己凝集する。Atg19もApe1のプロペプチドを認識して結合する。どちらも3量体コイルドコイル構造を介した、非常に類似したメカニズムである。
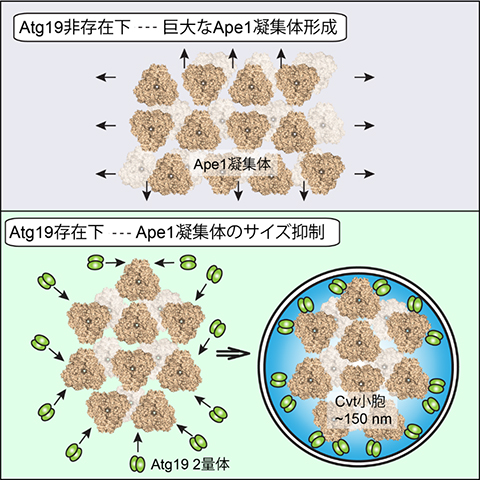
図2 Atg19によるApe1凝集体のサイズ抑制
Atg19がApe1と競合しながら凝集体に結合することで、凝集体のサイズが適度に抑えられる。同時に、Ape1凝集体の表面をラベルすることで、Cvt小胞による選択的な取り込みを促進している。
<用語解説>
- 注1) 選択的オートファジー
- 飢餓が引き金となり細胞内成分を非選択的に分解する一般的なオートファジーとは異なり、細胞が必要な時に特定の対象を分解するオートファジー経路。選択的オートファジーでは、分解対象の種類に応じたさまざまな選択的オートファジー受容体が存在し、それらはどれも分解対象とオートファゴソーム上のたんぱく質Atg8の両方に結合することで、分解対象をオートファゴソームに選択的に取り込ませる。
- 注2) 細胞の恒常性
- 生物は外部環境の変化に関わらず一定の状態を保つ性質を持っており、それを恒常性と呼ぶ。生物の構成単位である細胞も通常は恒常性を持っており、古くなった生体分子や細胞内小器官を常に刷新し続けることで、細胞内環境を一定に保っている。
- 注3) 出芽酵母
- パンやビール、ワインの製造に用いられる酵母。真核生物であるため基本的な生命現象はヒトを含む高等生物と共通点が多く、遺伝学的解析が簡便に行えることから、モデル生物として汎用されている。オートファジーに関与する遺伝子群はほとんどが出芽酵母を用いて同定された。
- 注4) オートファゴソーム
- オートファジーが誘導された時のみ形成される一過性の細胞内小器官で、二重の生体膜からなる。細胞質成分を取り囲みながら形成され、形成後は速やかにリソソームと融合し、内膜および内容物はリソソーム酵素の働きで分解される。
- 注5) リソソーム
- 真核生物が持つ細胞内小器官の1つであり、内部を酸性に保ち、さまざまな加水分解酵素を含む。オートファジーやエンドサイトーシスにより取り込んだ細胞内小器官やたんぱく質を分解する。
- 注6) 液胞
- 酵母や植物の細胞で発達している細胞内小器官であり、リソソームと類似した特徴を持つ。酵母や植物では液胞がオートファジーやエンドサイトーシスにより取り込んだ細胞内小器官やたんぱく質を分解する。
- 注7) Cvt小胞
- オートファゴソームに類似した一過性の構造体で、出芽酵母でのみ同定されている。オートファゴソームと比べてサイズが小さく、Ape1など特定のたんぱく質を選択的に包みこんで液胞へ輸送する。
- 注8) X線結晶構造解析法
- 結晶はX線を回折する性質があるが、この性質を利用して結晶の構成物の原子がどのように立体的に配列しているのかを決定する手法。たんぱく質は結晶になる性質があるため、たんぱく質の立体構造を明らかにするために広く利用されている。
- 注9) プロペプチド
- 新しく合成されたたんぱく質に付加されるペプチドで、たんぱく質が実際に機能する状態へと成熟する過程で切除される領域。たんぱく質が細胞内の適切な場所に輸送される際に目印として働いたり、たんぱく質の活性を一時的に阻害したりする機能がある。
- 注10) コイルドコイル
- たんぱく質の二次構造であるαへリックス(右巻きらせん)が2本以上集まり、互いに巻きつきあって形成される構造。たんぱく質の自己結合や、異なるたんぱく質同士の結合を担う機能がある。
<論文情報>
| タイトル(和訳) |
“Structural Basis for Receptor-Mediated Selective Autophagy of Aminopeptidase I Aggregates”
(アミノペプチダーゼI凝集体の受容体を介した選択的オートファジーの構造基盤) |
| doi |
10.1016/j.celrep.2016.05.066 |
<お問い合わせ先>
<研究に関すること>
野田 展生(ノダ ノブオ)
公益財団法人 微生物化学研究会 微生物化学研究所(微化研) 主席研究員
〒141-0021 東京都品川区上大崎3-14-23
Tel:03-3441-4173
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: