理化学研究所(理研) 統合生命医科学研究センター 自然免疫システム研究チームの茂呂 和世 チームリーダーと免疫細胞システム研究グループの小安 重夫 グループディレクター、慶應義塾大学 医学部 呼吸器内科学教室の加畑 宏樹 助教と別役 智子 教授らの共同研究チーム※1)は、自然リンパ球注1)によって発症するアレルギー炎症を抑制するメカニズムを解明しました。
2010年、茂呂チームリーダー、小安グループディレクターらの共同研究チームは、新しいリンパ球「ナチュラルヘルパー細胞(NH細胞)注2)」を発見しました※2)。それ以降、さまざまな類似する細胞が報告され、今ではこれらを「2型自然リンパ球(ILC2s)」と呼んでいます。ILC2sの発見により、これまで広く知られてきたT細胞やB細胞、IgE注3)を介したアレルギー反応とは異なる、ILC2sを介したアレルギー反応(自然アレルギー)が存在することが明らかになりました。一方、どうすればILC2sの活性化を抑制できるのか、どのようにILC2sによる炎症反応が収束するかは明らかにされていませんでした。
共同研究チームは、アレルギー疾患を根本的に治療するためには、ILC2sの抑制メカニズムを解明する必要があると考え、ILC2sを抑制するサイトカイン注4)を探索し、1つずつスクリーニングしました。その結果、共同研究チームはインターフェロン(IFN)とインターロイキン-27(IL-27)と呼ばれる2つのサイトカインがILC2sの増殖・機能を抑制することを発見しました。さらに、喘息のモデルマウスにIFNあるいはIL-27を投与したところ、肺でのILC2sの増殖を強く抑えることができ、喘息の炎症症状である、好酸球注5)浸潤や粘液過剰分泌、気道過敏性を抑えることに成功しました。また、寄生虫感染についても、虫体が体外に排出された後、IFNとIL-27がILC2sの活性化を抑え、炎症を収束させることが明らかとなりました。
ILC2sは、皮膚や腸管、肺など、アレルギー疾患と関わりの深い部位に存在することから、アトピー性皮膚炎、食物アレルギー、喘息など、多様なアレルギー性疾患に関わっていると考えられます。これまで見過ごされてきた、自然アレルギーという概念を考慮することで、今後、アレルギーの発症・増悪メカニズムの解明や新しい治療法の開発が可能になると期待されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業の一環として行われました。成果は、国際科学雑誌『Nature Immunology』オンライン版(11月23日付け:日本時間11月24日)に掲載されます。
※1)共同研究チーム
理化学研究所 統合生命医科学研究センター
自然免疫システム研究チーム チームリーダー 茂呂 和世(もろ かずよ)
免疫細胞システム研究グループ グループディレクター 小安 重夫(こやす しげお)
慶應義塾大学 医学部
| 呼吸器内科学教室 |
助教 加畑 宏樹(かばた ひろき)
教授 別役 智子(べつやく ともこ) |
※2)Moro K, Yamada T, Tanabe M, Takeuchi T, Ikawa T, Kawamoto H, Furusawa J, Ohtani M, Fujii H, Koyasu S. ,Innate production of Th2 cytokines by adipose tissue-associated c-Kit+Sca-1+ lymphoid cells ,Nature. 463: 540-4, 2010
<研究の背景>
2010年、茂呂チームリーダー、小安グループディレクターらの共同研究チームは、新しいリンパ球(ナチュラルヘルパー細胞(NH細胞))を発見しました。それ以降、さまざまな類似する細胞が報告され、今ではこれらを「2型自然リンパ球(ILC2s)」と呼んでいます。当初、ILC2sは寄生虫感染排除を行う細胞と考えられていましたが、研究が進むにつれ、実はILC2sが寄生虫排除と同じメカニズムによって、T細胞やB細胞、IgEに依存しない新たなアレルギー性炎症の発症や病態に関わることが明らかになってきました。ILC2sを介したこの新しいアレルギーは「自然アレルギー」と呼ばれ、現在さまざまな診療科のアレルギー性疾患で解析が進められています。
また、アレルギー疾患に対する最も有用で一般的な治療としてステロイド療法が知られています。しかし、一部の患者はステロイドに対する抵抗性を持ってしまい、効率の良い治療が受けられないことでアレルギーが重症化してしまうことが問題になっています。共同研究チームは過去の研究で、このステロイド抵抗性にもILC2sが深く関わっていることを明らかにしています。インターロイキン-33(IL-33)と呼ばれるサイトカインによって活性化されたILC2sに依存的なアレルギー疾患が発症したときに、TSLPと呼ばれるサイトカインが存在するとILC2sはアポトーシス(細胞死)を起こしにくい細胞へと変化します。そのため、ステロイドを投与してもILC2sが死なず、2型サイトカインを出し続けてしまうことでアレルギーが重症化、慢性化することが明らかになりました※3)。
このように、ILC2sはアレルギーの発症だけでなく、アレルギーの重症化、慢性化に関わる細胞であることから、一日も早い抑制メカニズムの解明が待たれていました。
※3)2013年10月25日プレスリリース「ステロイドが効かない重症ぜんそくのメカニズムをマウスで解明」
http://www.riken.jp/pr/press/2013/20131025_2/
<研究手法と成果>
共同研究チームは、ILC2sの抑制メカニズムを解明するために、ILC2s表面に発現しているサイトカイン受容体を詳しく調べたところ、ILC2s表面には多数のサイトカイン受容体が発現していることが分かりました。次に、共同研究チームは、それらの受容体に対するサイトカインを1つずつ調べ、抑制効果があるものをスクリーニングしました。その結果、インターフェロン(IFN)とインターロイキン-27(IL-27)と呼ばれるサイトカインがILC2sの増殖とサイトカイン産生を強く抑えることが明らかになりました。
そこで、共同研究チームは、IFN受容体を欠損させたマウスに対して寄生虫感染を行い、IFNシグナルが欠如した場合にILC2sによる炎症がどうなるかを調べました。すると、IFN受容体欠損マウスでは寄生虫が肺からいなくなった後もILC2sと好酸球が残り、炎症が継続することが明らかになりました。この結果は、内在性のIFNがILC2sによる炎症の収束に重要であることを意味しています。さらに、IL-33誘導性の喘息モデルマウスを用いてIFNやIL-27がILC2sによるアレルギー症状を抑えることができるかを調べたところ、IL-33とともにIFNあるいはIL-27を投与したマウスの肺ではILC2sの増加が強く押さえられ、好酸球浸潤や粘液過剰分泌、気道過敏性が抑えられることが明らかになりました。どちらのサイトカインもSTAT1と呼ばれる転写因子に依存的にILC2sを抑制することから、これらのサイトカインまたはSTAT1経路が障害されるような場合には、IL-33-ILC2sを介したアレルギー疾患が悪化することが考えられます。
以上の結果から、寄生虫感染ではIL-33によってILC2sが活性化し、積極的な排虫を促すが、虫体が体外に排出された後もILC2sが活性化し続けることは生体にとって危険な状態になるため、IFNやIL-27が出されることによって虫体の排出とともに炎症が収束することが明らかになりました。また、IL-33-ILC2s依存的なアレルギー性炎症はIFNやIL-27によって抑制することができることも明らかになりました。これらの知見は今後のアレルギー性炎症疾患の新しい治療戦略を考える上で有用な知見であり、その波及効果は大きいと思われます。
<今後の期待>
今後、アレルギーの発症・悪化メカニズムの解明や治療法の確立を目指すために、これまで見過ごされてきた自然アレルギーという概念を包含して考える必要があります。ILC2sの活性化機構や分化機構が次々と報告される中、これまで明らかになっていなかった抑制機構を解明できたことは大きな前進です。ILC2sは皮膚や腸管、肺などアレルギー疾患と関わりの深い部位に存在することが分かっていることから、アトピー性皮膚炎、食物アレルギー、喘息など多様なアレルギー性疾患に関わっていると考えられ、今回の成果をもとに各組織におけるアレルギー性炎症のメカニズムを解析していくことで、アレルギー性疾患の画期的な治療法開発につながるのではないかと思われます。実際に、獣医学領域では動物のアレルギー性疾患に対するIFN治療はすでに行われており、今回の成果は不明であったそのメカニズムを明らかにしたものといえ、将来的に人への応用が期待されています。
<参考図>
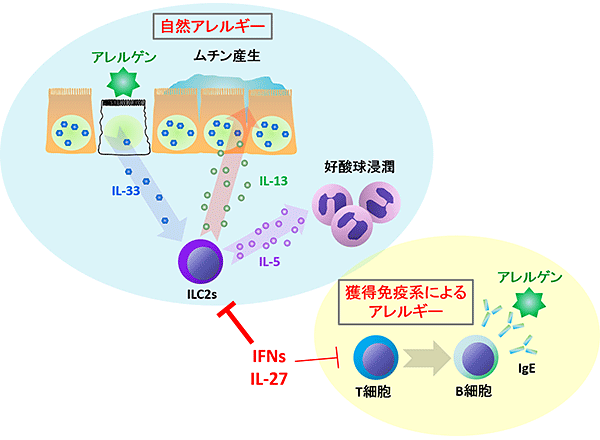
図1 IFNとIL-27によるILC2sを介した自然アレルギー抑制機構
アレルゲンを特異的に認識したT細胞がB細胞を活性化することによりアレルゲン特異的IgEを作らせる獲得免疫系によるアレルギーとは独立に、ILC2sを主体とするアレルギーが存在することが明らかになってきており「自然アレルギー」と呼ばれている。自然アレルギーでは酵素活性、特にタンパク質分解活性を持つアレルゲンが生体防御の最前線である上皮細胞を傷害することで上皮細胞からのIL-33産生を誘導する。IL-33はILC2sを強く活性化することによりアレルギー症状の悪化につながるムチン産生(粘液過剰分泌)や好酸球浸潤を引き起こす。本研究からIFNやIL-27は自然アレルギーの原因細胞であるILC2sを抑制できることが明らかになった。
<用語解説>
- 注1) 自然リンパ球
- これまでT細胞、B細胞、NK細胞、NKT細胞、LTi細胞の5種類のリンパ球が知られていたが、NH細胞の発見により全部で6種類のリンパ球が生体内に存在することが分かった。このうちのNK細胞、LTi細胞、NH細胞の3つは抗原を認識する受容体を持たないことから自然リンパ球と呼ばれるようになった。これに伴い、各細胞はそれぞれILC1、ILC3、ILC2と呼ばれるようになっている。
- 注2) ナチュラルヘルパー細胞(NH細胞)
- リンパ球の一種。Tリンパ球やBリンパ球のように異物を認識する受容体を持たず、IL-33によって刺激を受けると大量のIL-5やIL-13を産生する細胞で、アレルギー性炎症や寄生虫感染防御において重要な細胞であることが分かっている。脂肪組織の中に多く存在するが、それ以外に肺や腸管などさまざまな臓器に存在する。
- 注3) T細胞、B細胞、IgE
- これまで一般的に知られているアレルギーは、生体内に進入したアレルゲンに対して、2型T細胞(Th2)が活性化することでアレルゲン特異的B細胞が増殖し、さらにアレルゲン特異的IgEを作り出すことで起こることが分かっている。
- 注4) サイトカイン
- 細胞同士が情報を伝達するために放出する小さなタンパク質。大きく分けて1型サイトカイン、2型サイトカイン、3型サイトカインに分かれ、それぞれ細胞内細菌感染とウィルス感染、寄生虫感染とアレルギー性炎症、細胞外細菌感染や真菌感染に関与することが分かっている。
- 注5) 好酸球
- 顆粒球の一種で、細胞内にエオジン親和性の顆粒を持つ。表面にIgEの受容体を持ち、アレルゲン特異的IgEとアレルゲンの複合体によって活性化されるとヒスタミンなどの生理活性物質や強力な傷害活性を持つMajor Basic Proteinなどを放出する。好酸球増多は好酸球を呼び寄せるケモカインであるエオタキシンと増殖因子であるIL-5の機能で誘導されるが、ILC2sはIL-33によってエオタキシンとIL-5の両方を大量に産生する。寄生虫感染防御の中心的役割を果たすだけでなく、アレルギー性鼻炎などのアレルギー性炎症においても重要な役割を果たす。
<論文情報>
| タイトル |
“Interferon and IL-27 antagonize the function of group 2 innate lymphoid cells and type 2 innate immune responses” |
| 著者名 |
Kazuyo Moro, Hiroki Kabata, Masanobu Tanabe, Satoshi Koga, Natsuki Takeno, Miho Mochizuki, Koichi Fukunaga, Koichiro Asano, Tomoko Betsuyaku, and Shigeo Koyasu |
| 掲載誌 |
Nature Immunology |
| doi |
10.1038/ni.3309 |
<お問い合わせ先>
<研究に関すること>
理化学研究所 統合生命科学センター
自然免疫システム研究チーム チームリーダー 茂呂 和世(もろ かずよ)
免疫細胞システム研究グループ グループディレクター 小安 重夫(こやす しげお)
Tel:045-503-9687(茂呂) Fax:045-503-9686(茂呂)
E-mail: (茂呂)
(茂呂)
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
川口 哲(かわぐち てつ)
Tel:03-3512-3524 Fax:03-3222-2066
E-mail:
<報道担当>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: