ポイント
- ヒトのインスリン代謝などに関係するタンパク質リン酸化酵素Akt注1)(図1)の酵素活性を、光照射により分単位で操る手法を開発し、Akt活性の時間的な変動パターンが細胞応答を制御する新規メカニズムが存在することを証明しました。
- 人工の光感受性Aktと数理モデルを組み合わせ、世界で初めて細胞内のAkt活性の時間的な変動パターンを自在に操作することを可能としました。
- Aktは糖尿病やガンをはじめとしたさまざまな疾患に密接に関連する分子であるため、Aktによる疾患発症のメカニズム解明や薬剤の最適な投与量や時間の提案などに寄与することが期待できます。
生命がその機能を正常に発揮し恒常性を維持するためには、細胞内のさまざまな分子の活性が、体内時計や睡眠、栄養摂取などに応じて適切な時間パターンで上昇・下降することが必須です。これまで生体内における分子の活性を化学物質や人工タンパク質で人為的に操作するさまざまな手法が開発されてきましたが、操作の強度を指定した「定量的な操作」や一度活性化した後に再び不活性化させる「可逆的な操作」が困難であるというボトルネックが、さらなる応用研究を妨げてきました。
東京大学 大学院理学系研究科 化学専攻の桂 嘉宏 大学院生と小澤 岳昌 教授らは、東京大学 大学院理学系研究科 生物科学専攻の黒田 真也 教授の研究グループとの共同研究により、新規に作製した人工の光感受性分子とシミュレーション解析を用いて、細胞内における酵素活性の時間的な変動パターンを定量的かつ可逆的に光操作する手法の開発に成功しました。また、開発した手法を用いて、酵素活性の時間的な変動パターンによって、細胞内で誘導される遺伝子発現の誘導強度が異なることを明らかにしました。
本研究で光操作の対象としたタンパク質リン酸化酵素Aktは、糖尿病やガンといったヒトにおけるさまざまな疾患において、その活性が異常な時間的変動パターンで上昇・下降することが知られています。そのため、Akt活性の時間的な変動パターンと細胞応答との関係性を詳細に解析しうる本手法は、今後、インスリンなどの薬剤の最適な投与量および時間の提案やAktが関与する疾患発症のメカニズム解明などに寄与することが期待されます。また、本研究で確立した一連の方法論は、Akt以外の分子にも応用可能である汎用性があり、近年注目が集まっている「生命機能を光によって意のままに操る」研究全般の発展に貢献することが期待できます。
本研究は、JST 戦略的創造研究推進事業 チーム型研究(CREST)(「生命動態の理解と制御のための基盤技術の創出」研究領域、研究代表者:黒田 真也)、日本学術振興会 基盤研究(S)(研究課題番号:26220805)挑戦的萌芽研究(研究課題番号:26620128)の一環として行われ、内藤記念科学振興財団、アステラス病態代謝研究会、にご支援をいただきました。
<発表内容>
① 研究の背景・先行研究における問題点
生体内における酵素などの分子の活性は、あらゆる生命機能の維持や発揮に不可欠であり、分子活性を人為的に操作する手法は古くから研究されています。近年、光感受性タンパク質を分子に組み込み、光照射で分子機能を操作する「オプトジェネティクス」と呼ばれる技術が注目されています。化学物質を用いる古典的な操作法と異なり、オプトジェネティクスは、光によって時空間的な操作が可能な点に大きな特徴があります。化学物質は生体内で拡散するため不可逆的な操作になる一方、光による操作は、レーザーなどの指向性の高い光源を用いることで、時空間的に自在な操作が可能です。しかし、このオプトジェネティクスにおいても、どのように光を照射すれば、どの程度、光感受性分子が活性化するかという定量的な見積もりが困難であるという大きな問題があります。すなわち、光照射という生体に与える「入力」と光感受性分子による「出力」を結ぶための何らかの一般的な技術・方法論の開発が急務とされています。
② 研究内容
人工の光感受性Aktの作製
本共同研究グループは、植物由来の光受容タンパク質CRY2注2)について、遺伝子工学技術を用いAktと融合することにより、光感受性のある人工Aktを作製しました。Aktは細胞質から細胞膜への移動により活性化する性質があるため、光照射によって細胞膜へ移行する設計をしました。作製した光感受性Aktをマウス筋芽細胞内に発現させ、細胞外から光を照射したところ、光感受性Aktが分単位の時間スケールで可逆的に活性化することが確認できました(図2)。活性化した光感受性Aktは、細胞内に内在する本来のAktと同様に、Aktの基質タンパク質をリン酸化し、Aktに支配される遺伝子発現や細胞極性の決定(細胞の移動方向の決定)などの生命現象を誘導することが確認できました。さらに、レーザー光源を用いることにより、細胞内の特定の場所でのみAktを活性化させる「空間的な操作」も可能であることが示されました。
人工光感受性Aktの活性の時間パターンを再現する数理モデルの構築
次に、作製した人工光感受性Aktの活性の時間パターンを定量的に光操作するシステムの開発に向けて、Aktの時間的な活性を記述する数理モデルを構築しました。本研究を含めこれまでにさまざまな分子種を対象とした光操作技術が開発されているものの、生体内における分子活性を精密に制御する方法論が不足していました。本共同研究グループは、実験データに基づき、人工光感受性Aktの活性の時間的な変動を表す数理モデルの構築に成功しました(図3、図4)。構築した数理モデルでは、さまざまな光照射パターンに伴うAkt活性の変動を正しく予測することが確認でき、定量的にAkt活性を操作する技術開発に成功しました。さらに数理モデル構築の過程で、実験結果とシミュレーション結果との比較検討から、Aktの活性化メカニズムに、ポジティブ・フィードバック注3)と呼ばれる活性化機構が関与することを新たに特定しました。
Akt活性の時間的変動パターンの意義
最後に、構築した数理モデルと人工光感受性Aktを融合した一連のシステムを用いて、Akt活性の時間的変動パターンが持つ生物的意義について検討しました。活性化の強度と頻度が異なる3つの時間的変動パターンのAkt活性をそれぞれマウス筋芽細胞内で人工的につくりだし、それぞれのパターンにおいてAktによって調節されている遺伝子発現の誘導効率を比較しました(図5)。その結果、Akt活性の総量が同じであっても、その時間的変動パターンによってAktによる細胞機能の誘導効率が異なることを発見しました。従来の生物研究では、分子の「固有名詞」である分子名とその機能を一対一につなぐ研究が中心である一方、本結果は、分子活性の時間的変動パターンにも細胞機能の制御メカニズムが内包していることを直接的に示す結果です。
③ 社会的意義・今後の予定など
Aktが調節する代謝や遺伝子発現といった生命機能の異常は、糖尿病やガンをはじめとしたヒトのさまざまな疾患に密接に関与することが知られています。今後、さまざまな時間パターンのAkt活性入力とそれに伴う代謝物質や遺伝子発現などの細胞応答出力を定量的に解析することにより、Aktによる疾患発症のメカニズム解明や糖尿病患者に対するインスリンの最適な薬剤投与パターンの提案などに寄与することが期待されます。また、本研究で示した光感受性分子の設計や数理モデル構築などの一連の手法は、Akt以外の分子にも応用可能であるシステムとしての汎用性を備えており、オプトジェネティクス研究領域全体の発展に貢献することが期待できます。
<参考図>
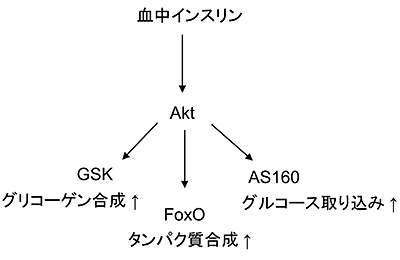
図1 細胞内でのAktの役割
タンパク質リン酸化酵素Aktは血中インスリンなどに応じて活性化され、基質タンパク質であるGSK、FoxO、AS160などをリン酸化することにより、グリコーゲン合成、タンパク質合成、グルコース取り込みなどの細胞機能をそれぞれ調節する。
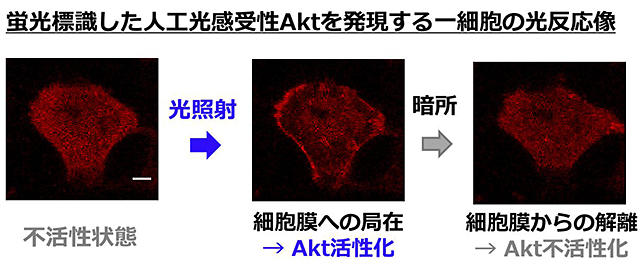
図2 開発した人工光感受性Aktの細胞内動態
細胞内におけるAktの活性化は、細胞質から細胞膜への細胞内局在変化によって制御されていることから、光受容タンパク質CRY2を用いて、光照射依存的に細胞質から細胞膜へ局在変化する人工光感受性Aktを作製した。光照射を止めることで、人工光感受性Aktは再び不活性化するため、生体内におけるAkt活性を時空間的に操作することが可能である。
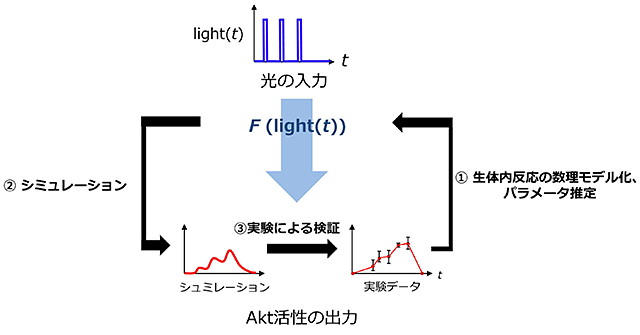
図3 人工光感受性Aktの活性の時間的パターンを記述する数理モデルの作製プロセス
実験データおよび背景知識から数理モデルを作製し、シミュレーションを行う。シミュレーション結果と実験データとの合致の程度や実験データによる検証のプロセスを繰り返すことで、最終的な数理モデルを得る。
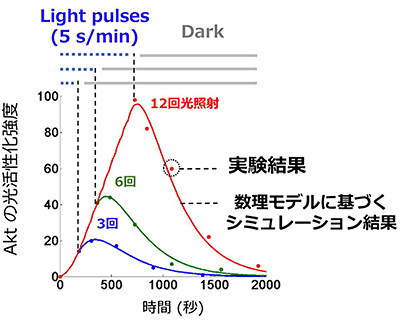
図4 作製した数理モデルによるシミュレーションと実験結果
最終的な数理モデルによるシミュレーション結果は、実験的に得られた人工光感受性Aktの活性の時間的変動パターンをよく再現する。
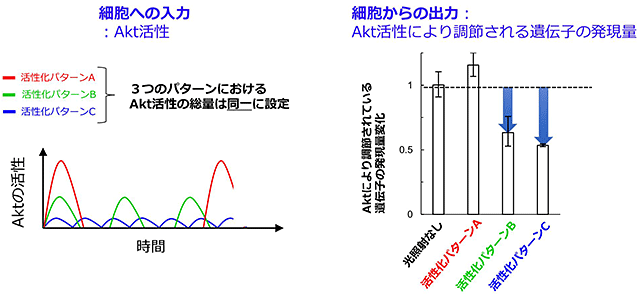
図5 Akt活性の時間的変動パターンが持つ生物的意義の検討
細胞へ与えるAkt活性の総量が同じであっても、その活性を与える時間的変動パターンによって細胞からの応答強度が異なる。本結果は、Akt活性の時間的変動パターンに細胞応答を制御する新規メカニズムが存在することを示す。
<用語解説>
- 注1) Akt
- 生体内で発現するタンパク質リン酸化酵素の一つ。基質タンパク質をリン酸化修飾することで、細胞内のさまざまな機能を調節する。Aktの活性化は、細胞質から細胞膜への移動によって制御されている。
- 注2) CRY2
- 植物由来の光受容タンパク質。光吸収により立体構造が変化する性質がある。
- 注3) ポジティブ・フィードバック
- 自身が誘導する反応により生じた活性が自身にフィードバックし反応を増強する作用のこと。
<発表雑誌>
| 掲載誌 |
Scientific Reports |
| タイトル |
“An optogenetic system for interrogating the temporal dynamics of Akt” |
| 著者名 |
Yoshihiro Katsura , Hiroyuki Kubota , Katsuyuki Kunida, Akira Kanno, Shinya Kuroda, Takeaki Ozawa |
| doi |
10.1038/srep14589 |
<お問い合わせ先>
<研究に関すること>
東京大学 大学院理学系研究科 化学専攻
教授 小澤 岳昌
Tel:03-5841-4351
E-mail:
<JST事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
調査役 川口 哲
Tel:03-3512-3524
E-mail:
<報道担当>
東京大学 大学院理学系研究科・理学部
特任専門職員 武田 加奈子、准教授・広報室副室長 横山 広美
Tel:03-5841-8856
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: