ポイント
- ショウジョウバエでは、加齢にともなって体内のSアデノシルメチオニン(SAM:注1))量が増加していくこと、人為的にSAM代謝・消費を促進してSAMの増加を抑えることで寿命が延長することを発見した。
- ショウジョウバエでは、食餌制限やインスリンシグナル抑制による寿命の延長にもSAMの代謝が必須であることを発見した。
- SAM代謝調整機構はヒトにも保存されており、本研究成果を応用した健康・長寿の新たな戦略の開発が期待される。
摂取カロリーの制限による寿命の延長は、酵母、線虫、ショウジョウバエ、マウスからヒトまで種を超えて広く見られる現象です。近年の研究から、実際には総カロリーではなく、摂取する食餌の質が寿命の延長に重要であることがわかってきました。中でも、必須アミノ酸の一種であるメチオニンだけを制限することでも寿命が延長することが示唆されています。しかし、その詳しいメカニズムは明らかになっていませんでした。
東京大学 大学院薬学系研究科の小幡 史明 特任助教(研究当時、現:英国The Francis Crick Institute研究員)、三浦 正幸 教授らの研究グループは、メチオニンそのものではなく、メチオニンから合成されるSアデノシルメチオニン(SAM)の代謝が寿命延長の決定要因であることを、ショウジョウバエを用いて明らかにしました。本研究グループは、ショウジョウバエの脂肪組織にSAMの量を一定にしようとする仕組みがあることを発見し、この機能を担う酵素とその遺伝子を特定しました。SAMの量を詳しく分析してみると、老化したショウジョウバエの体内ではSAM量が増加していました。そこでSAM量を調節する酵素の働きを遺伝学的に強めると、代謝が促進され加齢に伴うSAM量の増加が抑えられ、個体の寿命が延長することが分かりました。さらに、SAM量を調節する酵素の機能を欠損させたショウジョウバエでは、食餌制限による寿命延長効果が見られないことから、SAM量の調節が寿命延長の鍵となる要因であることを見出しました。SAM代謝経路はヒトにも保存されていることから、本研究成果によって明らかになった新たな寿命延長機構がヒトにもあてはまるかを検討し、効率的かつ安全に健康・医療へ応用されることが期待されます。
本研究は、文部科学省 科学研究費補助金基盤研究(S) 「発生頑強性を規定する細胞死シグナルの解明」(研究代表者:三浦 正幸)、挑戦的萌芽研究 「メチオニンによる腸幹細胞の増殖制御機構の解明」(研究代表者:小幡 史明)と、国立研究開発法人 科学技術振興機構(JST) 戦略的創造研究推進事業の研究領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究総括:永井 良三)※における研究課題「個体における組織細胞定足数制御による恒常性維持機構の解明」(研究代表者:三浦 正幸)の一環で行われました。
※平成27年4月1日に日本医療研究開発機構(AMED)が設立されたことにともない、本研究課題はAMEDに承継され、引き続き研究開発の支援が実施されます。
<研究背景>
がんや糖尿病、心筋梗塞など加齢にともなう様々な疾患のリスクを低減すること、およびその結果としての寿命の延長は超高齢社会の現代にあって必須の命題と言えます。しかしながら、加齢による生理的な変化や寿命の長さがどのように決定されるのかを分子(遺伝子)レベルで明らかにすることは、非常に難しい課題です。加齢というのが非常に複雑な現象であることはもちろん、一回の実験に要する時間があまりに長いため(マウスでさえ寿命は2-3年)、研究すること自体が難しいと言えます。
そこで、線虫やショウジョウバエなど比較的「寿命が短いモデル生物」を利用した研究が盛んに行われています。近年では、食餌制限やインスリンシグナルの機能減弱による寿命延長などは、哺乳類から酵母などの単細胞まで一貫して見られる現象で、「種を超えて共通した老化原理」の存在が考えられるようになりました。
メチオニンは、外から栄養として摂取する必要がある「必須アミノ酸」の一種です。興味深いことに、酵母からマウス、ラットまでの幅広い生物で、食餌からメチオニン量のみを制限した場合に寿命が延長することが報告されています。メチオニンは、そのままの形でタンパク質合成の原料として使われますが、一方でSAMに代謝されて、様々な機能を担うことが知られています。これまで線虫をモデルとした研究から、メチオニンからSAMを合成する酵素Sams(SAM合成酵素)の機能を抑制しただけでも寿命が延長することが報告され、メチオニン制限による寿命延長は、メチオニンそのものではなくSAM量の低下によるものであることが示唆されていました。しかし、Sams(マウスMAT1A)の機能が低下したマウスにおいては、加齢にともない肝障害があらわれ、最終的に肝がんを発症することが知られています。このような動物種によって異なる結果が示すように、メチオニン、あるいはSAMの老化・寿命への影響、その分子機構についてはこれまでよくわかっていませんでした。
<研究内容>
始めに本研究グループは、Samsの機能を抑制したショウジョウバエが「短命」になることを明らかにしました。当初の予想とは異なりSAM合成酵素であるSamsの機能を抑制したにもかかわらず、このショウジョウバエのSAM量は、正常個体と変わらないことが分かりました。詳しく解析してみると、ショウジョウバエ体内ではSAM量を一定に保とうとする強い調節機構が存在し、その仕組みは余分なSAMを消費する代謝調節酵素Gnmt注2)が担っていることが明らかになりました(図1)。
次に本研究グループは、加齢にともなってSAM量が増加していくことを発見しました(図2)。また、GnmtによるSAM代謝が加齢にともなって活性化していることを見出しました。Gnmtを過剰に発現するショウジョウバエを作出し、SAM代謝能力を高めたところ、加齢に伴うSAM量増加を抑制できることが明らかになりました。そこで寿命を測定してみると、このショウジョウバエは長寿であることが判明しました(図1、2)。
Gnmt量が、FoxO注3)と呼ばれる転写因子により制御されることは、本研究グループの以前の研究(http://www.u-tokyo.ac.jp/public/public01_260418_j.html)で明らかになっていました。FoxOは前述のインスリン機能抑制などで長寿になる際に必須のタンパク質で、ショウジョウバエではFoxOが活性化することで長寿になることが報告されていました。本研究結果から、インスリンシグナル抑制による寿命延長が、Gnmtの機能欠損により見られなくなることから、これまで知られていたFoxOによる寿命の延長は、GnmtによるSAM代謝調節が原因であることが示唆されました(図2)。また食餌制限による寿命延長もGnmtに依存していることが明らかになりました(図2)。
<今後の展望>
本研究によって食餌制限による寿命延長のメカニズムの一端が明らかにされたことで、この知見を応用した薬剤や、健康法の開発が期待されます。例えば、SAMの代謝を活性化することで、食べる量・質をそれほど変化させず、食餌制限と同じような健康増進効果が得られる可能性があります。そのためには今回ショウジョウバエをモデルとして得られた知見が、マウスを始めとした哺乳類モデルでも当てはまるかどうかを検証することが必要です。
今後の課題として、SAMそのもの、あるいはその代謝産物がどのようにヒトを含む哺乳類の寿命に影響を与えるかを詳しく調べる必要があります。SAMは抗うつ、抗肝臓傷害作用をもつサプリメントとして使われている実績がありますが、その作用機序の多くは不明です。今後、SAMを摂取することにより体内で起こる反応と、その分子機構を詳細に研究することで、より効率的かつ安全な健康・医療への応用が期待されます。
<参考図>
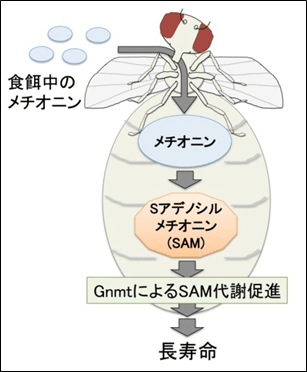
図1 メチオニン代謝と寿命への影響
食餌中に含まれるメチオニンは、体内でSamsによりSAMに変換される。Gnmtは余剰なSAMを代謝して制御する酵素である。Gnmtが活性化しSAM代謝・消費が促進されると長寿になる。
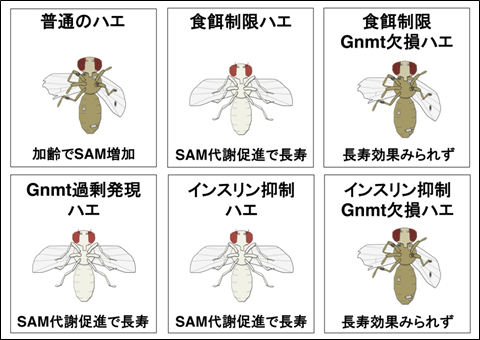
図2 SAM代謝が寿命延長の鍵である
通常のハエでは加齢とともにSAM量が増加していく。このSAM量の増加は、遺伝学的な方法でGnmtを過剰に発現することで抑制でき、このようなハエでは長寿になる。長寿になることが知られている食餌制限や、インスリンシグナルを抑制したハエでは、活性化したFoxOがGnmtの発現を上昇させ、SAM代謝・消費の促進がおこり長寿になる。また、Gnmtを欠損した場合には、SAMが増加し、これらの長寿効果が見られなくなり、短命になる。
<用語解説>
- 注1) SAM
- Sアデノシルメチオニン。必須アミノ酸であるメチオニンの代謝によって合成されて、ポリアミンやシステインの原料となる。活性型メチオニンとも呼ばれ、DNAやRNAなどの核酸や種々のタンパク質のメチル化修飾に必要。
- 注2) Gnmt
- グリシンNメチルトランスフェラーゼ。肝臓に豊富に存在する酵素。アミノ酸であるグリシンにメチル基を付与してサルコシンを合成する反応を担う。この過程でSAMを消費するため、余分なSAMを消費してその量を制御する因子として機能する。ショウジョウバエ、マウス、ヒトには存在するが、線虫には存在しない。
- 注3) FoxO
- 主にインスリンにより制御をうける転写因子で、飢餓ストレスにより活性化してタンパク質合成抑制、脂質代謝を促進するなどの機能をもつ。酸化ストレスによっても活性化され、抗酸化作用のある遺伝子を標的にもつ。寿命延長に関わる転写因子として有名で、ショウジョウバエでは脂肪体組織でFoxOを活性化させるだけで寿命が延長する。
<発表雑誌>
雑誌名:Nature Communications
出版・発行:2015年9月18日(英国時間)
タイトル:“Enhancing S-adenosyl-methionine catabolism extends Drosophila lifespan.”
著者:Obata, F. and Miura, M.*(*:責任著者)
doi: 10.1038/ncomms9332
<お問い合わせ先>
<研究に関すること>
東京大学 大学院薬学系研究科 薬科学専攻 遺伝学教室
三浦 正幸(ミウラ マサユキ) 教授
Tel:03-5841-4860 Fax: 03-5841-4867
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: