心不全、敗血症などの重篤なショック状態により血中乳酸値が上昇することで引き起こされる乳酸アシドーシス注1)は、致死率が約50%と高く、早急な対応が求められる病態です。
この度、慶應義塾大学 医学部の南嶋 洋司 特任講師、壽原(すはら)朋宏 医師(大学院 医学研究科 博士課程)、菱木 貴子 専任講師、笠原 正貴 東京歯科大学 教授らのグループは、乳酸アシドーシスにつながる血中乳酸値の上昇に対して、酸素濃度センサー分子であるプロリン水酸化酵素PHD2注2)を不活性化させることによって、肝細胞がより多くの乳酸を血中から取り込むことで血中乳酸値を低下させるメカニズムを解明しました。
従来、細胞の酸素濃度センサーであるPHD2が不活性化すると、低酸素応答(利用できる酸素が少なくなった時に細胞が見せる応答反応)が活性化して、大量の乳酸が細胞から血中に放出されるとされていました。しかし、今回の研究によって、「肝細胞における低酸素応答は、乳酸の放出を亢進させるのではなく逆に乳酸の取り込みを活性化させる」という、従来の認識を覆す新たな事実を証明しました。
本研究は、JST 戦略的創造研究推進事業の一環として、慶應義塾大学 医学部と米国のハワード・ヒューズ医学研究所およびハーバード大学 医学部 ダナ・ファーバー癌研究所との共同研究で行われました。
本研究成果は、2015年8月31日(米国東部時間)に米国科学雑誌「米国科学アカデミー紀要(PNAS)」オンライン速報版で公開されました。
<研究の背景>
我々の身体には、利用できる酸素が限られた低酸素環境においても生き延びることができるように低酸素応答と呼ばれる低酸素に対する防御システムが備わっています。通常、低酸素応答は、HIF注3)と呼ばれる低酸素応答を制御する主要な転写因子(遺伝子の発現を制御する蛋白質)によって制御されています。このHIFはPHD2によって機能が抑制されているため、PHD2の機能を抑えることで、酸素の有無に関係なくHIFが活性化して低酸素応答を引き起こすことが可能となります(図1)。
細胞内でPHD2が抑制され低酸素応答が活性化すると、細胞は酸素を利用しない糖代謝(嫌気解糖)によって細胞のエネルギーであるアデノシン3リン酸(ATP)注4)を産生し、大量の乳酸が細胞から血中に放出されます。もし全身の細胞でPHD2の機能が低下して低酸素応答が活性化すると、血中に放出される乳酸が激増し、乳酸アシドーシスという致死的な状態に陥ってしまうことになります。ところが、マウスにおいて全身の細胞でPHD2を破壊して低酸素応答を活性化させると、予想に反して血中乳酸値は上昇するどころか野性型マウスと比べて逆に低値であることが分かりました。そこで、体内で血中の乳酸を分解する反応が活発な肝臓に着目しました。
<研究の概要と成果>
細胞のエネルギー代謝が、酸素を使わずにブドウ糖からエネルギーを産生する嫌気解糖に切り替わった結果として筋肉などから血中に放出された乳酸は、血液の流れに乗って肝臓に運ばれ、肝細胞においてブドウ糖に変換(糖新生)され、再び血液の流れに乗って筋肉などに戻され嫌気解糖に利用されて、そこでまた乳酸が産生される、というリサイクル回路(コリ回路)によって制御されていることが古くから知られています。本研究グループは、酸素濃度センサーであるPHD2遺伝子を肝臓でのみ破壊することによって肝臓においてのみ低酸素応答を活性化したマウスを作製し、肝臓における低酸素応答が全身の乳酸の代謝に与える影響を観察しました。
その結果、PHD2遺伝子を肝臓でのみ破壊したマウスにおいては、1時間ほどベルトコンベアの上を走らせることで運動負荷を加えて高乳酸血症を誘導しても、野生型マウスと比較して血中乳酸値は有意に低値であり、また野生型マウスよりも長時間走ることができることを確認しました。さらに、PHD2を肝臓でのみ破壊したマウスでは、致死量の乳酸を腹腔内に投与しても、野生型マウスと比較して血中乳酸値は有意に低値でした。また、血液は酸性(アシドーシス)には傾かずに中性を維持しており、マウスの生存率も劇的に改善することを明らかにしました(図2)。
乳酸アシドーシスは、敗血症などの重篤な疾患などに頻繁に合併し、生命予後を悪化させる大変危険な病態です。そこで本研究グループは、致死量の大腸菌毒素(LPS:リポポリサッカライド)を投与して作製した敗血症モデルマウスに、PHD2の阻害剤を経口投与しました。その結果、PHD2阻害剤を経口投与したマウス群においては、野生型マウスと比較して血中乳酸値の上昇が認められず、かつマウスの生存率の著明な改善が確認できました。経口投与された薬剤は、消化管から吸収されて門脈を経由してまず肝臓に作用するため、この研究結果は肝臓における低酸素応答をPHD2阻害剤などで活性化すると、血中乳酸値を低下させることができることを意味しています。
<研究の意義・今後の展開>
敗血症などの重篤な感染症の治療成績は、血中乳酸値と逆相関するため、重症感染症の治療には乳酸アシドーシスを軽減させることが必須となります。本研究成果は、肝臓におけるPHD2を介した低酸素応答を標的とする全く新しい乳酸アシドーシスの治療法の開発、ひいては重症感染症などの治療成績改善へとつながるものと期待されます(図3)。
<参考図>
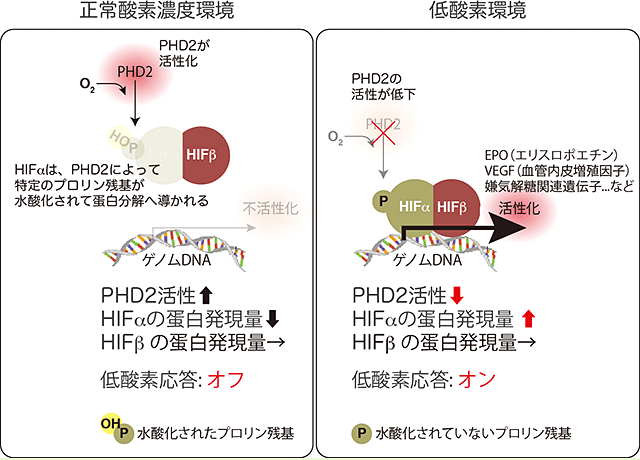
図1 PHD2とHIFによる低酸素応答の制御メカニズム
正常酸素濃度環境では、活性化したPHD2によって特定のプロリン残基が水酸化されたHIFαは蛋白分解へと導かれるため、低酸素応答はオフとなる(左)。
一方で低酸素環境においては、酵素反応に酸素(O2)を必要とするPHD2の酵素活性は低下し、プロリン水酸化による蛋白分解を免れたHIFαは蛋白発現量が上昇してHIFβと二量体を形成し、様々な低酸素関連遺伝子の転写を活性化する(右)。
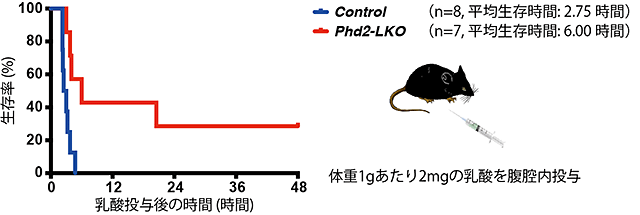
図2 肝臓でのPHD2不活性化による致死的乳酸負荷後の生存率の劇的な改善
肝臓特異的にPHD2遺伝子を破壊したマウス(Phd2-LKO)においては、野生型マウス(Control)と比較して致死量の乳酸(2mg/g・BW)を腹腔内に投与した後の生存率が有意に高いことが分かる(Log-rank test,p=0.0055)。
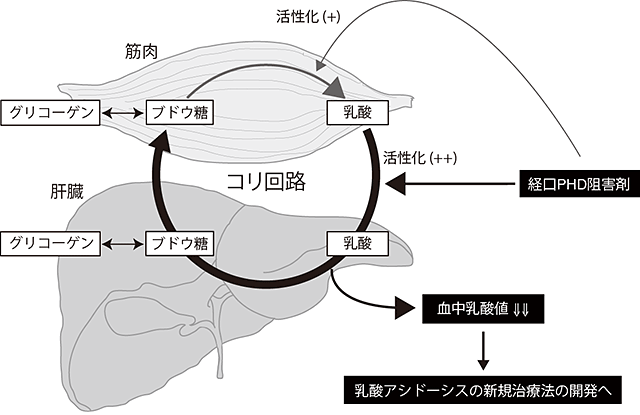
図3 低酸素応答による肝臓内でのコリ回路の活性化
肝臓で低酸素応答を活性化させると、血中の乳酸を肝細胞に取り込み、そこからブドウ糖を合成(糖新生)し、新たに合成されたブドウ糖を血中へと戻すという「コリ回路」の肝臓側の機能が活性化すことが証明された。
<用語解説>
- 注1) 乳酸アシドーシス
- 血中乳酸値が5mM以上に上昇し、動脈血のpHが7.35未満にまで低下した危険な状態。血液が酸性に傾き、様々な臓器障害を引き起こす致死的な病態である。敗血症などの重症感染症にしばしば合併し、患者の生存率を低下させる重要な予後規定因子である。
- 注2) PHD:prolyl hydroxylase domain-containing protein.
- 低酸素環境に順応するために必要な遺伝子の発現制御を司る転写因子HIFの、ある特定のアミノ酸プロリン残基を水酸化する酵素。酵素活性に酸素や鉄を必要とする。通常酸素濃度環境では、HIFのα–サブユニット(HIFα)の特定のプロリン残基を水酸化して蛋白分解へ導くことによって低酸素応答を抑制しているが、酸素濃度が低下すると酵素活性を失うため、HIFαは蛋白分解を免れて蛋白発現量が急激に増加し、HIFβと結合して低酸素環境下で必要な遺伝子群の転写を活性化する。すなわち、PHDはHIFを介した低酸素応答のオン・オフを決定するスイッチ役として機能する「細胞内酸素濃度センサー」である。3つあるPHD遺伝子のうち、生体内ではPHD2が主要なHIFαのプロリン水酸化酵素である。
- 注3) HIF:hypoxia-inducible factor.
- 低酸素環境で必要な遺伝子を発現させる転写因子。αとβの2つのサブユニットから形成されるが、このα–サブユニット(HIFα)は、正常酸素濃度環境ではプロリン水酸化酵素PHD1~PHD3(主にPHD2)によって特定のプロリン残基が水酸化され、それを指標にHIFαは蛋白分解へと導かれるため、正常酸素濃度環境下では転写因子としては機能しない。しかし、酸素濃度が低下すると、酵素活性に酸素を必要とするPHD2は酵素活性を失うため、分解を免れたHIFαはβ–サブユニット(HIFβ)と結合して二量体を形成し、造血因子エリスロポエチン(EPO)や血管内皮増殖因子(VEGF)などの低酸素関連遺伝子を転写する。HIFβは1つの遺伝子しか同定されていないが、HIFαは哺乳動物ではHIF1α、HIF2α、HIF3αの3つの遺伝子が同定されており、発現している臓器・転写ターゲット・転写活性がそれぞれ異なる。
- 注4) アデノシン3リン酸(ATP:adenosine triphosphate)
- 我々の身体の細胞が行う生命活動に必須なエネルギー源であり、しばしば「エネルギー通貨」とも呼ばれる。ATPに含まれる高エネルギーリン酸結合が加水分解される際にエネルギーを放出し、筋肉の収縮などの様々な反応に利用される。
<特記事項>
本研究成果は主に以下の事業・研究領域・研究課題によって遂行されました。
■MEXT/JSPS科学研究費助成事業 20593966,24659154,26111006
■JST 戦略的創造研究推進事業
<論文について>
| タイトル(和訳) |
“Inhibition of the oxygen sensor PHD2 in the liver improves survival in lactic acidosis by activating the Cori cycle”
(肝臓における低酸素応答はコリ回路の活性化を介して乳酸アシドーシスの生存率を改善する~低酸素センサーPHD2を標的とした新たな乳酸アシドーシス治療法の開発へ~) |
| 著者名 |
壽原 朋宏、菱木 貴子、笠原 正貴、早川 典代、小柳 津智子、中西 豪、久保 亜紀子、森崎 浩、William G.Kaelin Jr.、末松 誠、南嶋 洋司 |
| ※本論文は平成26年度の研究成果を報告したものです。 |
| 雑誌名 |
「米国科学アカデミー紀要(PNAS:Proceedings of the National Academy of Sciences of the United States of America)」オンライン速報版 |
| doi |
10.1073/pnas.1515872112 |
<お問い合わせ先>
<研究に関すること>
慶應義塾大学 医学部 医化学教室
南嶋 洋司(ミナミシマ ヨウジ) 特任講師
〒160-8582 東京都新宿区信濃町35番地
Tel:03-5363-3753 Fax:03-5363-3466
E-mail:
https://www.jst.go.jp/erato/suematsu/
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
慶應義塾大学 信濃町キャンパス総務課 吉岡、三舩
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:
http://www.med.keio.ac.jp/
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: