ポイント
- 肥満によって自己免疫疾患を含む炎症性疾患の発症リスクが高まると言われていたが、そのメカニズムは不明であった。
- 肥満患者に高発現する脂肪酸合成酵素「ACC1」が自己免疫疾患を悪化させる分子メカニズムを解明しました。
- ACC1を制御すれば、肥満によって引き起こされる自己免疫性炎症疾患の治療への道が開けると期待される。
JST 戦略的創造研究推進事業において、千葉大学 医学研究院の遠藤 裕介 特任講師、中山 俊憲 教授らのグループは、同大学医学研究院の細胞治療内科学 横手 幸太郎 教授のグループと共同で、肥満患者に高発現している脂肪酸合成酵素「ACC1」が自己免疫疾患注1)を引き起こす作用があることを発見しました。
食習慣、生活習慣の変化や運動不足に伴い世界規模で“肥満”患者が増加しています。肥満、特に内臓脂肪蓄積を伴う肥満症注2)は、糖尿病、脂質異常症、高血圧などのいわゆる生活習慣病と密接に関わっており、今後の医療問題の根本とも考えられます。肥満関連疾患というと糖尿病や動脈硬化性疾患が注目されがちですが、自己免疫疾患、慢性の気道炎症疾患である喘息、がんなどの免疫担当細胞と関わりの深い疾患の発症リスクが高まることも明らかになってきています。
本研究グループは、肥満環境下のCD4陽性ヘルパーT(Th)細胞注3)に脂肪酸代謝の律速酵素注4)であるACC1が高発現していることを見いだしました。また、慢性のステロイド抵抗性気道炎症や自己免疫疾患を引き起こすTh17細胞の割合とACC1の発現レベルに相関関係があることを肥満患者検体で発見しました。さらに、ACC1は脂肪酸合成経路を活性化し、Th17細胞のマスター転写因子であるRORγtの機能を制御することで、Th17細胞分化を促進するという新たな仕組みを解明しました。今後、ACC1やACC1が制御している脂肪酸合成経路を創薬ターゲットとすることで、将来的に肥満関連疾患の治療開発に役立つことが期待されます。
本研究成果は、2015年7月30日(米国東部時間)発行の米国科学誌「Cell Reports」オンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。なお、平成27年4月1日に日本医療研究開発機構(AMED)が設立されたことに伴い、本研究課題はAMEDに承継され、引き続き研究開発の支援が実施されます。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」
(研究総括:宮坂 昌之 大阪大学 未来戦略機構 特任教授) |
| 研究課題名 |
「気道炎症の慢性化機構の解明と病態制御治療戦略の基盤構築」 |
| 研究代表者 |
中山 俊憲(千葉大学 大学院医学研究院 教授) |
| 研究期間 |
平成23年10月~平成29年3月 |
<研究の背景と経緯>
肥満人口は世界規模で見ても増加の一途をたどっています。日本では、肥満症(健康障害を伴う肥満)の診断基準が2001年に、内臓脂肪の蓄積を基盤としてさまざまな代謝異常をもたらすメタボリックシンドローム注5)の診断基準が2005年に策定されています。内臓脂肪蓄積を伴う肥満症の特徴として、脂肪組織で慢性炎症が生じており、糖尿病や動脈硬化症などの心血管系疾患の一因となっています。肥満関連疾患というと糖尿病や動脈硬化性疾患が注目されがちですが、自己免疫疾患、喘息、がんといった免疫担当細胞と関わりの深い疾患の発症リスクが高まることも明らかになってきています(図1)。
ここ数年の研究から、免疫システムと代謝システムを担う細胞の相互作用により肥満関連疾患の病態が悪化することが明らかになりつつあります。例えば肥満環境下で、Thサブセットの1つであるTh17細胞が増加し、一方、免疫反応の収束や抑制に関わるTreg(Regulatory T)細胞が減少するということが報告されています。Th細胞は免疫反応の司令塔ともいえる細胞であり、産生するサイトカイン注6)の種類によって、Th1、Th2、Th17細胞およびTreg細胞の少なくとも4種類に分類されます(図2)。このように、肥満誘導性の病態と免疫システムの司令塔であるTh細胞との間に関連性が示されていますが、どのような分子が、またどのようなメカニズムでTh細胞の質的変化を引き起こし、病態を増悪化させているかについてはいまだ不明のままです。
本研究グループは、肥満環境のTh細胞の動態変化に焦点をあてて研究を行い、その質の変化をコントロールする因子を探索し、肥満誘導性の病態との関連性および誘導メカニズムを明らかにすることを目的として研究を行いました。
<研究の内容>
本研究グループは、肥満環境下にあるTh細胞は遺伝子レベルで変化があるのではないかという仮説を立て、野生型および高脂肪食付与による肥満マウス由来のCD4陽性ヘルパーT細胞を用いてゲノムワイドマイクロアレイ解析注7)を行いました。その結果、肥満マウス由来のCD4T細胞では、脂肪酸合成の律速酵素であるACC1の発現が優位に上昇していました。
肥満病態のACC1の役割について調べるため、ACC1の競合阻害剤であるTOFA注8)を用いてTh17細胞誘導性の自己免疫疾患動物モデルである実験的自己免疫性脳脊髄炎(EAE)注9)をマウスに発症させ解析を行いました。野生型マウスと比較して、肥満マウスではEAEの病態の増悪化、および中枢神経系に浸潤するTh17細胞の増加が認められましたが、TOFAの投与により、病態が改善されました(図3)。つまり、ACC1を抑えることにより、Th17細胞分化が抑制され、自己免疫性の炎症が制御できることが明らかになりました。
ACC1のTh17細胞分化に対する役割を解析するため、ACC1欠損マウスを用いて検討を行いました。ACC1欠損マウス由来のCD4T細胞では、Th17細胞分化能は著しく抑制されました(図4)。ACC1がTh17細胞分化を誘導する分子メカニズムについても検討を行いました。その結果、ACC1はTh17細胞のマスター転写因子RORγtの発現ではなく機能をコントロールすることでTh17細胞分化を制御していることが分かりました(図5)。また、ACC1によるRORγtの機能制御には、Th17細胞の脂肪酸合成が鍵となっていることが明らかになりました。
さらに、肥満環境下でのACC1誘導性のTh17細胞分化の重要性をより詳細に検証するため、高度肥満患者注10)(BMI35以上)の末梢血を用いて解析を行いました。健常者と比較して、高度肥満患者の末梢血中ではTh17細胞が2~3倍増加しており、同様に、ACC1の発現増加も認められました。また、興味深いことに、肥満患者のACC1の発現レベルはTh17細胞の割合と相関関係にあることが分かりました(図6)。
<今後の展開>
脂肪酸合成酵素ACC1は肥満環境下で、Th17細胞誘導性の自己免疫疾患を増悪化させていたことから、肥満における自己免疫性炎症疾患のドライバー因子であると言えます(図7)。また、今回の研究結果から、ACC1は脂肪酸合成経路を活性化し、Th17細胞のマスター転写因子であるRORγtの機能をコントロールすることで、Th17細胞分化を誘導するという新たな分子メカニズムが解明されました。今後、どの脂肪酸代謝物がRORγtの活性化に必須であるかを探索することで、Th17細胞による炎症性疾患の予防、新規診断マーカー、治療に結びつく可能性が広がると考えられます。
肥満患者のCD4T細胞において、ACC1の発現レベルとTh17細胞の割合に相関が認められたことから、ACC1は自己免疫疾患を含む肥満誘導性の炎症性疾患のリスク因子であると考えられます。今後、ACC1やACC1が制御している脂肪酸合成経路を創薬ターゲットとすることで、将来的に肥満関連疾患の治療開発に役立つことが期待されます。
<参考図>
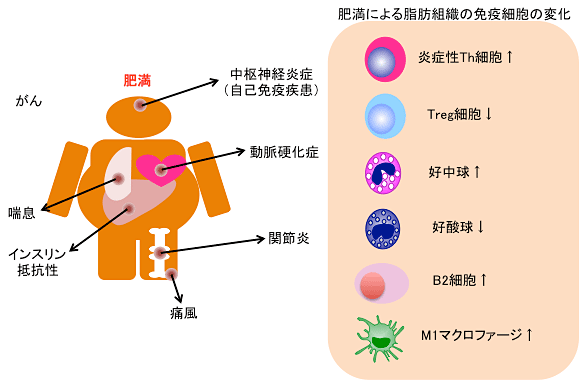
図1 免疫担当細胞が関与する肥満誘導性炎症疾患
肥満によって発症リスクが上昇する疾患の中でも特に免疫細胞が関係する炎症性疾患についてまとめた(左図)。また、肥満脂肪組織中の免疫担当細胞の変化について示した(右図)。
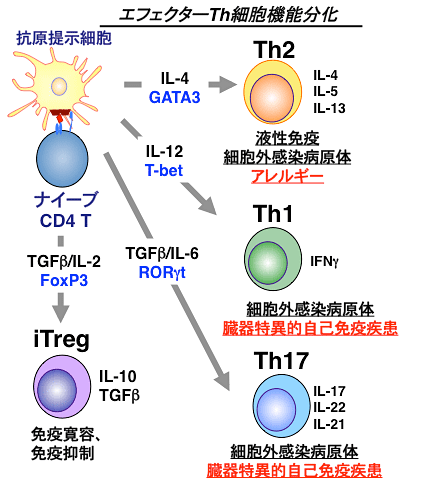
図2 ヘルパーT細胞(Th1/Th2/Th17/Treg細胞)の分化と免疫応答・疾患
ナイーブCD4T細胞は、抗原提示細胞が提示する抗原によって活性化され、周囲の環境中にあるサイトカインなどの影響によりさまざまな種類のヘルパーT細胞へと分化する。図中に、各ヘルパーT細胞の種類、分化に必要なサイトカインなどの因子、細胞自身が分泌するサイトカイン、関係する疾患を示した。
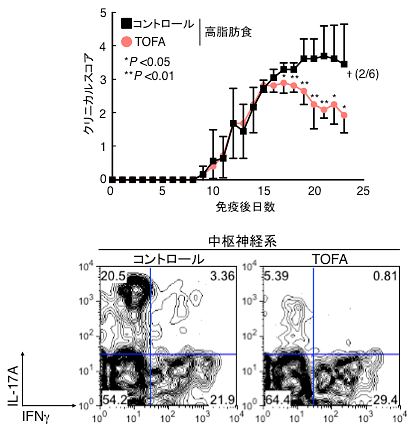
図3 TOFAによる肥満依存的EAE病態の抑制
TOFAの投与により、肥満誘導性の実験的自己免疫性脳脊髄炎の病態が改善された(上図)。†は病態悪化により死亡したマウス数を示している。コントロール群では2匹のマウスが死亡したが、TOFA投与群では0匹であった。中枢神経系に浸潤するTh17細胞の割合もTOFAの投与により著しく抑制された(下図)。
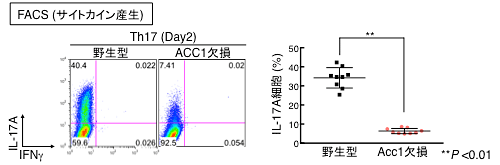
図4 ACC1欠損マウス由来のTh細胞はTh17細胞分化の抑制が見られる
野生型とACC1欠損型マウス由来のTh17細胞から分泌されるサイトカイン産生パターンについての結果を示す(左図:FACSプロット、右図:複数検体のまとめ)。
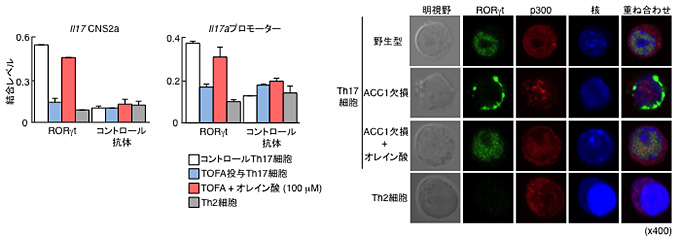
図5 ACC1の阻害によりRORγtの機能抑制が認められる
RORγtのIL-17遺伝子座への結合能をChIPアッセイにより評価した。Th17細胞にTOFAを添加し、ACC1の機能を阻害したところ、RORγt結合サイトのあるIl17CNS2aおよびIl17aプロモーター領域へのRORγtの結合低下が認められた(左図)。RORγtの細胞内の局在について免疫染色法で検討を行った(右図)。野生型マウス由来のTh17細胞ではRORγtとp300が核内で共局在するのに対して、ACC1欠損マウス由来のTh17細胞ではp300との局在も認められず、RORγt自体の局在が核の表面に認められた。ACC1欠損マウス由来のTh17細胞に一価の不飽和脂肪酸であるオレイン酸を添加することにより、RORγtの局在は野生型由来のTh17細胞に戻ることが示された。
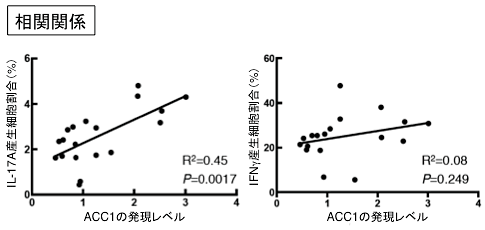
図6 肥満患者におけるACC1の発現レベルとIL-17A産生細胞割合
肥満患者のIL-17A注11)産生細胞、IFNγ産生細胞の割合とCD4T細胞中のACC1の発現レベルについての相関関係を示した。ACC1の発現のレベルはIL-17A産生細胞の割合と非常に良い相関関係にあることが分かったが、IFNγ産生細胞の割合とはほとんど相関しないことが示された。
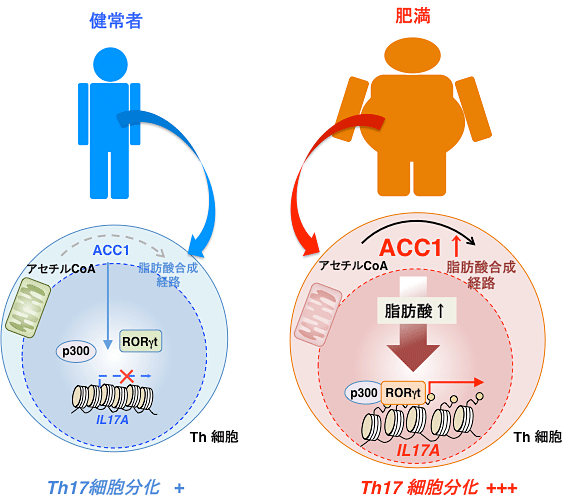
図7 肥満によるACC1の発現上昇はTh17細胞分化を促進する
健常者のTh細胞ではACC1の発現レベルは低く抑えられており、脂肪酸合成経路も活発には行われておらず、RORγtの活性化を介したTh17細胞分化も過剰には誘導されない(左図)。肥満患者ではTh細胞におけるACC1の発現が増加しており、脂肪酸合成経路を活性化させることでRORγt依存的なTh17細胞分化が誘導され、さまざまな自己免疫性疾患の発症リスクが上昇する(右図)。
<用語解説>
- 注1) 自己免疫疾患
- 本来、異物を認識し排除するための役割をもつ免疫システムが、自分自身の正常な細胞や組織に対して過剰に反応し、症状を起こす疾患の総称を指す。大きく分けて、全身にわたり影響が及ぶ全身性自己免疫疾患とある臓器のみに症状が現れる臓器特異的自己免疫疾患の2つがある。
- 注2) 肥満症
- 脂肪組織が過剰に蓄積した状態を肥満と呼び、わが国ではBMI25kg/m2以上と定義している。肥満に起因ないし関連する健康障害を合併するか、その合併が予測される場合を特に肥満症と呼び、医学的に減量を必要とする疾患単位として取り扱う。肥満に起因ないし関連し、減量を要する健康障害には、耐糖能障害や脂質異常症、冠動脈疾患のほか、睡眠時無呼吸症候群などの疾患が含まれる(日本肥満学会.肥満症診断基準2011)。
- 注3) ヘルパーT(Th)細胞
- 白血球の一種でB細胞とともにリンパ球に分類される。T細胞はさらにキラーT細胞とヘルパーT細胞に分類され、前者はがん細胞やウイルスに感染した細胞などを攻撃し排除する。後者はサイトカインと呼ばれる液性因子を分泌し、B細胞やキラーT細胞の働きを助ける役割を担う。
- 注4) 律速酵素
- 生体内で複数の酵素が関与して特定の物質を代謝する際に、一連の酵素群の中でもっとも酵素活性量が少なく、そこの反応系全体の速さを決めている酵素。
- 注5) メタボリックシンドローム
- 糖尿病、脂質異常症、高血圧といった、いわゆる生活習慣病は、お互いに合併しやすく、その発症には内臓脂肪の蓄積(内臓型肥満)が密接に関わっている。メタボリックシンドロームとは、内臓脂肪型肥満に高血糖、高血圧、脂質異常症のうち2つ以上を合併した状態のことを指す。メタボリックシンドロームの状態では、脳卒中や心筋梗塞などの心血管系疾患の発症リスクが数倍に増加する。
- 注6) サイトカイン
- 細胞が分泌する液性因子であり、細胞間の情報伝達を仲介する。なかでもインターロイキン(IL)と呼ばれる一連のグループは主に免疫系の細胞から分泌され、免疫系が正常に働くために重要である。
- 注7) ゲノムワイドマイクロアレイ解析
- 多数のDNA断片(DNAプローブ)をガラスもしくはシリコン基板上に配置したDNAチップを用い、細胞内の遺伝子発現量を網羅的に測定する解析手法。細胞から抽出したメッセンジャーRNA(mRNA)を用い、逆転写によって合成したcDNAとDNAプローブをハイブリダイゼーションさせることで細胞内に発現している数万個の遺伝子情報を解析することが可能である。
- 注8) 5-(テトラデシルオキシ)-2-フロ酸(5-(Tetradecyloxy)-2-furoic acid:TOFA)
- アセチルCoAカルボキシラーゼ(ACC1)の強力かつ可逆的な競合阻害剤であり、細胞透過性を示す。
- 注9) 実験的自己免疫性脳脊髄炎(Experimental Autoimmune Encephalomyelitis:EAE)
- EAEは、中枢神経組織由来のタンパク質抗原やペプチドを免役することによって誘導される自己免疫疾患動物モデルである。多発性硬化症と多くの病態を共有することから、その病態研究に多く使用される。アジュバントとして百日咳毒素が用いられるのが一般的である。従来はIFNγを産生するTh1細胞誘導性の病態であると考えられていたが、最近ではTh17細胞誘導性の病態であるとする考え方が主流となっている。
- 注10) 高度肥満患者
- 日本において肥満はBMIの値により4段階(BMI25-30:1度肥満、BMI30-35:2度肥満、BMI35-40:3度肥満、BMI40-:4度肥満)に分類されている。その中でもBMI35以上の肥満は高度肥満と定義される。日本では全人口のおよそ0.2-0.5%程度が高度肥満と推測されている。通常の肥満でも、生活習慣病をはじめとしてさまざまな疾患の危険因子となるが、高度肥満の状態ではさらに循環器・呼吸器系などに重篤な合併症を生じるリスクが高く、また難治性である場合が多いことから、重要な診断・治療の対象として位置づけられている。
- 注11) IL-17A
- IL-17Aは主にTh17細胞より産生される炎症性サイトカインの一種である。標的細胞として上皮細胞、線維芽細胞、ケラチノサイト、内皮細胞、マクロファージなどが挙げられる。標的細胞に働きかけ、炎症性サイトカインやケモカイン産生を促すことで炎症反応を誘導する。
<論文タイトル>
“Obesity Drives Th17 Cell Differentiation by Inducing the Lipid Metabolic Kinase, ACC1”
(肥満は脂肪酸合成酵素を誘導することによりTh17細胞分化を促進する)
doi :10.1016/j.celrep.2015.07.014
<お問い合わせ先>
<研究に関すること>
中山 俊憲(ナカヤマ トシノリ)
千葉大学 大学院医学研究院 免疫発生学(H3) 教授
〒263-8522 千葉県千葉市中央区亥鼻1-8-1
Tel:043-226-2185 Fax:043-227-1498
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
千葉大学 企画総務部 渉外企画課 広報室
Tel:043-290-2019 Fax:043-284-2550
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: