名古屋工業大学 大学院未来材料創成工学専攻 ナノ・ライフ変換科学分野およびオプトバイオテクノロジーセンターの神取 秀樹 教授、井上 圭一 助教らのグループは、光のエネルギーを使ってナトリウムイオン(Na+)を細胞から汲み出す新しいタンパク質(ナトリウムポンプ型ロドプシン:NaR)について、謎とされていたNa+の輸送メカニズムの全体像を明らかにしました。
今回の発見をもとにタンパク質のNa+輸送を制御できれば、脳神経研究などの応用が可能になり、様々な脳神経疾患へ治療法の開発に寄与すると期待されます。また神取教授らはこれらの知見をもとにNa+以外のイオンを輸送することにも成功しており、将来的には光のエネルギーを使って神経細胞からリチウムイオン(Li+)を輸送する新しいうつ病の治療法の開発や、環境中のセシウムイオン(Cs+)などを除去する技術にもつながる可能性があります。
本研究の成果は、注目度の高い欧州化学誌であるAngewandte Chemie International Edition誌のオンライン版に近日中に掲載されることが決定しています。
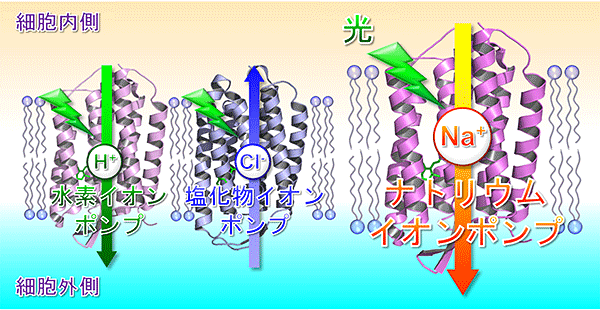
細菌など微生物が持つ、光でイオンを輸送するタンパク質(微生物型ロドプシン)
これまで知られていた、光で水素イオン(左)や塩化物イオン(中央)を輸送するロドプシンと最近神取グループより発見された、光でナトリウムイオンを輸送するロドプシン(右)。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業、日本学術振興会 科学研究費補助金(若手研究(A))の一環として行われました。
■ ナトリウムポンプ型ロドプシン:NaRの特徴
タンパク質は生物に固有の物質であり、生命活動の基盤となるタンパク質は10万種類以上もあります。その合成は生きた細胞の中で行われ、合成されたタンパク質は生物の構造そのものや酵素などとして生命現象の発現に利用されます。
1971年に、太陽光エネルギーを使って水素イオン(H+)を細胞の中から外へ輸送するという全く新しいタイプのタンパク質がある種類の細菌から見つかり、1977年には塩化物イオン(Cl-)を細胞内へ取り込むタンパク質も発見されました。これら光のエネルギーを使ってイオンを輸送するタンパク質はロドプシンと呼ばれています。しかし、生体にとっては重要なイオンの1つであるナトリウムイオン(Na+)を運ぶロドプシンは、その後の長い研究の中でも見つかっていませんでした。Na+の輸送は神経興奮など生物活動にとって極めて重要な機能ですが、細菌はNa+の輸送のためには太陽光エネルギーを使わない、というのがこれまでの定説になっていました。
しかし神取教授のグループは2013年に海洋にすむ細菌から新たにポンプのようにNa+を輸送するタンパク質を発見し、ナトリウムポンプ型ロドプシン(NaR)と名付けました。そしてこの発見は生物界の常識を覆すものとして、大きな注目を浴びました。
■ ナトリウムポンプ型ロドプシンの謎
極めて新しい分子として注目されているNaRですが、それには発見当時から大きな謎があることが知られていました。というのも神取グループで発見されたナトリウムポンプ型のものを含め、ロドプシンは光を吸収するためにレチナールと呼ばれる色素分子と必ずタンパク質内部で結合しています。そしてこのレチナールは必ず水素イオン(H+)と結合しており、そのH+はちょうどロドプシンがイオンを輸送するときにイオンが通る、狭い穴の途中に存在しています。H+は+の電気を帯びているため、同じく+の電気を持つNa+との間には大きな反発力が生じ、Na+がタンパク質内部を通過する上で大きな障害となってしまうはずです(図1)。
これらの理由から40年以上のロドプシンの研究においてNa+を輸送するロドプシンは存在しないとさえ考えられてきました。神取教授らがNaRを発見した後も、このタンパク質が他のロドプシンと同様にH+を結合しているにも関わらず、どのようにしてNa+を輸送しているのかは大きな謎とされていました。そこで今回神取教授と井上助教らのグループは光を吸収した後、タンパク質がNa+を輸送する様子を、レーザーを用いた高速の観察技術やバイオテクノロジーを用いて調べることにより、これまで謎とされていたNaRによるNa+輸送のメカニズムの解明に挑みました。
■ ナトリウムポンプ型ロドプシンのNa+輸送メカニズム
NaRのNa+輸送メカニズムを調べるため、まず神取教授らは研究に必要なNaR試料の作製に取り組みました。本来NaRは海洋にすむ細菌の細胞中に存在しますが、海洋性の細菌は飼育が難しく、さらにそこに含まれるNaRも非常に微量であるため、その性質を調べることが非常に困難です。そこで神取教授らは飼育が容易な大腸菌を用いて、海洋性の細菌の持つものと全く同じNaRを作り出すことに着手しました。そのためにまず海洋性細菌の持つDNAの一部を大腸菌の細胞内に組み込みました。タンパク質であるNaRは数百個のアミノ酸が連なった構造を持っていますが、このDNAにはそのつながり方の情報が全て保存されており、DNAが導入された大腸菌はその情報をもとにNaRを細胞内に作り出すことができるようになります。そして神取教授らは大腸菌を用いて大量のNaRタンパク質を人工的に作り出すことに成功しました(図2)。
そして次に、得られたNaRがどのようにしてNa+を輸送するのか、その様子を詳細に調べることで、これまで謎とされていた輸送メカニズムの解明に取り組みました。しかしNaRによるNa+の輸送は1000分の1秒といった非常に短い時間で起こるため、通常どのようにNa+がタンパク質内部を輸送されているのかを観察することはできません。そこで本研究では2億分の1秒というNaRがNa+を輸送するよりも圧倒的に速い時間でレチナールの異性化を引き起こし、分子の光反応を開始させることができる「超短パルスレーザー」とタンパク質の色の変化を超高速で観察できる「高速カメラシステム」を用いて、Na+の輸送過程においてNaRにどのような変化が起こるのかを調べました。
その際にまず神取教授らはNa+の輸送を阻害しているH+のすぐそばに、アスパラギン酸とアスパラギンという2つの特徴的なアミノ酸が存在することに着目しました。この位置にこれらのアミノ酸が存在するのは数あるロドプシンの中でNaRだけが持つ特徴であり、それには何か特別な理由があると考えられました。そこでNaRにレーザー光を照射し、Na+の輸送過程の観察を試みたところ、まず初めに光を吸収すると共にタンパク質内部のレチナールの構造が変化することが分かりました。その後40万分の1秒という非常に短い時間の間に、Na+の通過を邪魔していたレチナール上のH+がNaR上のアスパラギン酸へと移動し、さらにアスパラギン酸の向きが変化することで完全にNa+の通過する経路からH+が取り除かれることが明らかになりました。
そしてそれに引き続き、1000分の1秒の時間で、Na+が細胞の内側から、タンパク質内部に侵入する様子が観察されました。この時Na+が容易にタンパク質内部に入り込むことができるよう、もう1つの特徴的なアミノ酸であるアスパラギンがNa+を強くひきつけます。そして興味深いことに、Na+がアスパラギンに結合すると、H+が結合したアスパラギン酸が再び元の位置に戻り、Na+の通ってきた経路をふさぐことが明らかになりました。これによりNa+は元来た経路を戻って細胞の内側に戻ることができなくなり、最終的に細胞の外側に出て行くことになります。このようにしてNaRは光のエネルギーを使って、レチナールの構造を変え、さらに自身の持つ2つのアミノ酸を巧みに使うことでNa+の輸送を行っているという全体像が初めて明らかになりました(図3)。
これによって40年以上にわたって議論が行われてきたロドプシンによるNa+の輸送のメカニズムが極めて詳細に明らかとなりました。
■ 今後の展望:医療・環境問題へのロドプシンの利用に向けて
今回の研究によりNaRがどのようなメカニズムでNa+を輸送しているのかが初めて明らかになりました。Na+は様々な生き物の体の中で重要な役割を持ち、例えば動物の脳などの神経細胞では、Na+が移動することで神経の興奮が引き起こされます。これに対し今回の発見をもとにNa+の動きをNaRで制御できれば脳神経回路の動作メカニズムの研究への応用が期待されます。また神取教授らはこれらをもとに人工的にNaRのタンパク質構造を改変することで、Na+以外のイオンについても光を使って輸送することができるようになるのではないかと考えています。例えば本来NaRのタンパク質内部に存在する穴は非常に小さいため、Na+よりもサイズが大きいカリウムイオン(K+)をNaRは輸送することができませんが、神取教授らは既に今回明らかになった穴を大きくすることでK+を輸送する分子の作製にも成功しています。
その他にもうつ病の治療ではリチウムイオン(Li+)を患者の体内に投与しますが、大量に蓄積すると副作用が生じることが分かっています。NaRはLi+を輸送することもできるため、今回の結果をもとに、よりLi+の輸送能力の高い分子を作り出すことができれば、そのような副作用の改善に役立つと考えられます。また福島原発の事故以来、海水中などに含まれる放射性セシウムイオン(Cs+)が大きな環境問題となっています。これについてもCs+を輸送することができるロドプシンを設計することで、光というクリーンなエネルギーを使って回収・除染することが可能になると考えられ、環境問題にも今回の発見が大きく貢献することが期待されます。
<参考図>
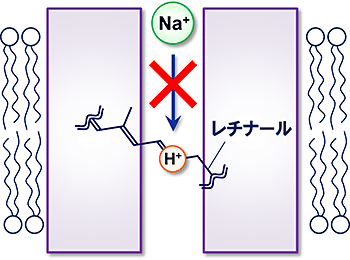
図1 レチナールに結合した水素イオン(H+)はナトリウムイオン(Na+)の輸送を阻害すると予想される。
図2 大腸菌を用いて合成されたNaR
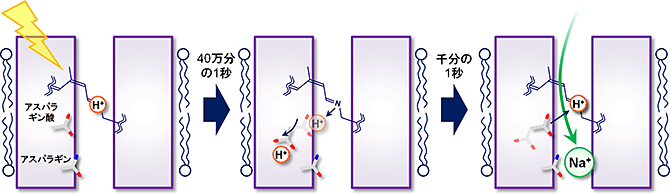
図3 今回明らかになったNaRによるNa+移動のメカニズム
光を吸収するとNaRの中のレチナールの構造が変化し(左)、その後Na+の輸送を邪魔していたH+が隣にあるアスパラギン酸に移動し、さらにアスパラギン酸が方向を変えることでNa+が通るための穴がタンパク質内に40万分の1秒という速さで開く(中央)。そして1000分の1秒の時間でNa+がタンパク質内を通過し、再びアスパラギン酸からH+が最初の位置に戻って、開いた穴が元に戻る(右)。
<お問い合わせ先>
<研究に関すること>
名古屋工業大学工学研究科 未来材料創成工学専攻 ナノ・ライフ変換科学分野
神取 秀樹(カンドリ ヒデキ)
Tel/Fax:052-735-5207
E-mail:
井上 圭一(イノウエ ケイイチ)
Tel/Fax:052-735-5224
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: