ポイント
- 特異性注1)の高い人工の酵素活性の設計は難しく、特定の非天然化合物だけを生合成する経路の構築は困難であった。
- 目的物を高い選択性で生産する人工生合成経路を構築する新手法「メタボリック・フィルタリング」を開発し、非天然化合物の生合成で新手法の有効性を実証した。
- さまざまな人工生合成経路に利用可能で、各種の非天然化合物の生合成に道を開いた。
JST 戦略的創造研究推進事業において、千葉大学の梅野 太輔 准教授らは、合成生物学と酵素の進化分子工学注2)の技術を用いて新しい代謝経路構築の方法論を開発し、非天然アスタキサンチン注3)を生産する人工生合成経路の構築に成功しました。
近年、医薬品や工業用化学物質など、自然界に存在しない有用物質(非天然化合物)を生物内で合成させる人工生合成経路の構築が望まれています。非天然化合物を作るには、天然には存在しない酵素反応ステップが必要です。酵素工学の進歩により、既存の酵素に新たな酵素活性を持たせることは可能になりつつありますが、その新しい活性のみを選択的に触媒する酵素(特異的な酵素)を作ることは、はるかに困難な課題です。人工の酵素活性が十分に特異的でない場合、それらをいくつも組み合わせて長い人工生合成経路を構築すると、各ステップで副産物への経路が生じるため実用化が困難です。梅野准教授らは、非特異的な酵素活性の「重ね合わせ」の妙によって経路全体の選択性を作り出す「メタボリック・フィルタリング」という手法を考案し、その有効性を実証しました。
高い抗酸化作用を持つ非天然化合物であるC50アスタキサンチンを生合成するため、全15ステップの人工経路をデザインしました。しかし、人為的に改変した酵素を共発現させただけでは、大量の副産物が得られただけで、目的のC50アスタキサンチンは検出さえできませんでした。そこで、人工生合成経路の上流と下流で、ある酵素の生産物選択性と次のステップの基質選択性が「部分的に」重なるように組み合わせることを試みました。すると、特異性の低い酵素だけからなるにもかかわらず、95%もの選択性でC50アスタキサンチンを作る人工生合成経路を構築できました。本研究成果は、さまざまな人工生合成経路に応用することが可能であり、これまで不可能だった非天然化合物の産生に貢献することが期待されます。
本研究は、千葉大学の古林 真衣子 大学院生(現 MIT研究員)、日本医科大学の高市 真一 准教授、生産開発科学研究所の眞岡 孝至 博士、名古屋大学の邊見 久 准教授らと共同で行ったものです。本研究成果は、2015年7月14日(英国時間)に英国科学誌「Nature Communications」のオンライン速報版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出」
(研究総括:松永 是 東京農工大学 学長) |
| 研究課題名 |
「超高効率でイソプレノイド燃料をつくる藻類の創製」 |
| 研究者 |
梅野 太輔(千葉大学 大学院工学研究科 准教授) |
| 研究期間 |
平成23年10月~平成27年3月 |
<研究の背景と経緯>
近年、非天然化合物の持つ有用な生理活性の利用を目的に、人工生合成経路を作り出す研究が盛んですが、その多くは天然の生合成経路に人工的なステップを1~2足したもので、これ以上人工のステップを足すことは非常に困難でした。これは、長い人工生合成経路には、開発に多大な手間を要する非天然の酵素活性を数多く必要とすること、開発した一つ一つの酵素活性に十分な特異性を与えることが現在の酵素工学技術では極めて困難であること、という2つの理由によります。
<研究の内容>
化粧品や抗酸化剤などの材料に使われるカロテノイド注4)は、炭素数40(C40)の骨格を持つ天然色素であり、光合成における光捕捉機能や光障害からの防御などに重要な役割を果たします。その構造と機能を多様化・拡張できれば、色素としての守備範囲を広げるだけではなく、新たな生理活性を持つ物質群の発見に結びつくと期待されます。例えば、C40よりも大きな非天然型の骨格を持つカロテノイド類似化合物は天然物を超える抗酸化機能を持つことが示されています。
梅野准教授らは、このような非天然カロテノイドであるC50アスタキサンチンの生合成に挑みました。これには自然界には存在しない多くの酵素活性が必要であり、まず図1の赤い矢印に示す6酵素15ステップの新規酵素反応をつなげた経路を設計しました。
最初の3ステップの酵素反応は、天然物よりも炭素数の多い分子骨格を作るためのものであり、これらは進化分子工学技術を用いて天然の酵素の選択性を拡張することで調達しました。この2つの酵素によって生合成されるC50カロテノイドからC50アスタキサンチンへの変換には、選択性が低いことが報告されている4つの酵素をそのまま用いることができます。こうして、全15ステップを触媒する6つの酵素が揃ったと思われました。しかし、それらの酵素遺伝子を発現させても、大腸菌は多種類の副産物を蓄積するだけで、目的とするC50アスタキサンチンは検出されませんでした。このように、せっかく作った酵素活性も、それぞれの特異性が十分でない場合、それらの酵素を組み合わせて作る生合成経路は、複数の分岐点を持つネットワーク状の経路となってしまいます(図2)。特に、現在の酵素工学技術では、新しい酵素活性を作ることはできても、その新活性に高い特異性を与えることは、極めて困難とされています。
そこで、C50アスタキサンチンの生合成経路を担う最初の2つの酵素FDSとCrtMに対し、基質サイズへの選択性が少しずつ異なる変異体を8種類ずつ取り揃えました。この8変異体x8変異体を総当たり戦のようにかけ合わせたところ、ある特別な変異体ペアは、C50カロテノイドだけを、ほぼ単一産物として作ることが見いだされました(図3)。このペアをなす変異体は、どちらも単独では選択性の低い酵素でしたが、FDS変異体の生産物選択性とCrtM変異体の基質選択性が「部分的に」重なるような組み合わせであれば、ある1つの中間体(C25PP)のみが両者で受け渡されることが分かりました(図3)。この副経路を除去する戦略は、人工生合成経路を構成する酵素同士に互いの選択性の不足を補い合わせ、経路全体として選択性を実現させるという、全く新しい考え方です。不必要な経路を段階的に遮断する様子が光学フィルタを用いた波長の絞り込みと似ていることから、この手法を「メタボリック・フィルタリング(Metabolic Filtering)」と名づけました。
さらに、同様の現象を利用することによって、C30、C35、C40、C50、C55、C60など、さまざまな骨格サイズのカロテノイドを、それぞれ90~95%という高い選択性で合成できることも実証しました。
選択的にC50カロテノイド骨格を作る人工生合成経路が得られたので、続く4~9ステップ目の反応を触媒する酵素活性の開発に挑みました。これは紅色細菌の持つフィトエン脱水素酵素(CrtI)という酵素の進化分子工学により達成されました。この経路に、末端環化(鎖状の末端部の炭素に6員環注5)を形成させる2ステップ)、位置選択的な酸化(水酸基を導入する2ステップ、およびケト基注6)を導入する2ステップ)を追加して、合計15ステップのC50アスタキサンチンの合成経路が完成しました(図1)。
こうして構築した生合成経路を導入した大腸菌は、自然界には見られない紫色をしていました(図1)。また、天然の(C40骨格型の)アスタキサンチンの生合成経路を導入した大腸菌と遜色のない量の色素を蓄積することが分かりました。これだけのステップ数にもかかわらず、理論的に想定される642種類ある副産物の中から、ほぼC50アスタキサンチンだけを作る、非常に高い選択性を持つ経路であることも示されました。
<今後の展開>
本研究で提案・実証した、「メタボリック・フィルタリング」を用いれば、「非特異的な酵素の重ね合わせ」の妙だけによって、経路全体の選択性を非常に高くできることが分かりました。いまなお困難な酵素それぞれの特異化を実現しなくても、多段階な人工生合成経路の構築を可能にするものであり、さまざまな有用物質の新たな生合成経路の構築に貢献することが期待されます。
<参考図>
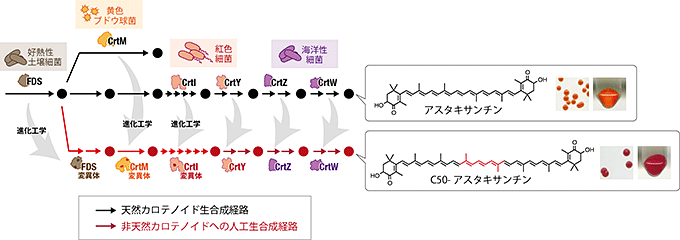
図1 C50アスタキサンチンへの人工生合成経路デザイン
天然のカロテノイド生合成経路(黒矢印)は植物や微生物に広く存在しています。本研究では、これらの酵素を進化工学的に改変して組み合わせ、大腸菌内に発現させることにより、非天然化合物であるC50‐アスタキサンチンへの生合成経路(赤矢印)を作ることに成功しました。
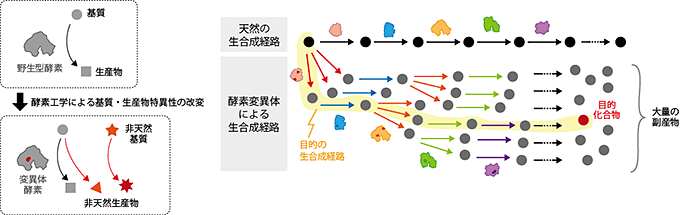
図2 非天然化合物への人工生合成経路を作る上での課題
新しい生合成経路を作るためには新たな酵素反応ステップが必要です。一般に、新しい酵素反応は、既存の酵素の反応選択性を低くし、機能を拡張することによって作られます。このようにして作られた選択性の低い酵素活性をいくつも組み合わせて生合成経路を作ると、多くの分岐点が生まれ、目的化合物は望まぬ副産物の海に埋もれてしまいます。
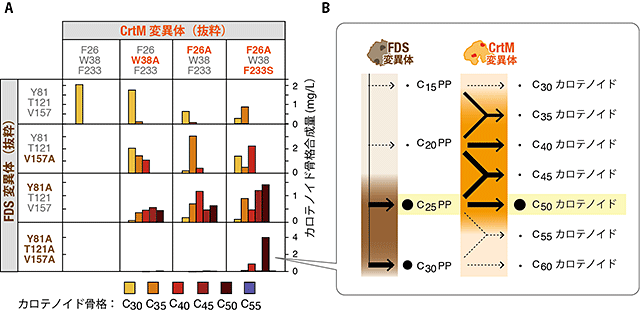
図3 選択的なC50カロテノイド骨格の生産
- (A) アミノ酸変異を入れることで酵素FDSとCrtMの基質/生産物選択性が少しずつ変化した酵素変異体を8種類ずつ作成し、それらを総当たり戦のように組み合わせて細胞の中で働かせ、細胞に蓄積するカロテノイド分子の骨格を調べました。図は、そのうちの4種類ずつをかけ合わせた16の実験を抜粋して掲載しています。FDS変異体、CrtM変異体それぞれが持つアミノ酸変異を、色文字でハイライト表示してあります。それぞれの変異体はペアを組む相手によってさまざまな生産物を作りますが、一番右下の組み合わせでは、C50骨格が選択的に合成されていることが分かります。
- (B) 黒線の太さは、その反応の触媒しやすさを表します。これは図3Aの一番右下の組み合わせの場合を示しています。FDS(Y81A、T121A、V157A)はC15からC25だけでなくC30なども生産します。一方、CrtM(F26A、W38、F233S)はC20+C20、C20+C25、C25+C25の反応を触媒しやすいことを示しています。それぞれの酵素変異体の基質/生産物選択性はそれほど高くありませんが、この酵素変異体の組み合わせでは、結果としてC50カロテノイドが選択的に生産されます。
<用語解説>
- 注1) 特異性
- 複数の類似反応のうち、特定の反応だけが進む場合、その反応は「選択的」に行われたとされる。一般に化学触媒と比べ、酵素が触媒する反応は選択的であると言われる。基質となり得る多くの化合物のうち実質的に1つにだけに作用する酵素は「基質特異性が高く」、生成可能な数多くの化合物の中で特定の物質だけを作る酵素は、「生産物特異性が高い」と言われる。最近の研究により、酵素の多くは以前考えられていたほど特異性が高くないことが明らかになってきた。この特異性の低さは、特に天然物合成に関わる酵素に顕著であり、人工生合成経路に必要な「新規な活性」の調達に利用されている。
- 注2) 進化分子工学
- 酵素を改変するための有効な手法の1つ。酵素の遺伝子にランダムに変異を導入し、多様化する。この変異体の集団(ライブラリ)の中から、望む酵素活性を持つ変異体を選抜(スクリーニング)・取得する。この「多様化」→「選抜」を繰り返すことによって、性能の高い新規酵素活性を作り出すことが可能である。
- 注3) アスタキサンチン
- サケや甲殻類に多く含まれている、橙色から赤色を示すカロテノイド色素の一種。天然のアスタキサンチンは炭素数40である。カロテノイドの中でも特に高い抗酸化作用を持つことで知られ、自然界における生理作用だけでなく、サプリメントや色揚げ剤、基礎化粧品などといった産業的応用にも注目されている。
- 注4) カロテノイド
- 炭素数40の骨格を基本構造とする天然色素の一群。主に黄色から赤色を示し、光合成装置における光捕捉機能や、光障害からの防御などに重要な役割を果たす。産業的にも多くの価値を持ち、抗酸化剤、天然着色料、色揚げ剤、化粧品材料などに使われている。
- 注5) 6員環
- 6の原子(今回の場合は6個の炭素原子)から構成される環状構造。
- 注6) ケト基
- 炭素と酸素が二重結合で結ばれた官能基をカルボニル基と言い、その両側に炭素原子が結合している場合、特にケト基(ケトン基)と呼ぶ。
<論文タイトル>
“A highly selective biosynthetic pathway to non-natural C50 carotenoids assembled from moderately selective enzymes”
(特異性の低い酵素によって作る、高い選択性を持つC50カロテノイド群への人工代謝経路)
doi :10.1038/ncomms8534
<お問い合わせ先>
<研究に関すること>
梅野 太輔(ウメノ ダイスケ)
千葉大学 大学院工学研究科 共生応用化学科 准教授
〒263-8522 千葉県千葉市稲毛区弥生町1-33
Tel:043-290-3413 Fax:043-290-3413
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 哲(カワグチ テツ)、松丸 健一(マツマル ケンイチ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2066
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
千葉大学
〒263-8522 千葉県千葉市稲毛区弥生町1-33
Tel:043-290-2018 Fax:043-284-2550
E-mail: