ポイント
- Regnase-1とRoquinという2つの蛋白質が、炎症性サイトカインのRNAを分解することで炎症のブレーキとして働いています。
- Regnase-1とRoquinは同じRNA構造を認識しますが、その機能する空間/場、時期、メカニズムがそれぞれ異なることを解明しました。
- 炎症性サイトカインの過剰な産生で引き起こされる炎症性疾患の病態解明への貢献が期待されます。
JST 戦略的創造研究推進事業において、京都大学 ウイルス研究所の竹内 理 教授らの研究グループは、病原体感染などに対する炎症反応が、RNA分解酵素Regnase-1注1)とRNA結合蛋白質Roquin注2)という、不必要なmRNAを分解する2つのブレーキシステムにより巧妙に制御されていることを解明しました。
病原体感染に対する炎症反応は、マクロファージなどの自然免疫注3)担当細胞が炎症性サイトカイン注4)を分泌することにより引き起こされます。炎症の活性化と抑制がバランス良く調節されていますが、このバランスの破綻が、免疫不全症や、自己免疫疾患を始めとした炎症性疾患の原因となると考えられています。マクロファージから分泌される炎症性サイトカインの量はmRNA産生と分解により厳密に制御されていることが知られています。これまで、Regnase-1、Roquinという蛋白質がmRNAに結合し分解すること、これらの分子をマウスで欠損させると自己免疫疾患を発症することが分かっていましたが、その詳細な機構は不明でした。
本研究では、2つの異なるRNA結合蛋白質Regnase-1とRoquinが、1)炎症性サイトカインmRNAに存在する同じステムループ構造を認識し分解することで炎症性サイトカイン量を制御していること、2)しかし機能する空間/場、分解するmRNAの翻訳注5)状態や分解のメカニズムが異なること、3)分解する時期も、それぞれ炎症早期、後期と異なることを解明しました。本研究は、過剰もしくは慢性的な炎症で生じる炎症性疾患の病態解明や、新たな治療法の開発につながることが期待されます。
本研究は、ドイツ マックス・デルブリュック分子医学センター(MDC)、近畿大学、大阪大学、東京大学、オーストラリア国立大学と共同で行ったものです。本研究成果は、2015年5月21日(米国東部時間)発行の米国科学誌「Cell」に掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。なお、平成27年4月1日に日本医療研究開発機構(AMED)が設立されたことにともない、本課題はAMEDに承継され、引き続き研究開発の支援が実施されます。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」
(研究総括:宮坂 昌之 大阪大学 未来戦略機構 特任教授) |
| 研究課題名 |
「自然免疫における転写後調節を介した慢性炎症抑制メカニズムの解析」 |
| 研究代表者 |
竹内 理(京都大学 ウイルス研究所 教授) |
| 研究期間 |
平成24年10月~平成30年3月 |
上記研究課題では、自然免疫細胞の活性化調節メカニズムを、転写の観点だけでなく、転写後制御の観点から再定義して、新規炎症制御法開発につなげていくことを目指します。
<研究の背景と経緯>
細菌やウイルスなどの病原体が感染すると、マクロファージなど自然免疫担当細胞によりToll様受容体(TLR)を介して最初に認識されます。マクロファージは病原体を貪食するとともに、炎症性サイトカインという蛋白質を分泌し、これが周りの免疫細胞を活性化させたり、免疫細胞の炎症局所への集積を促すなどして、いわゆる炎症を引き起こします。この炎症は、病原体の排除に重要な免疫反応ですが、過剰、もしくは慢性化した炎症は敗血症性ショック、自己免疫疾患、動脈硬化、代謝性疾患などさまざまな病気の原因となります。そのため、生体には、炎症を精緻にコントロールする機構が備わっており、その破綻が炎症性疾患の発症に関連すると考えられています。中でも、炎症性サイトカインの量が、炎症の調節において中心的な役割を果たしています。炎症性サイトカインは、感染に伴いマクロファージ内で、DNAからmRNAが転写され、次にmRNAから蛋白質が翻訳されるというステップで作られますが、mRNAは単に転写で作られるだけでなく、分解されることでその量が調節されています。我々は、以前、RNA分解酵素Regnase-1を発見し、この分子が炎症性サイトカイン産生調節に重要であることを報告してきました(Nature 2009;Nature Immunology 2011;Cell 2013)。また、他の研究グループによりRNA結合蛋白質Roquinも炎症性サイトカインmRNA分解や自己免疫疾患発症抑制に重要であることが報告されています。しかしながら、Regnase-1の標的mRNAの特異性や作用機構およびRegnase-1とRoquinの制御メカニズムの関係性は分かっていませんでした。
本研究では、2つの異なるRNA結合蛋白質Regnase-1とRoquinが時空間的に異なるメカニズムで共通の炎症性サイトカインmRNAを制御していることを解明しました。
<研究の内容>
Regnase-1がどのようなmRNAをどのような目印を通じて認識するかという事を明らかにするために、Regnase-1と結合するmRNAをRNA-immunoprecipitation sequencing(RIP-Seq)により網羅的に同定するとともに、Regnase-1の結合領域をhigh-throughput sequencing of RNA isolated by crosslinking immunoprecipitation(HITS-CLIP)により網羅的に同定しました(図1A)。その結果、Regnase-1は多くの炎症に関わるmRNAのうち、3′非翻訳領域に存在するステムループ構造(図1B)に結合すること、加えて、Regnase-1に結合するステムループ構造のループ部分はUAU/UGU loop配列を持つことが判明しました。興味深いことに、このステムループ構造の特徴はRoquinが認識するステムループ構造と類似しており、Roquinと結合するmRNAをRIP-seqにより網羅的に同定した結果から、Regnase-1とRoquinは同様の標的mRNAを認識していることが分かりました。また標的となるステムループ構造を持つRNAを細胞に発現させると、Regnase-1によってもRoquinによっても分解されたことから、Regnase-1とRoquinは同じステムループ構造を持つmRNAを分解していることが分かりました。つまり、このステムループ構造は、Regnase-1とRoquinという2つの異なる蛋白質により共通して読み取られる認識構造(シスエレメント)であるという事です。
では、Regnase-1とRoquinはどのような関係性をもって炎症関連mRNAを制御しているのでしょうか。まず、Regnase-1とRoquinの細胞内局在を調べると、RoquinはRNA分解に関わる酵素が豊富なストレス顆粒(SG)やprocessing bodies(PBs)に局在するのに対し、Regnase-1は粗面小胞体(ER)に多く存在し、蛋白質翻訳装置であるリボソームと共局在する事が判明しました(図2)。このRegnase-1とRoquinの細胞内局在の違いは機能する”空間/場”が異なることを示唆しています。実際に、Regnase-1の発現を低下させると翻訳を活発に行っているmRNAが増加するのに対し、Roquinを欠損させると翻訳活性がほとんどないmRNAが増加しました。更に、Regnase-1が標的mRNAを分解するには、翻訳装置(リボソーム)が働いていることが必須であることが分かりました。これまで、異常mRNAを蛋白質翻訳により検出して分解するシステム(Nonsense-mediated decay)が知られていますが、このシステムに重要な蛋白質UPF1とRegnase-1が相互作用すること、Regnase-1によるmRNA分解にUPF1が必須であることを見出しました。この結果は、Regnase-1による炎症関連mRNA分解のシステムと、異常mRNAを分解するシステムの共通性を示しています。
次に、同じ標的mRNAに対して異なるメカニズムによりmRNA安定性制御を行なっているRegnase-1とRoquinが生物学的に異なる役割を担っているか検討するために、Regnase-1欠損およびRoquin変異マクロファージの免疫刺激(LPS注6)によるTLR4刺激)に対する炎症性サイトカインmRNAの発現を確認しました。その結果、Regnase-1欠損マクロファージでは免疫刺激(LPS刺激)の早期において、Roquin変異マクロファージではLPS刺激の後期において標的mRNAの発現が亢進していました。これは異なるメカニズムで作用しているRegnase-1とRoquinがそれぞれ時間的に異なる炎症の早期と後期において機能していることを示しています。次に、Regnase-1とRoquinがRNA分解能において重複性を有するか検討するために、Regnase-1とRoquinの二重変異(Regnase-1–/–/Rc3h1san/san)マウス由来の線維芽細胞(MEF)においてRegnase-1とRoquinの共通の標的mRNA(IL6、TNF、PTGS2)量を調べたところ、それぞれの単独変異のMEFにおけるmRNA量よりも増加していました(図3)。これに対し、Regnase-1、Roquinいずれの標的でもないmRNA(NFKBIA)は正常でした。また、Regnase-1、Roquinの単独変異はそれぞれ、LPS刺激後早期、後期における標的mRNA量を増加させました(図3)。この結果はRegnase-1とRoquinはRNA分解能において重複性を有し、この重複したmRNA安定性制御が正常な遺伝子発現において重要であることを示しています。
以上の結果より、Regnase-1とRoquinは共通のステムループ構造を認識するが時空間的に異なるRNA分解の制御因子として機能している事が明らかとなりました(図4)。
<今後の展開>
本研究では、Regnase-1とRoquinは共通のステムループ構造を認識するが時空間的に異なるRNA分解の制御因子として機能することにより、炎症を制御している事を解明しました。今後、ヒト自己免疫疾患や炎症性疾患におけるRegnase-1、Roquinの機能を検討することで、これらの疾患の病態解明につながることが期待されます。また、Regnase-1、Roquinの機能を変化させることは、自己免疫疾患や炎症性疾患などの創薬ターゲットとなることが期待されます。
本研究では,Regnase-1はRoquinと共通のステムループ構造を認識して、UPF1依存的にタンパク質翻訳の終結反応と共役し翻訳を活発に行っているmRNAを分解していることを明らかにしました。しかしながら、Regnase-1がどのようにUPF1依存的にmRNA分解を生じているのかまだ分かっていません。また、Regnase-1とRoquinはマクロファージなどの自然免疫担当細胞だけでなく、獲得免疫T細胞においても重要な役割を担っているため、T細胞におけるRegnase-1とRoquinによるRNA安定性制御も重要であると考えられます。また、Regnase-1、RoquinのRNA結合を調節する小分子をスクリーニングすることで、炎症の制御法の開発につなげていきたいと考えています。
<参考図>
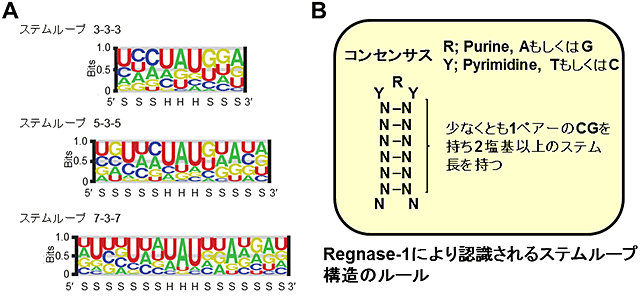
図1 Regnase-1とRoquinはステムループ構造を認識する
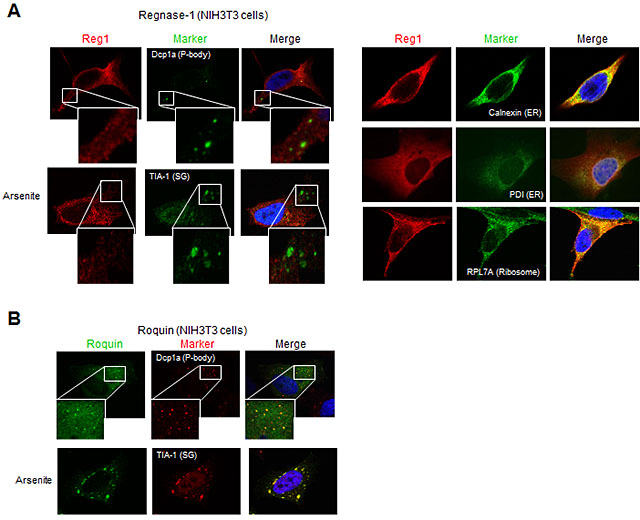
図2 Regnase-1とRoquinはERとストレス顆粒・P bodyにそれぞれ局在する
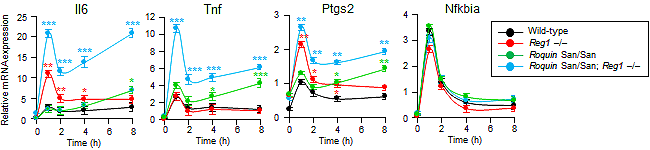
図3 Regnase-1/Roquin変異MEFのLPSに対する応答
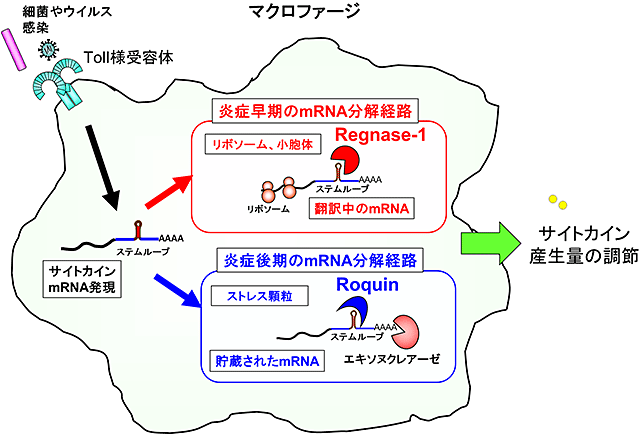
図4 Regnase-1とRoquinのサイトカインmRNA分解機構モデル
<用語解説>
- 注1) Regnase-1
- IL6やIL12p40などのサイトカインmRNAの分解を行うことで過剰な免疫応答を抑制するサイトカイン産生のブレーキ役を担っているRNA分解酵素。
- 注2) Roquin(Rc3h1、Rc3h2、RING finger and CCCH zinc finger protein)
- IcosやTnfなど炎症に関わる蛋白質をコードするmRNA分解を誘導することで自己免疫疾患となることを防いでいることが知られているRNA結合蛋白質。
- 注3) 自然免疫
- 病原体の侵入を最初に検知して免疫システムを活性化させる。マクロファージや樹状細胞などの自然免疫担当細胞により担われ、病原体を検出した自然免疫担当細胞は炎症性サイトカインを産生・分泌して炎症を誘導する。
- 注4) 炎症性サイトカイン
- 炎症に伴い細胞から分泌される蛋白質のうち、細胞同士の信号伝達に重要なものがサイトカインであり、中でも炎症を引き起こすものを炎症性サイトカインと呼ぶ。これにはインターロイキン6(IL6)、インターロイキン1(IL1)、腫瘍壊死因子(TNF)などがあげられる。
- 注5) 翻訳
- mRNAに記述されたコドン情報に基づいて、蛋白質を合成する反応。mRNAにリボソームと呼ばれる蛋白質複合体が結合することにより蛋白質鎖が作られ、mRNAの終止コドンを認識して終結する。細胞内小器官である粗面小胞体にはリボソームが付着しており、サイトカインなど細胞外に分泌される蛋白質の翻訳を担っている。
- 注6) リポポリサッカライド(LPS)
- グラム陰性細菌の細胞外膜に存在するリポ多糖であり、TLR4により認識される。LPSによりマクロファージは多量の炎症性サイトカインを産生し、敗血症性ショックなどの原因となる。Bruce Beutlerは、LPS受容体としてのTLR4の発見により、2011年ノーベル生理学賞を受賞した。
<論文タイトル>
“Regnase-1 and Roquin Regulate a Common Element in Inflammatory mRNAs by Spatiotemporally Distinct Mechanisms”
(Regnase-1とRoquinは時空間的に異なるメカニズムで共通の炎症性mRNAを制御する)
著者:Takashi Mino, Yasuhiro Murakawa, Akira Fukao, Alexis Vandenbon, Hans-Hermann Wessels, Daisuke Ori, Takuya Uehata, Sarang Tartey, Shizuo Akira, Yutaka Suzuki, Carola G. Vinuesa, Uwe Ohler, Daron M. Standley, Markus Landthaler, Toshinobu Fujiwara, Osamu Takeuchi
doi :10.1016/j.cell.2015.04.029
<お問い合わせ先>
<研究に関すること>
竹内 理(タケウチ オサム)
京都大学 ウイルス研究所 感染防御研究分野 教授
〒606-8507 京都府京都市左京区聖護院川原町53
Tel:075-751-4024 Fax:075-761-5766
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
京都大学 企画・情報部広報課
Tel:075-753-2071 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: