ポイント
- 微小がんを術中に発見し取り残しを防ぐことは、転移を防ぐなど、患者の予後をより良くするために強く求められている課題である。
- がん細胞中の糖鎖分解酵素活性を検出する蛍光試薬を開発し、より多くの種類のがんを、スプレーするだけで見つけることが可能となった。
- 外科手術がん検体を活用して、どの位の精度でがんを見つけることが可能かを検証し、安全性を確かめて、新しいがん医療技術として実用化を目指す。
JST 戦略的創造研究推進事業において、東京大学 大学院医学系研究科・薬学系研究科の浦野 泰照 教授らは、外科手術時や内視鏡・腹腔鏡手術時に、がんが疑われる部分にスプレーするだけで、数分でがん部位のみを光らせて検出することを可能にする新たな蛍光試薬の開発に成功しました。
浦野教授らは2011年に、特定のたんぱく質分解酵素活性が、がん細胞で高くなっていることを利用した、世界初の迅速がん部位可視化スプレー蛍光試薬の開発に成功し、現在では患者由来の外科手術サンプルを用いてその機能の検証を行っています。しかし、この試薬では見つけることができないがんも多く存在することから、より幅広いがん種を光らせることができる新たなスプレー蛍光試薬の開発が望まれていました。
本研究グループは今回、新たにがん細胞中の糖鎖分解酵素注1)活性が高いことを活用したがん検出スプレー蛍光試薬を開発しました。この試薬は無色透明で蛍光を発しませんが、がん細胞中に含まれるβ-ガラクトシダーゼ注2)という糖鎖分解酵素と反応すると構造が変化して、強い蛍光を発する物質へと変化するように設計されています。この試薬を、さまざまな種類の卵巣がん細胞を腹腔内へと転移させたモデルマウスに投与した結果、上述したたんぱく質分解酵素活性を標的とする試薬では可視化できなかったものを含め、全てのがん細胞の可視化に成功しました。
腹腔に転移したがんは、1mm以下の微小がんまで取りきることができれば、術後5年生存率が大きく改善することが知られています。今回開発に成功したスプレー蛍光試薬を術中に使用することで、微小がんの発見や取り残しを防ぐことが可能となり、腹腔鏡を活用したがん治療に画期的な役割を果たすことが期待されます。今後、本スプレー蛍光試薬の臨床新鮮検体注3)を活用した機能の検証と、安全性試験注4)を行う予定です。
本研究は、米国国立衛生研究所の小林 久隆 主任研究員、および京都大学 化学研究所の平竹 潤 教授の協力を得て行いました。
本研究成果は、2015年3月13日(英国時間)に英国科学誌「Nature Communications」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 CREST
| 研究領域 |
「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」
(清水 孝雄 研究総括) |
| 研究課題名 |
「臨床検体を用いた疾患部位特異的な代謝活性のライブイメージング探索技法の確立と創薬への応用」 |
| 研究代表者 |
浦野 泰照(東京大学 大学院医学系研究科・薬学系研究科) |
| 研究期間 |
平成26年10月~平成32年3月 |
<研究の背景と経緯>
卵巣がん患者の半数以上は、治療開始の段階ですでに治療難度が高い腹腔内に転移があると診断されます。この腹腔内転移の治療には、外科手術や腹腔鏡手術が有効であり、1mm以下の微小な転移まで切除するとその予後が改善することが知られています。しかし、微小がん転移部位を正常な組織と精確に区別して識別することは非常に難しく、がん部位の術中可視化技術の開発が強く求められていました。
これまでに本研究グループでは、患部に噴霧すると転移部位を明るく光らせるスプレー蛍光試薬gGlu-HMRGの開発に成功していました。この試薬は、がん細胞中のある種のたんぱく質分解酵素活性が高いことを活用したものですが、この酵素活性が高くないがん種も多く、例えば、適用可能な卵巣がんも限られることがモデルマウスを使った実験から明らかとなっていました。
<研究の内容>
本研究グループは、より広範ながん種の検出を可能とさせるべく、卵巣がんでその酵素活性が促進されていることが報告されている、糖鎖分解酵素であるβ-ガラクトシダーゼに着目しました(図1)。本酵素に対する蛍光検出試薬はいくつか開発されていますが、既存の活性検出試薬をがんのモデルマウスへ適用したところ、試薬の感度の低さなどによりがんの検出は困難でした。そこで試薬分子の特性を見直し、分子構造の最適化を図ることにより新たな試薬の開発に成功しました。このスプレー蛍光試薬はそれ自体ではほぼ無蛍光性ですが、β-ガラクトシダーゼと反応することにより1,000倍以上明るく光る性質を持ち、がん細胞の持つβ-ガラクトシダーゼ活性を検出可能です。
開発したスプレー蛍光試薬を卵巣がんモデルマウスに適用したところ1mm以下の微小ながんまでも高精細に検出可能であり(図2)、以前開発した蛍光試薬で検出が困難であったがんも検出可能でした。また、がんにおける蛍光は非常に明るく肉眼での観察が可能でした(図3)。さらに、このスプレー蛍光試薬を用いて、蛍光内視鏡により生きている状態のがんモデルマウス腹腔に存在する微小がんの検出にも成功し(図4)、模擬的な手術において試薬の蛍光を目印としたがんの切除も達成しました。
<今後の展開>
開発したスプレー蛍光試薬は、微小ながんの容易な発見を可能とし、診断や手術での見落としや取り残しを防ぐ役割が期待できます。本研究グループは、蛍光の検出が安価な装置で行える点で、この技術が一般的ながん検出手法として普及する上で大きな有用性があると考えています。現在、臨床新鮮検体へと適用してがんイメージング機能の実践的な検証を行っており、今後、安全性試験など臨床試験への適用に向けた準備を進めていきます。
また、β-ガラクトシダーゼのほか、糖の結合を加水分解する種々の糖鎖分解酵素の活性が多くのがんで促進されていることが知られています。今回開発したスプレー蛍光試薬は分子内に糖構造を含んでいますが、それを適切に他の糖へと入れ替えることによって、種々の糖鎖分解酵素の活性を検出する試薬へと展開することが可能です。現在、本研究グループはさまざまな種類のがんへの適用性の拡大を目指し、スプレー蛍光試薬のラインナップの整備を進めています。
<参考図>
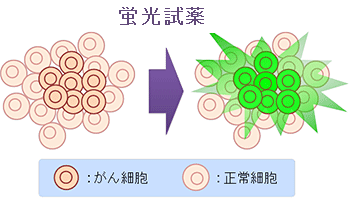
図1 蛍光試薬を用いたがんの検出
開発した蛍光試薬によりβ-ガラクトシダーゼの活性が促進されているがん細胞で蛍光が観察され、がんの容易な識別が可能となる。
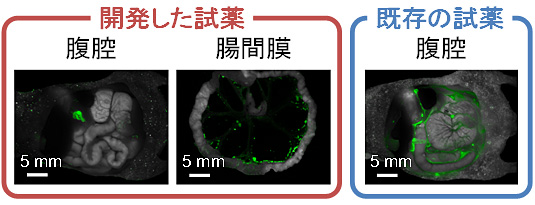
図2 開発した蛍光試薬によるがんの検出
試薬の蛍光が観察された部分が緑色となっている。既存の活性検出試薬では腹腔全体で蛍光が観察されるが、開発した蛍光試薬ではがんのみにおいて蛍光が観察される。
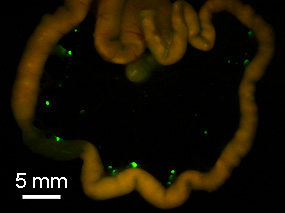
図3 蛍光試薬により緑色に光るがん
モデルマウスの腸間膜上にある1mm以下のがんまで肉眼で容易に識別可能である。
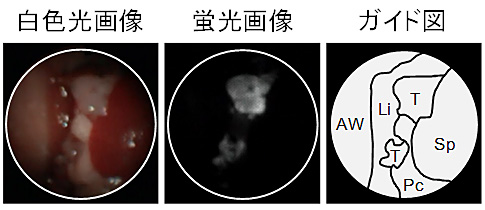
図4 蛍光内視鏡によるがんの検出
開発した蛍光試薬により、麻酔下のモデルマウスにおいて腹腔内にあるがんを容易に識別可能であった。
ガイド図:AW、腹壁;Li、肝臓;T、がん;Pc、膵臓;Sp、脾臓
<用語解説>
- 注1) 糖鎖分解酵素
- 各種の糖や、糖がつながりあった化合物(糖鎖)が結合したたんぱく質が細胞には沢山存在して、たんぱく質の機能や細胞コミュニケーションに重要な役割を持っていることが知られている。糖鎖分解酵素は、この糖鎖を特定の位置で分解する活性を持ち、たんぱく質の機能やコミュニケーションを制御している。
- 注2) β-ガラクトシダーゼ
- 糖鎖分解酵素の1つで、糖化合物に含まれるβ-ガラクトシド結合を分解する酵素。卵巣がんをはじめ、乳がんや大腸がんなどで酵素活性が促進されていることが知られている。
- 注3) 臨床新鮮検体
- 患者から外科・内視鏡手術で体外に取り出された直後の、凍結や固定操作を加えていない組織。
- 注4) 安全性試験
- ここでは、化学物質の毒性を、動物や培養細胞を用いて試験することを指す。
<論文タイトル>
“Sensitive β-galactosidase-targeting fluorescence probe for visualizing small peritoneal metastatic tumours in vivo”
(微小な腹腔内転移がんを可視化する高感度なβ-ガラクトシダーゼ蛍光プローブ)
doi: 10.1038/ncomms7463
<お問い合わせ先>
<研究に関すること>
浦野 泰照(ウラノ ヤステル)
東京大学 大学院医学系研究科・薬学系研究科 教授
〒113-0033 文京区本郷7-3-1
Tel:03-5841-3601/4850 Fax:03-5841-3563/4855
E-mail:
<JST事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: