ポイント
- 体内に侵入してきた微生物のDNA配列を感知して、自然免疫応答を引き起こすToll様受容体9(TLR9)と呼ばれるタンパク質の立体構造を明らかにしました。
- TLR9を活性化する微生物由来のDNA配列、および不活性化するDNA配列との結合様式が分かりました。
- TLR9は重要な創薬の標的であり、DNA配列を認識する機構の解明により、これを調節する抗ウイルス薬、アレルギー薬、ワクチンなどの開発につながることが期待されます。
東京大学 大学院薬学系研究科の清水 敏之 教授、大戸 梅治 講師、同医科学研究所の三宅 健介 教授、柴田 琢磨 助教、大阪大学 大学院工学研究科の内山 進 准教授、エレナ・クラユヒナ 特任研究員らの研究グループは、微生物の侵入を感知して自然免疫応答を活性化するTLR9受容体の詳細な立体構造を世界で初めて明らかにしました。
細菌やウイルスなどの病原体への感染を防ぐ仕組みとして、私たちの体には自然免疫機構が備わっており、Toll様(TLR)受容体と呼ばれるタンパク質が主要な役割を担っています。TLRは、病原体のもつ分子によって活性化され、2量体を形成することでその役割を果たすことが知られています。今回立体構造を明らかにしたTLR受容体の一種TLR9は、微生物由来のDNA配列(CpGモチーフ注1))を感知することで、インターフェロン注2)などの産生を促します。TLR9は、抗ウイルス薬やアレルギー薬などの創薬の標的として注目されていましたが、具体的にどのようにDNAを認識するのかは不明でした。
研究グループは、微生物由来のDNA配列が結合していないTLR9、微生物由来のDNA配列が結合しているTLR9、TLR9の機能を阻害するDNA配列が結合しているTLR9の3種の立体構造を明らかにしました。その結果、TLR9と微生物由来のDNA配列は2対2の比率で結合して2量体の活性化型を形成することが分かりました(図1上)。このDNA配列はTLR9のN末端側にある溝に結合することによって認識されていることが分かりました。一方で、TLR9とTLR9の機能を阻害するDNA配列は1対1の比率で結合し、2量体になることはありませんでした。また、このDNA配列はTLR9の馬蹄型構造の内側にコンパクトなループのような形で結合していました(図1下)。
これらの知見は、抗ウイルス薬、アレルギー薬、ワクチンなどの治療薬の設計につながるものと期待されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)、科学研究費補助金、公益財団法人 武田科学振興財団助成金、公益財団法人 持田記念医学薬学振興財団助成金などの外部資金支援を受けて行われたものです。
本研究成果は、2015年2月9日(英国時間)に英国科学誌「Nature」のオンライン版で公開されます。
<研究内容>
細菌やウイルスなどの病原体に対する感染防御機構として、私たちの体には自然免疫機構が備わっており、TLR受容体が重要な役割を担っています。DNA中に存在するシトシンとグアニンがホスホジエステル結合でつながったDNA配列はCpGモチーフと呼ばれ、哺乳類ではメチル化されることが多いのに対して、細菌やウイルスではメチル化されない(非メチル化)ことが分かっています。微生物由来の非メチル化CpGモチーフはTLR9を強く活性化してインターフェロンなどの産生を促し、抗ウイルス反応などを引き起こします。このために、TLR9はウイルス感染、アレルギーに対する治療薬やワクチンのアジュバント注3)などの標的として注目されています。しかし、TLR9がどのようにCpGモチーフを持つDNA配列を認識して免疫を活性化するのか、具体的な機構は不明でした。
本研究グループは、TLR9によるDNA配列の認識機構をX線結晶解析によって明らかにするために、TLR9の細胞外領域を大量に調製することに成功しました。得られたタンパク質を結晶化し、最終的に、DNA配列が結合していないTLR9、CpGモチーフを有するDNA配列が結合したTLR9、TLR9の機能を阻害するDNA配列(アンタゴニストDNA配列)が結合したTLR9、の3つの状態の結晶構造を明らかにしました。結晶からの回折データの取得には、大型放射光施設SPring-8および高エネルギー加速器研究機構フォトンファクトリーの強力なX線を使用して、1.6~2.8Å(オングストローム、1Åは0.1ナノメートル)という高い分解能での構造決定を実現しました。
構造解析の結果、TLR9と微生物由来のCpGモチーフは2対2の比率で複合体を形成しており、TLR9は2分子が結合して(2量体構造)活性化型のm字型の構造をなしていました(図1上)。また、CpGモチーフはTLR9のN末端側に存在する溝にはまり込んで結合しており、その周辺のアミノ酸残基と特徴的な相互作用を形成していました(図2)。さらにCpGモチーフは伸びた形で2分子のTLR9に挟まれることでTLR9の2量体を安定化させていました。その結果、TLR9の2量体のC末端側同士が接近することで、細胞外から細胞内へと微生物が侵入してきたという情報を伝えていることが分かりました。一方で、TLR9とアンタゴニストDNAは1対1の比率で複合体を形成していました(図1下)。アンタゴニストDNAはTLR9の馬蹄型構造の内側にコンパクトなループ構造を作って結合していました。アンタゴニストDNAは微生物由来のCpGモチーフよりもTLR9に強力に結合していました。またそれらのTLR9上の結合部位は一部重なっていることから、アンタゴニストDNAは微生物由来のCpGモチーフの結合を物理的に阻害することによって、TLR9の機能を阻害していることが分かりました。
TLRの中でも、微生物由来のCpGモチーフを認識するTLR9は抗ウイルス薬やワクチンのアジュバントなどの創薬上重要な標的として、その発見以来十数年近く精力的に研究がなされてきました。しかし、その詳細なDNA配列との結合様式が分からなかったために具体的な化合物設計の指針がありませんでした。本研究により、TLR9を活性化するまたは不活性化するDNA配列との結合様式が分かったことで、ワクチンアジュバントやウイルス感染やアレルギーなどの治療薬の開発が進展するものと期待されます。
<参考図>
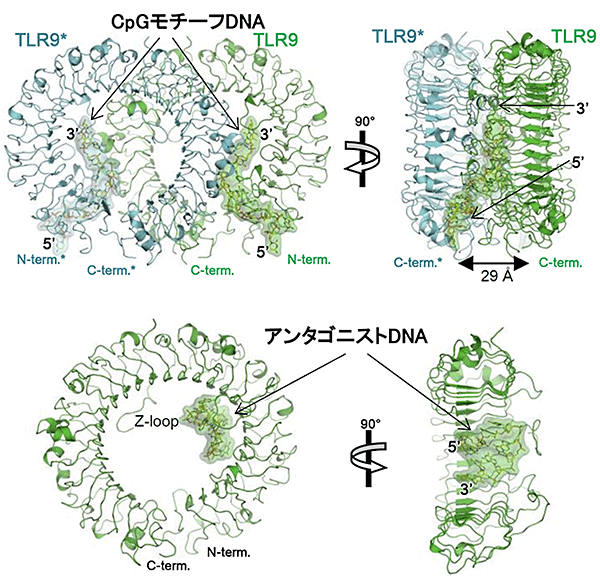
図1 TLR9の結合様式
- (上図) CpGモチーフを有するDNA配列とTLR9との結合様式。
- (下図) アンタゴニストDNA配列とTLR9との結合様式。
2量体を形成するTLR9分子の一方を緑色で、他方を青色で示している。CpGモチーフは伸びた構造で、TLR9の2量体に2ヶ所で結合している(2対2複合体)。アンタゴニストDNAはTLR9の馬蹄型構造の内側にループ構造を作り結合している(1対1複合体)。

図2 TLR9によるCpGモチーフの認識の結合様式
- (左図) CpGモチーフを認識するTLR9のN末端側の溝。
- (右図) CpGモチーフを認識するTLR9のN末端側の溝の拡大図。
- (左図) CpGモチーフが青色で示したTLR9の溝にすっぽりと収まっていることが分かる。
DNA配列とTLR9の炭素原子をそれぞれ黄色と緑色で、水素結合は破線で示している。CpGモチーフおよびTLR9の溝内のアミノ酸のトリプトファン(Trp47)とフェニルアラニン(Phe49)部分の電子密度を灰色のメッシュで示している。
<用語解説>
- 注1) CpGモチーフ
- DNA中に存在するシトシンとグアニンがホスホジエステル結合でつながったDNA配列。哺乳類ではメチル化されることが多いのに対して、細菌やウイルスではメチル化されていない(非メチル化)ことが知られている。非メチル化CpGモチーフはTLR9を強く活性化してさまざまな免疫応答を引き起こす。
- 注2) インターフェロン
- 細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化するなどの作用を発揮する。
- 注3) アジュバント
- 抗原と混合して生体に投与することで、投与した抗原に対する免疫応答を増強する物質のことで抗原性補強剤とも呼ばれる。
<発表雑誌>
| 雑誌名 |
Nature |
| 論文タイトル |
“Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9” |
| 著者 |
大戸 梅治、柴田 琢磨、丹治 裕美、石田 英子、エレナ・クラユヒナ、内山 進、三宅 健介、清水 敏之† ( † 責任著者) |
| doi |
10.1038/nature14138 |
<お問い合わせ先>
<研究に関すること>
清水 敏之(シミズ トシユキ)
東京大学 大学院薬学系研究科 教授
Tel:03-5841-4840 Fax:03-5841-4891
E-mail:
HP:http://www.f.u-tokyo.ac.jp/~kouzou/index.html
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: