ポイント
- 着床前の多能性幹細胞を着床前の胚に移植すると作製できるキメラ動物は、遺伝子改変動物の作製を容易にします。
- 着床後段階にあるマウスの多能性幹細胞(EpiSC)をESC様の着床前段階の多能性幹細胞に変換する従来の技術には、変換効率が低いなどの問題がありました。
- 今回EpiSCを、ESC様の状態へと短期間で効率的に誘導する新しい手法を開発することに成功しました。
二種類以上の異なる個体の細胞が混ざったキメラ注1)動物は、遺伝子改変動物の作製を容易にします。たとえば、キメラマウスは、多能性注2)状態にあるマウスの胚性幹細胞(ESC)を着床前の胚に移植することで作製できます。一方で、生体の様々な細胞を作り出せる多能性幹細胞には、ESCのほかに、より発生段階の進んだエピブラスト幹細胞(EpiSC)もあります。マウスEpiSCは、着床後の胚である卵筒胚注3)のエピブラストから作製され、胚盤胞注4)に移植してもキメラ個体を形成できない点で異なります(図1)。また、げっ歯類以外のヒトを含めた動物種のESCはその特徴がマウスEpiSCと類似していることが知られており、これに対応するようにげっ歯類以外ではESC由来のキメラ動物は作製されていません。
東京大学 医科学研究所附属幹細胞治療研究センターの中内 啓光 教授、同 正木 英樹 特任研究員、東京大学 大学院医学系研究科の村山 秀之 博士課程大学院生らの研究グループは、マウスのEpiSCに、細胞の接着因子であるE-cadherin(イーカドヘリン)を過剰に発現させること、または化合物を添加すること、によってβ-catenin(ベータカテニン)が核へ移行することを抑制してESC様の状態へと短期間で高効率に変換させることを発見しました。
これまでの知見では、β-cateninの核への移行を促進することがESC様の状態の維持に有用であると広く認識されていましたが、本研究成果はこれとは異なる結果を示しています。今後、この変換におけるβ-cateninの役割を再検証することで、げっ歯類以外の動物種において着床後でも多能性状態にある幹細胞を着床前の多能性状態へ変換する条件が最適化され、新規な多能性幹細胞の開発に繋がることが期待されます。
本研究はJST 戦略的創造研究推進事業の一環として行われ、2015年1月13日(現地時間)に米国科学雑誌「Stem Cell Reports」に掲載されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業
| 研究プロジェクト |
「中内幹細胞制御プロジェクト」 |
| 研究総括 |
中内 啓光(東京大学 医科学研究所 教授) |
| 研究期間 |
平成19~24年度 |
JSTはこのプロジェクトで、臓器発生過程の基礎的研究と、その知見に基づいた臓器再生法確立のための新技術の研究を行っています。
<研究の背景と経緯>
着床前胚である胚盤胞の内部細胞塊から樹立されたげっ歯類のESCは生体のすべての細胞に分化できる分化多能性を有し、桑実胚や胚盤胞といった着床前胚との間にキメラ個体を形成できます。生殖細胞もキメラとなるため、遺伝子改変したESCからキメラ個体をつくることで遺伝子改変動物の作製が容易になりました。一方、着床後胚である卵筒胚のエピブラストから樹立されたマウスEpiSCは分化多能性を有しますが、胚盤胞に移植してもキメラ個体を形成することはできません。このような差異から、着床前段階の多能性状態にある幹細胞を「ナイーブ型多能性幹細胞」、着床後胚のエピブラスト相当まで進んだ多能性状態にある幹細胞を「プライム型多能性幹細胞」とも称します。幹細胞の定義は「未分化状態を維持しつつ自己複製できる細胞」ですが、マウスESCは未分化性の維持に白血病抑制因子(LIF)を、マウスEpiSCは塩基性線維芽細胞増殖因子(bFGF)を必要とするという差異があります(図1)。
現在、着床前胚へ移植した際にキメラ個体を形成するナイーブ型多能性幹細胞はげっ歯類でのみ樹立されています。ヒトを含めた他の動物種のESCは、胚盤胞の内部細胞塊から作製されるにも関わらず、その特徴がマウスEpiSCに類似しており、プライム型であると考えられています。実際に、げっ歯類以外のESCからキメラ動物が作製されたとの報告は未だありません。非げっ歯類動物においてキメラ動物からの遺伝子改変動物作製を可能にするために、また、ヒトにおいてもより早い発生段階へのリプログラミングを達成する目的などから、ナイーブ型多能性幹細胞の開発が精力的に行われています。主なアプローチは、発生の進行に必要なシグナル経路を阻害剤によって遮断し、多能性状態を維持するというものです。代表的な例はマウスESCがLIFのない環境でもMEK阻害剤、GSK3阻害剤という2つの化合物の添加によって多能性を維持できることで、この2種の阻害剤添加によるナイーブ型多能性幹細胞の培養法はスタンダードとなっています(2i培養法)。
これまでに、LIFを含んだ培地で培養することでマウスEpiSCがナイーブ型へと変換されるものの、長期間の培養を必要とする上に変換効率が低いことが知られていました。そこで本研究グループは、マウスEpiSCをナイーブ型多能性幹細胞へとより高効率に変換させる条件を見出すこと、見出された条件から多能性状態変換のメカニズムを解明し、非げっ歯類のナイーブ型多能性幹細胞作製につなげることを目的として研究を行いました。
<研究の内容>
1) E-cadherinの過剰発現はEpiSCのナイーブ型への変換を促進する
これまでに、細胞接着因子であるE-cadherinは、マウスESCにおいてLIFシグナルを活性化させることが報告されています。また、E-cadherinを初期化因子と組み合わせて強制的に発現させると体細胞からiPS細胞へのリプログラミングが促進されることが報告されていました。そこで本研究グループは、EpiSCにE-cadherinを過剰に発現させることで、ナイーブ型への変換においてもE-cadherinの過剰発現が優位に作用するかを検討しました。その結果、LIF存在下でE-cadherinを過剰に発現すると、EpiSCが短期間で効率的にナイーブ型多能性幹細胞へと変換されることを見出しました(図2)。
2) β-cateninの核局在抑制はナイーブ型への変換を促進する
E-cadherinは細胞内でカドヘリン関連タンパクであるβ-cateninと特異的に結合し、結果としてβ-cateninが核に留まる(局在する)ことを抑制することが知られています。実際にE-cadherinを過剰に発現させると、核内のβ-catenin量が減少していました。このことがE-cadherin過剰発現によるナイーブ型への効率的な変換の原因であるとの仮説を立て、β-cateninの核局在を阻害するWntシグナル阻害剤として知られるIWP-2またはXAV939を用い、ナイーブ型への変換における効果を検討しました。その結果、LIFを含む培地にIWP-2またはXAV939を添加することによって、ナイーブ型への変換が短期間で高効率に起こることを見出しました(図3A)。一方で、げっ歯類ESCの2i培養法に用いられるβ-cateninの核局在を促進するGSK3阻害剤(図3B,CHIR)は、添加の有無によって有意な差がありませんでした。さらに、IWP-2添加によって変換されたナイーブ型多能性幹細胞を胚盤胞へ移植したところ、キメラ個体を形成できること、より高度な判定基準である生殖系列への寄与(卵子や精子などの生殖細胞に分化し、次世代をつくり得ること)が起こることを確認しました(図3C)。
これらの結果から、マウスEpiSCからナイーブ型多能性幹細胞への変換過程においては、LIFシグナルの活性化に加えてβ-cateninの核局在を抑制することが変換効率および変換速度の促進に有用であることが明らかとなりました。
<社会的意義・今後の展開>
現在までにヒトを中心としたげっ歯類以外の動物のナイーブ型多能性幹細胞作製法はさまざまな手法が報告されていますが、それぞれの報告ごとに誘導条件が異なり、再現性に問題があることが指摘されていました。他方で、いずれの報告でも唯一共通しているのは前述の2i培養法を用いることでした。しかし、今回研究グループはE-cadherinの過剰発現または化合物によりβ-cateninの核局在を抑制した方がプライム型からナイーブ型への変換が促進されることを示しました。今後は、ヒトを含めたげっ歯類以外の動物のナイーブ型多能性幹細胞の誘導においてWnt/β-cateninシグナルの役割を再検証し、再現性が高く高効率な誘導法の確立につなげる予定です。
<参考図>
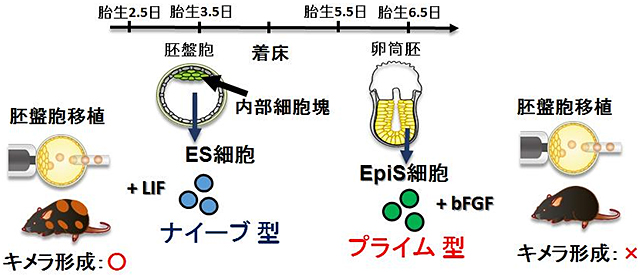
図1 ナイーブ型多能性幹細胞とプライム型多能性幹細胞
着床前胚である胚盤胞の内部細胞塊から作製されるマウスESCは、多分化能を維持するために白血病抑制因子(LIF)を必要とする。マウスESCは、胚盤胞に移植するとキメラ個体を形成できる。これはマウスESCが内部細胞塊の発生段階を保っていることを示す。着床後に形成される卵筒胚からもEpiSCという多能性幹細胞が作製される。しかし、EpiSCを胚盤胞へ移植してもキメラ個体は形成されない。また、その多能性維持は塩基性線維芽細胞増殖因子(bFGF)を必要とする。このような差異から前者は「ナイーブ型」多能性幹細胞、後者は「プライム型」多能性幹細胞と分類される。
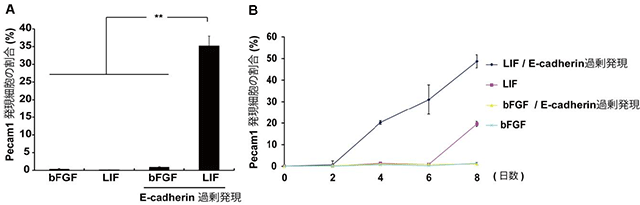
図2 E-cadherin過剰発現によるナイーブ型への変換促進
EpiSCにE-cadherinを過剰に発現させたところ、ナイーブ型多能性幹細胞への変換を示す指標であるPecam1を発現する細胞がLIF添加群において顕著に増加した(A)。またこの条件下では変換にかかる時間も短縮された(B)。bFGF添加群はプライム型を維持する培養条件である。
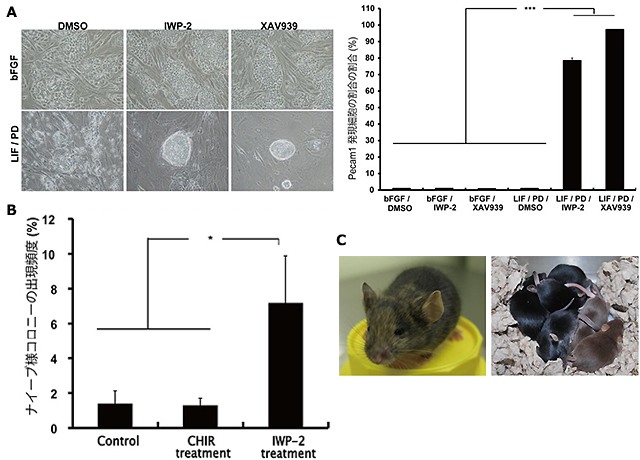
図3 Wnt阻害剤処理によるナイーブ型への変換促進
EpiSCからナイーブ型多能性幹細胞への変換過程において、β-cateninの核局在を阻害するWnt阻害剤(IWP-2,XAV939)またはβ-cateninの核局在を促進する化合物(CHIR)を添加し、作用を検証した。IWP-2またはXAV939添加群ではナイーブ型への変換が促進された(A)。一方、CHIR添加群は非添加群との間に有意な差は認められなかった(B)。Wnt阻害剤添加によって得られたナイーブ型多能性幹細胞株からはキメラ個体が作製でき、生殖系列への寄与も認められた(C)。
<用語解説>
- 注1) キメラ
- 生体内において2種類以上の異なる個体の細胞が混ざること。マウスESCをマウス胚盤胞に移植すると、ESCは胚発生に寄与し、全身性のキメラマウスが形成される。マウスではこのことを利用し、古くから特定の遺伝子の働きを抑えたノックアウトマウス作製に用いられてきた。
- 注2) 多能性
- 外胚葉、中胚葉、内胚葉の三胚葉への分化能を示し、理論的には生体内の全ての細胞に分化できることを指す性質。多能性幹細胞とは、多能性を維持しつつ自己複製が可能な細胞を示す。
- 注3) 卵筒胚
- 胎生5.5~7.5日に見られる着床後の胚。エピブラストとそれに隣接した胚体外外胚葉を持つ構造をとる。このエピブラストの領域からエピブラスト幹細胞を樹立することができる。
- 注4) 胚盤胞
- 受精後、受精卵が卵割を繰り返し、マウスであれば3~4日後に見られる着床前の初期胚。内腔を持つ特徴的な構造をとり、外側を囲む一層の栄養外胚葉と、その内側に塊として存在する内部細胞塊の二つの細胞種からなる。
<発表雑誌>
| 雑誌名 |
米国科学雑誌「Stem Cell Reports」2015年1月13日掲載予定 |
| 論文タイトル |
“Successful Reprogramming of Epiblast Stem Cells by Blocking Nuclear Localization of β-Catenin”
(β-cateninの核局在抑制によるエピブラスト幹細胞のリプログラミング) |
doi |
10.1016/j.stemcr.2014.12.003 |
<お問い合わせ先>
<研究に関すること>
中内 啓光(ナカウチ ヒロミツ)
東京大学 医科学研究所 附属幹細胞治療研究センター 教授
〒108-8639 東京都港区白金台4-6-1
Tel:03-5449-5330
E-mail:
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
剱持 由起夫(ケンモチ ユキオ)、井上 聡子(イノウエ アキコ)
Tel:03-6380-9130 Fax:03-3222-2066
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: