ポイント
- 炎症反応の制御機構の破綻により、アレルギー疾患や自己免疫疾患が発症する。
- HSP70が炎症反応に必須な分子を分解に導く新制御機構を解明した。
- 炎症性疾患の新たな治療法開発が期待される。
JST 戦略的創造研究推進事業において、理化学研究所 統合生命医科学研究センター(RIKEN-IMS)の田中 貴志 チームリーダーらは、炎症反応に必須な転写因子NF-κB注1)の働きを抑制する分子機構に、熱ショックたんぱく質HSP70注2)が関与することを明らかにしました。
ウイルスや細菌に感染すると、私たちの身体は、炎症反応という一連の反応によって、これらの病原体と戦います。しかし、炎症反応が暴走するような状態が続くと、アレルギー疾患や自己免疫疾患などの炎症性疾患を発症します。これらの疾患に対して、炎症反応に必須なNF-κBの活性化の抑制機構は、重要な創薬標的と考えられており、多面的な研究の進展が望まれています。田中チームリーダーらは、これまでに、免疫細胞内において、核内たんぱく質PDLIM2注3)がNF-κBの分解を誘導することで炎症反応を抑制する分子メカニズムを研究してきました。
今回、田中チームリーダーらは、PDLIM2によるNF-κB分解を、熱ショックたんぱく質HSP70が促進することを発見し、その分子メカニズムの一端を解明しました。実際に、HSP70を欠損したマウスの免疫細胞では、NF-κBの分解が妨げられ、正常マウスと比べて、炎症反応が2~3倍増加しました。さらに、HSP70を欠損したマウスに、過剰な免疫反応の1つの病態である炎症性肉芽腫を発症させると、正常マウスと比べて明らかに重症化することが分かりました。
今後、このHSP70による炎症反応の抑制経路をより詳細に調べ、制御する方法を見つけることができれば、アレルギー疾患や自己免疫疾患などの炎症性疾患の新たな治療法の開発に貢献する可能性があります。
本研究は、和歌山県立医科大学 医学部の改正 恒康 教授(研究当時、大阪大学 免疫学フロンティア研究センター 教授)と共同で行ったものです。
本研究成果は、2014年12月16日(米国東部時間)に米国科学誌「Science Signaling」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「炎症反応を負に制御する分子機構の解明」 |
| 研究者 |
田中 貴志(理化学研究所 統合生命医科学研究センター チームリーダー) |
| 研究期間 |
平成23年10月~平成27年3月 |
<研究の背景と経緯>
ウイルスや細菌に感染すると、私たちの身体は、炎症反応という一連の反応を起こすことで、これらの病原体と戦います。病原体を見つけ出す働きを持つ代表的な免疫系の細胞である樹状細胞注4)は、細胞膜上のToll様受容体(TLR)注5)というセンサーを使って病原体を認識すると、そのシグナルが細胞内に伝わり、最終的に炎症反応を誘導するキー転写因子NF-κBを活性化します。活性化したNF-κBは、炎症反応に必要な多くの遺伝子が順序よく働くように指令を出し、炎症反応の開始と進行に必要不可欠な役割を果たしています。これらの炎症反応により病原体に打ち勝つことができます。ところが、このNF-κBが過剰に活性化して炎症反応が暴走するような状態が続くと、アレルギー疾患や自己免疫疾患などの炎症性疾患を発症することが報告されています。このため、正常な炎症反応を保ち炎症性疾患の発症を防ぐには、NF-κBの活性をオンにするだけでなく、それを適切な時点でオフにするシステムが非常に重要です。
2007年に田中チームリーダーらは、炎症反応の抑制する研究の中で見いだしてきた分子であるPDLIM2(PDZ and LIM domain protein 2)という核内たんぱく質が、NF-κBの分解を誘導し炎症を抑制することを明らかにしました。つまり、NF-κBは活性化すると細胞質から細胞核内へ移行し、標的遺伝子の転写を誘導しますが、PDLIM2は、核内に移行したNF-κBにユビキチン注6)という小さなたんぱく質を付加(ユビキチン化)することを明らかにしました。ユビキチン化はたんぱく質分解酵素の目印となることから、NF-κBの分解が誘導され、炎症反応が終息します(図1)。しかしながら、このPDLIM2がNF-κBをユビキチン化した後に分解するメカニズムの詳細は不明でした。
<研究の内容>
田中チームリーダーらは、PDLIM2がNF-κBを分解するメカニズムの詳細を明らかにするために、まず、PDLIM2を欠損した樹状細胞を用いて、PDLIM2が炎症反応開始後のどの時点で実際にNF-κBを分解するのかを調べました。その結果、樹状細胞においては、TLRが認識する細菌成分であるLPS注7)で刺激してから3-5時間経過してはじめてPDLIM2が働くことが明らかになりました。一方、PDLIM2のたんぱく質量自体は、TLRの刺激によって増加しないことから、別の核内たんぱく質がPDLIM2に結合し、PDLIM2の活性を調節しているのではないかと考えました。そこで、PDLIM2に結合するたんぱく質を免疫沈降法注8)を用いて探索したところ、熱ショックたんぱく質のHSP70が同定されました。また、HSP70は、細胞を刺激していない状態では細胞質にのみ存在し、細胞を刺激して3-5時間後に核の中へと移動していました(図2)。興味深いことに、このHSP70が核に移動する時間経過は、前述のPDLIM2が働く時間経過と一致しています。
そこで、培養細胞にNF-κBとHSP70を過剰に発現させ、細胞質と核内のNF-κB量の変化を検討したところ、核内のNF-κBが顕著に減少しており、HSP70は核内のNF-κBの分解を促進することによりNF-κBを不活性化することが明らかになりました(図3)。また、HSP70を欠損したマウスから採取した樹状細胞を、LPSで刺激したときの炎症性サイトカイン注9)の産生量を測定したところ、正常マウスに比べて2~3倍増加しており(図4)、同時にNF-κBの分解も妨げられていました。また、個体レベルでのこの分子メカニズムが働いていることを、Propionibacterium acnes(P.acnes )という細菌を投与して肝臓に炎症反応を引き起こすマウスモデルを用いて確認してみました。HSP70欠損マウスにP.acnes を投与したところ、正常マウスと比べて肝臓の炎症性肉芽種の形成が明らかに促進されており、HSP70欠損マウスでは過剰な炎症反応が起こっていると考えられました(図5)。
さらに田中チームリーダーらは、HSP70とPDLIM2がどのようにしてNF-κBの分解を促進しているのかを調べました。ユビキチン分子が付加されたたんぱく質は、プロテアソーム注6)というたんぱく質分解酵素により分解されて不活性化されることが知られています。そこで、免疫沈降法を用いてHSP70、PDLIM2とプロテアソームとの結合を調べたところ、HSP70は、PDLIM2およびNF-κBと結合するとともに、プロテアソームに結合するたんぱく質として知られているBAG1注10)とも結合して、PDLIM2-NF-κB複合体のプロテアソームへの輸送を助けることによりNF-κBの分解・不活性化を促進することが明らかになりました(図6)。
<今後の展開>
HSP70は以前から炎症反応に抑制的に働くことは知られていましたが、どのようにして抑制するのかは不明でした。今回、田中チームリーダーらは、転写因子を積極的に分解することでシグナル伝達を負に制御するというHSP70の新たな機能を発見し、HSP70が炎症反応を負に制御する分子メカニズムの詳細を明らかにしました(図7)。今回解明したHSP70による炎症反応の抑制機構は、アレルギー疾患などの炎症性疾患の新たな治療法開発のターゲットとなることが期待できます。
<参考図>
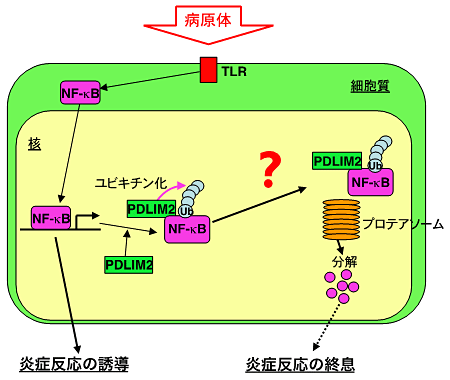
図1 樹状細胞における、PDLIM2による炎症反応抑制メカニズム
NF-κBは活性化すると細胞質から細胞核へ移行し、標的遺伝子の転写を誘導する。PDLIM2は、核内に移行したNF-κBに結合し、ユビキチンを付加する。その結果、プロテアソーム(たんぱく質分解酵素)がNF-κBを分解することで炎症反応を抑制する。しかし、PDLIM2によるNF-κBへのユビキチン化反応がいかに制御されるか、ユビキチン化NF-κBがいかにして分解されるかについての詳しい分子メカニズムは不明のままだった。
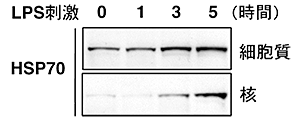
図2 LPS刺激によるHSP70の核内への移動
樹状細胞をLPS刺激したときの細胞質および核内のHSP70のたんぱく質量を、ウェスタンブロット法を用いて経時的に調べた。HSP70は、細胞を刺激していない状態では細胞質にのみ存在し、細胞をLPSで刺激して3-5時間後に核の中へと移動した。
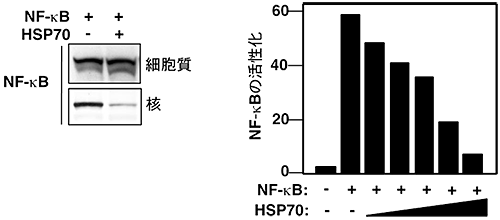
図3 HSP70の過剰発現によるNF-κBの減少と活性抑制
- (左)培養細胞にNF-κBとHSP70を過剰に発現させて、細胞質および核内のNF-κBのたんぱく質量を調べた。NF-κBだけを過剰発現させた場合と比べ、核内のNF-κB量が少ないことが分かった。
- (右)NF-κBとHSP70を過剰に発現させた培養細胞について、ルシフェラーゼアッセイを用いてNF-κBの標的遺伝子のたんぱく質の発現を検出することで、NF-κBが遺伝子を転写する活性を調べ、NF-κB活性化の程度を算出した。縦軸は、過剰発現させない培養細胞中のNF-κBを1とした時の相対強度。HSP70の発現量依存的にNF-κBの活性が抑制された。
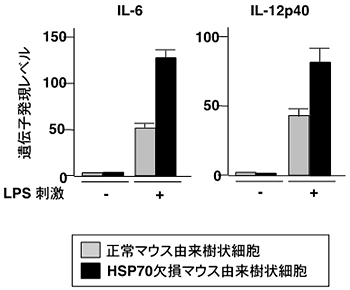
図4 HSP70欠損マウス由来の樹状細胞と正常マウス由来の樹状細胞の比較
樹状細胞をLPSで刺激したときの炎症性サイトカイン(IL-6、IL-12p40)の遺伝子発現量を調べた。HSP70欠損マウス由来の樹状細胞は、正常マウス由来樹状細胞と比べて2~3倍増加していた。
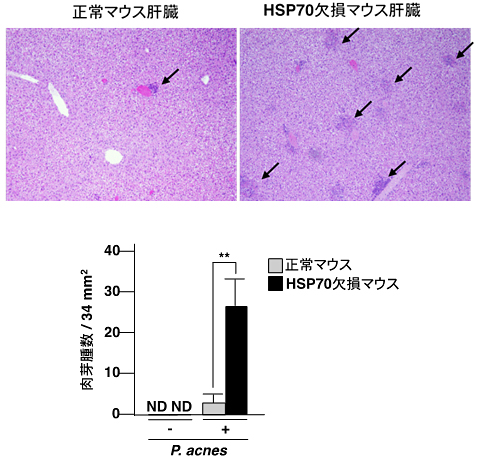
図5 HSP70欠損マウスにおける肝臓の肉芽腫形成の促進
- (上)正常マウスおよびHSP70欠損マウスに、P.acnes を投与して6日目の肝臓の組織像。矢印で示した箇所が肉芽腫。
- (下)同一面積中の肉芽腫を数えたところ、HSP70欠損マウスの方が明らかに形成数が多かった。P.acnes を投与していない何れの群のマウスでは、肉芽腫は認められなかった(ND)。
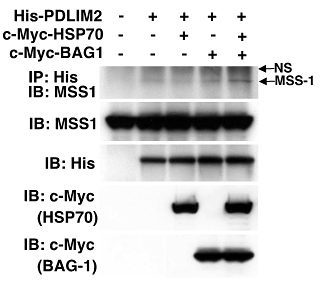
図6 BAG1およびHSP70によるPDLIM2とプロテアソームの結合の促進
培養細胞にPDLIM2とともにHSP70またはBAG1、あるいはHSP70とBAG1の両方を過剰に発現させて、PDLIM2とプロテアソームの1つのサブユニットであるMSS1との結合を調べた。HSP70またはBAG1だけを過剰発現させた場合と比べ、両者を同時に発現させたときの方が、PDLIM2とMSS1の結合が強くなることが分かった。
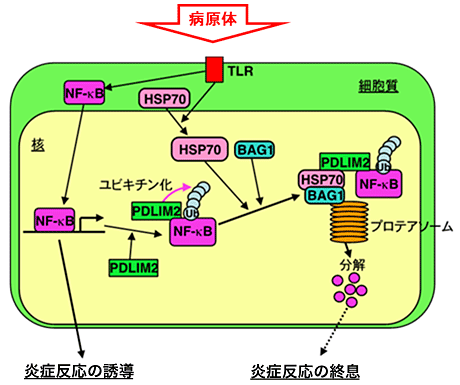
図7 HSP70がNF-κBを不活性化するメカニズム
病原体の成分をTLRが認識すると、そのシグナルによりNF-κBが活性化し細胞質内から核内に移行する。そしてDNA上の特定の部位に結合して、炎症反応に必要な多くの遺伝子が順序よく働くように指令を出す(図の左側)。一方で、TLRからのシグナルがあった3~5時間後に、HSP70が細胞質内から核内に移行し、BAG1と共同して、PDLIM2によってユビキチン化された核内のNF-κBのプロテアソームへの輸送を助けることにより、NF-κBの分解・不活性化を促進し炎症反応を終息させる(図の右側)。
<用語解説>
- 注1) 転写因子NF-κB
- 特定のDNA配列に結合して遺伝子の発現を制御するたんぱく質を転写因子という。転写因子NF-κBにはp65を含む5種類のサブユニットが知られており、これらが二量体を形成したものが転写因子として機能する。後述のToll様受容体が認識する菌体成分などの刺激で活性化され、炎症性サイトカインなどの発現を亢進させることで、炎症反応の誘導に中心的役割を果たす。
- 注2) HSP70
- 熱ショックたんぱく質70(HSP70)は、細胞が熱などの環境からのストレスにさらされたときに発現が亢進して、これらのストレスから細胞を保護する一群のたんぱく質(ストレスたんぱく質とも呼ばれる)のうちの1つで、分子量が70kD(キロダルトン)であることからこのように名付けられた。HSP70は、本来は、たんぱく質が新たに合成される際の正確な立体構造の形成を補助するか、あるいは立体構造の形成に失敗してしまったたんぱく質を分解するかの選択を行う品質管理を担っている。
- 注3) PDLIM2
- PDZドメインとLIMドメインという2つの特殊な構造を持つ核内たんぱく質で、田中チームリーダーらにより発見された。標的たんぱく質となる転写因子をユビキチン化し分解を誘導することで、シグナル伝達を終息させるように働く。
- 注4) 樹状細胞
- 樹状突起を持つ白血球で、微生物を認識して取り込み、Tリンパ球に異物の情報を伝える細胞(抗原提示細胞)として働く。
- 注5) Toll(トール)様受容体(TLR/Toll-Like Receptor)
- 病原体由来のさまざまな成分の認識に関与する膜たんぱく質群の総称。ヒトでは10種類、マウスでは12種類が報告されており、それぞれのTLRが病原体特異的な成分(膜分子や核酸)を認識する。
- 注6) ユビキチン/プロテアソーム
- ユビキチンは76個のアミノ酸からなる小さなたんぱく質で、標的となるたんぱく質に多数のユビキチン分子が鎖状に結合すると、標的たんぱく質はプロテアソームという巨大なたんぱく分解酵素複合体に認識され分解される。
- 注7) LPS(リポ多糖)
- グラム陰性桿菌の細胞壁を構成する糖脂質の1つ。樹状細胞の細胞膜表面にあるToll様受容体の1つTLR4を刺激することにより、転写因子NF-κBを活性化する。
- 注8) 免疫沈降法
- 目的のたんぱく質に特異的に結合する抗体を結合させ、さらに抗体にビーズなどの担体を結合させて沈殿させることにより目的のたんぱく質だけを精製する方法。
- 注9) 炎症性サイトカイン
- サイトカインとは、細胞同士の情報伝達にかかわるさまざまな生理活性を持つたんぱく質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。
- 注10) BAG1
- ユビキチン様ドメインとBAGドメインという2つの特殊な構造を持つ。ユビキチン様ドメインを介してプロテアソームと結合することから、たんぱく質のプロテアソームへの輸送にかかわるといわれている。また、BAGドメインを介してHSP70と結合し、HSP70の機能を制御することも示唆されている。
<論文タイトル>
“HSP70 mediates degradation of the p65 subunit of nuclear factor κB to inhibit inflammatory signaling”
(PDLIM2によるNF-κBのp65サブユニットの分解とNF-κBシグナルの負の制御にはHSP70が必須である。)
doi: 10.1126/scisignal.2005533
<お問い合わせ先>
<研究に関すること>
田中 貴志(タナカ タカシ)
理化学研究所 統合生命医科学研究センター 炎症制御研究チーム チームリーダー
〒230-0045 神奈川県横浜市鶴見区末広町1-7-22
Tel:045-503-9283
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail: