ポイント
- HMGB1を分子標的とする遺伝子治療を開発し、小脳失調症モデルマウスで顕著な治療効果を確認。
- HMGB1にミトコンドリアのDNA損傷を修復するという新たな機能があることを発見。
- 神経変性疾患に対する遺伝子治療の開発につながるものと期待。
JST 戦略的創造研究推進事業において、東京医科歯科大学 難治疾患研究所の岡澤 均 教授らは、DNAの機能に大きな影響を与えるたんぱく質HMGB1注1)を遺伝子治療注2)的に補充することで脊髄小脳失調症1型(SCA1)注3)モデルマウスの寿命と運動能力を顕著に改善することに成功しました。
近年、神経変性疾患の発症メカニズムが明らかにされつつありますが、いずれの変性疾患においても、病態進行を抑制する根本的治療(病態修飾療法注4))には成功していませんでした。
本研究グループは、2007年に網羅的たんぱく質質量解析(プロテオミックス解析)注5)を用いて、SCA1およびハンチントン病の神経細胞モデルで共通して減少するたんぱく質としてHMGB1を発見しました。この成果を基盤として、今回の研究では、HMGB1発現トランスジェニックマウス注6)との交配、またはHMGB1発現アデノ随伴ウイルスベクター注7)の投与により、SCA1モデルマウスの症状が顕著に改善することが示されました。さらに、HMGB1にはミトコンドリアのDNA損傷注8)を修復するという新たな機能があることも分かり、HMGB1補充により核DNAのみならずミトコンドリアDNAの損傷修復を介することによっても治療効果を発揮することが示されました。この成果は病態修飾治療への壁を破る可能性を示すもので、今後、SCA1などのポリグルタミン病注9)をはじめ神経変性疾患に対するHMGB1の遺伝子治療の開発につながるものと期待されます。
本研究成果は、2014年12月15日(現地時間)に欧州分子生物学機構(EMBO)の科学誌「EMBO Molecular Medicine」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出」
(研究総括:樋口 輝彦 国立精神・神経医療研究センター 理事長) |
| 研究課題名 |
「ポリグルタミン病の包括的治療法の開発」 |
| 共同研究者 |
岡澤 均(東京医科歯科大学 難治疾患研究所 教授) |
| 研究期間 |
平成21年10月~平成27年3月 |
JSTはこの領域で、少子化・高齢化・ストレス社会を迎えた日本において社会的要請の強い認知・情動などをはじめとする高次脳機能の障害による精神・神経疾患に対して、脳科学の基礎的な知見を活用し、予防・診断・治療法などで新技術の創出を目標にしています。
上記研究課題では、本質的な治療法のない遺伝性神経変性疾患のポリグルタミン病について、異常たんぱく質凝集の抑制・分解過程の制御、転写異常などの病態過程の制御の観点からの治療法の開発を目指します。
<研究の背景と経緯>
脊髄小脳失調症は、アルツハイマー病、パーキンソン病に次いで患者数の多い神経変性疾患で、患者数は推定3万人です。有効な治療法は確立されておらず、その病態解明と治療開発は喫緊の社会的問題です。
今回の研究の対象であるSCA1は、原因遺伝子の一部(ataxin-1遺伝子エキソン)のCAGリピート配列の異常伸長注10)によって生じることが明らかになっていました。グルタミンというアミノ酸をコードする3つの塩基配列(C=シトシン、A=アデニン、G=グアニン)が異常に伸長することから、ほかの複数の遺伝性脊髄小脳失調症(SCA2、SCA3、SCA6、SCA7、SCA17)、ハンチントン病、球脊髄性筋萎縮症などとともに、ポリグルタミン病と呼ばれ、共通の病態を持つと考えられています。
これらの疾患では、疾患たんぱく質が正しく折り畳まれない(ミスフォールディング)ために立体的な構造異常が生じ、通常では関連のない分子と結合することによって機能を阻害する、あるいは、結合した分子を凝集体に取り込んで細胞内で機能すべき場所から隔離してしまうなどのメカニズムを通じて、多くの細胞機能異常を生じさせることが知られています。岡澤教授らの先行研究から、変異型ataxin-1がHMGB1と結合し、核DNAの損傷修復機能を果たすHMGB1が不足するため、細胞機能異常が生じる可能性が示されていました(Qi et al, Nature Cell Biology 2007)。
<研究の内容>
研究グループは2007年に網羅的たんぱく質質量解析を用いて、SCA1およびハンチントン病の神経細胞モデルで共通して減少するたんぱく質としてHMGB1を発見し、その補充によってSCA1ショウジョウバエモデルの神経変性が改善することを報告しました(Qi et al, Nature Cell Biology 2007)。そして、この研究成果を臨床応用に近づけていくために、次のステップとして哺乳類であるモデルマウスでの検討を行いました。今回の研究では、米国・ベイラー医科大学のゾービ教授らが開発したSCA1モデルマウス(ヒト患者のataxin-1遺伝子エキソン7のCAG部分を挿入したノックインマウス)を用いて、HMGB1の補充による治療効果を調べました。
まず、このSCA1モデルマウスとHMGB1を過剰に発現させたマウスとを交配させ、変異ataxin-1と外来性HMGB1の両方を発現するダブルトランスジェニックマウスを作製し、その運動能力と寿命を観察しました。その結果、ロータロッドという運動機能テストにおいて、SCA1モデルマウスでは5週齢で運動機能の低下が見られるのに対し、ダブルトランスジェニックマウスでは7週齢から改善が見られ、少なくとも21週齢まで改善効果が持続しました。また、SCA1モデルマウスでは、小脳プルキンエ細胞において核のDNA損傷が増加しているのに対し、ダブルトランスジェニックマウスではこれが改善していました。
また、平均寿命は217日から282日に(+68%)、最長寿命は274日から360日に延びました。
次に、SCA1モデルマウスにアデノ随伴ウイルス(AAV)ベクターを用いて外来性HMGB1を発現させる遺伝子治療実験も行い、同様に運動能力と寿命を観察しました。ダブルトランスジェニックマウスと同様に、AAVベクターによる遺伝治療実験においても、運動機能の低下が見られた5週齢のSCA1モデルマウスの小脳表面への注射を行ったところ、9週齢および13週齢においても運動機能の改善を認めました。平均寿命はダブルトランスジェニック以上の効果があり、平均寿命が217日から365.5日に(+68%)、最長寿命は274日から448日に延びました(図1)。
さらに、今回の研究では、HMGB1が核DNAのみならず、ミトコンドリアDNAの損傷修復に関与することを新たに明らかにしました。HMGB1は核内部に豊富に存在するたんぱく質で、ヒストンからのDNAの解きほぐしやDNAの折れ曲がりの調節などを行うDNA構造調節たんぱく質として知られています。加えて近年では、細胞質においてオートファジーによるミトコンドリアの自己消化(マイトファジー)に関わることも明らかになりました。
今回の研究では、精製したミトコンドリアのたんぱく質解析や電子顕微鏡を用いた免疫染色の結果から、HMGB1がミトコンドリアに存在することを示し(図2)、さらにその分布はミトコンドリア膜の内部であることを確認しました。ミトコンドリアにおける、HMGB1の機能は、PCRによるDNA損傷評価法注11)、CAPアッセイ法注12)、ChIP法注13)、ニックエンドラベリング法注14)などの解析から、ミトコンドリアDNA損傷修復であることも示されました(図3)。
また、SCA1モデルマウスの病態においてはミトコンドリアのDNA損傷が増加していることが示されましたが、HMGB1の補充によりミトコンドリアのDNA損傷が減少しました。SCA1モデルマウスおよびダブルトランスジェニックマウスの小脳組織から抽出したDNAの次世代シーケンサーによる解読結果からも、HMGB1はSCA1モデルマウスで生じるミトコンドリアDNAの変異増加を正常化していることが分かりました。さらに、SCA1モデルマウスで増加したミトコンドリアDNA切断がダブルトランスジェニックマウスでは改善していました(図4)。
以上から、HMGB1は核DNAに対する損傷修復機能のみならず、ミトコンドリアDNAの品質管理機能も介して、神経変性を抑止する作用があるものと考えられました。
今回の研究では、HMGB1を分子標的として病態修飾による治療の可能性を明らかにしただけでなく、SCA1モデルマウスとして標準的と考えられている変異ataxin-1ノックインマウスにおいて世界最高水準の治療効果を示したものです。また、基礎研究の成果としても、HMGB1がミトコンドリアDNAの損傷修復に関与することを世界で初めて明らかにしました。
なお、本研究は、伊藤 日加瑠 東京医科歯科大学 助教(現 ミネソタ大学 博士研究員)、藤田 慶太 東京医科歯科大学 特任助教、田川 一彦 東京医科歯科大学 准教授の協力を得て、村松 慎一 自治医科大学 教授、清水 潤 東京大学 講師、清水 重臣 東京医科歯科大学 教授との共同研究として行われました。米国・ベイラー医科大学のゾービ教授からはノックインマウス提供などの協力を得ました。また、本研究の一部は、新学術領域研究『シナプス病態』および、文部科学省 脳科学研究戦略推進プログラムにおいて行われました。
<今後の展開>
今回の研究成果で、ダブルトランスジェニックマウス、またアデノ随伴ウイルスを用いた遺伝子HMGB1の補充により、双方の結果ともマウス個体で神経変性を改善することが示され、哺乳類でのHMGB1補充の有効性が確認されました。また、詳細な組織学的検討から、脳炎症などの副作用も見られませんでした。今後は、ウイルスベクターの改善、霊長類モデルでの検証などを経て、あるいは、直接的に臨床試験へステップアップすることが期待されます。
本研究成果から、脊髄小脳失調症にアプローチする新しい治療戦略の方向性が示されました。
<参考図>
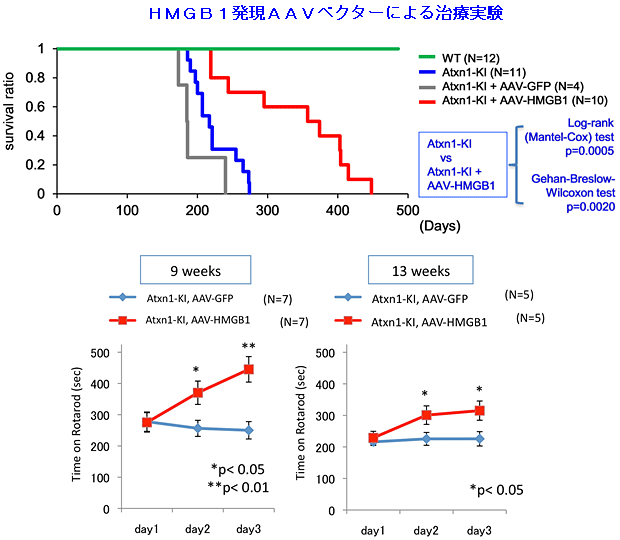
図1 AAVウイルスベクターによるHMGB1発現は
変異Atxn1ノックインマウスの寿命を顕著に延ばし、運動機能も改善する
SCA1モデルマウスの小脳表面の髄液腔にAAVウイルスベクターを注入してHMGB1を発現させた。平均寿命は217日から365.5日に(+68%)、最長寿命は274日から448日に延びた。コントロールマウス(緑線)は500日を超えても死亡する個体はいなかったが、SCA1モデルマウス(青線)では、200日頃から死亡する個体があり、生存率が低下する。SCA1モデルマウスにAAV-HMGB1を投与すると(赤線)、生存期間が伸びるが、AAV-GFPの投与(灰色線)では延長しない。また、下に示す、ロータロッド試験による運動機能評価でも有意な改善を認めた。
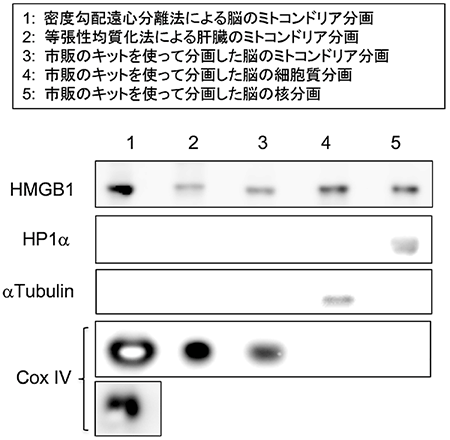
図2 HMGB1はミトコンドリアに存在している
1−5に示す各種精製法でミトコンドリアを分離して、ウェスタンブロットを行った。HMGB1は精製したミトコンドリアのたんぱく質に含まれている。
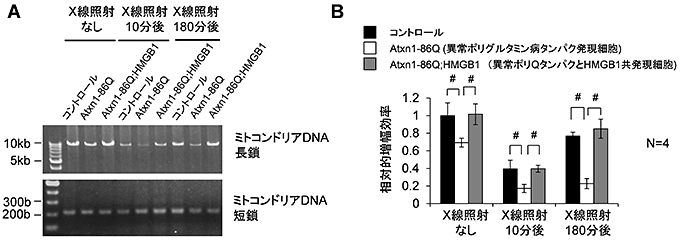
図3 HMGB1は、ミトコンドリアDNAの損傷修復を促進する
L929細胞およびL929細胞に変異アタキシン1、変異アタキシン1+HMGB1を発現させたものに放射線照射(IR)してミトコンドリアDNAに損傷を起こしたのち、時間経過を追って修復スピードを観察した。修復状況が悪いミトコンドリアDNAからは長いDNA断片のPCR増幅は困難であるので、long fragment/short fragmentの比が低下する。変異アタキシン1発現細胞では、10分から180分の回復が悪いが、HMGB1をともに発現させることによって損傷修復が改善している。
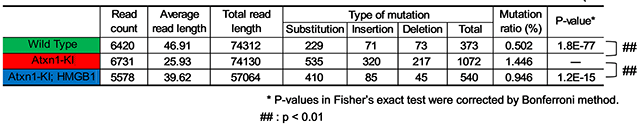
図4 HMGB1はミトコンドリアDNA変異を減少させる
SCA1モデルマウス(Atxn1-KI)、ダブルトランスジェニックマウス(Atxn1-KI;HMGB1)、コントロールマウス(Wild Type)の小脳組織から、DNAを抽出し、ミトコンドリアDNA配列を次世代シーケンサーで網羅的に解読した。その中の変異の種類と頻度を示す。塩基の入れ替え(Substitution)、挿入(Insertion)、欠失(Deletion)などが起きた回数を記載している。それらの変異頻度(Mutation ratio)はコントロールマウスに比較して、SCA1モデルマウスで有意に増加していたが、ダブルトランスジェニックマウスでは改善を示した。
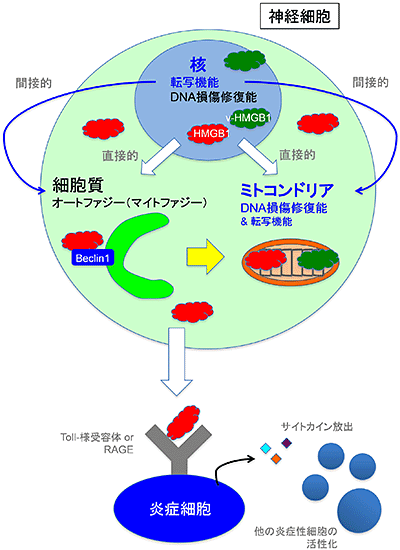
図5 HMGB1が小脳変性を抑制する複数のメカニズム
HMGB1は核においてDNAの転写、損傷修復を促すのみならず、細胞質では劣化したミトコンドリアのマイトファジーを促進し、今回示されたようにミトコンドリアDNAの修復にも働く。ただし、細胞が壊れると細胞外に放出されて炎症を引き起こす。
<用語解説>
- 注1) HMGB1
- DNAの高次構造を制御する最も重要なたんぱく質として知られており、全ての細胞の核内に存在している。DNAの高次構造を変化させる(例えば、ヒストンにDNAが巻き付いているところを解きほぐす)ことは、DNAからのRNA転写、DNA損傷修復、DNA複製など、DNAを介した全ての核機能に必須である。そして、神経細胞の大多数は生まれたときから生涯生き続けるため、DNAが受ける損傷を常に修復する必要がある。このため、HMGB1が脊髄小脳失調症1型(SCA1)病態で減少すると、DNA損傷修復や転写に大きな影響を受けると考えられる。
- 注2) 遺伝子治療
- 遺伝子発現を目的としたウイルスベクターなどを用いて、組織あるいは血液中に特定の遺伝子あるいはその一部を発現させて、導入した遺伝子の機能を利用して、疾患を治療しようとする方法全般を意味する。
- 注3) 脊髄小脳失調症1型(SCA1)
- 脊髄小脳失調症は、小脳神経細胞(プルキンエ細胞、歯状核など)の神経変性を中心として、時に大脳基底核、脊髄運動神経、網膜神経細胞、聴神経、末梢神経などの変性を合併する一群の脳疾患である。常染色体優性、常染色体劣性などの形式をとる遺伝性脊髄小脳失調症と、家族歴のはっきりしない弧発例がある。
-
この中で、脊髄小脳失調症1型(SCA1)は、常染色体優性遺伝形式を取り、ataxin-1という原因遺伝子のたんぱく翻訳部分(エキソン)の中のCAG繰り返し配列が正常よりも伸長することが原因となっている。
- 注4) 病態修飾療法
- 神経変性疾患の研究領域で多用される用語。神経変性は細胞機能障害から細胞死に至る一連の過程と考えられている。機能障害に伴って、神経細胞の分泌する伝達物質(ニューロトランスミッター)が減少して、神経回路が変調する。治療の方法として、このような伝達物質を補う方法もある。これらは「症状改善療法」と呼ばれ、パーキンソン病に用いるレボドーパはその一例である。しかし、神経細胞の機能障害から細胞死に至る過程そのものは抑止しないために、症状はやがて進行する場合が多い。これに対して、神経変性の過程そのものを抑止する治療法が「病態修飾療法」であり、根本的治療と考えられている。
- 注5) 網羅的たんぱく質質量解析(プロテオミックス解析)
- 質量解析は、サンプルに含まれるたんぱく質、脂質、糖質などの物質を、それらの質量から同定する方法である。この場合、特定の1から数種類たんぱく質のみを対象として、質量解析を行うショットガン法と、脳組織や腫瘍組織などに含まれる全てのたんぱく質を同定しようとする網羅的手法がある。後者を網羅的たんぱく質質量解析あるいはプロテオミックス解析と呼ぶ。近年の質量解析装置そのものの進歩により、より多数のたんぱく質を網羅的に同定することが可能になった。
- 注6) HMGB1発現トランスジェニックマウス
- HMGB1遺伝子を通常よりも多量に神経細胞に発現させる目的で遺伝子操作を加えたマウスのこと。神経細胞特異的プロモーターとHMGB1遺伝子cDNAをつないだプラスミド断片をマウス受精卵に注入して、ゲノムに組み込ませている。
- 注7) HMGB1発現アデノ随伴ウイルスベクター
- アデノ随伴ウイルスは非病原性ウイルスであり免疫反応を引き起こすことが少なく、安全なウイルスベクターとして注目されている。したがって法令上はP1レベルでの取り扱いが認められている。また、神経細胞(ニューロン)のような非分裂細胞にも高い効率で遺伝子導入が可能である。今回の研究では、アデノ随伴ウイルスにHMGB1遺伝子の全長を組み込んだ治療用ベクターを作製して実験に用いた。
- 注8) ミトコンドリアのDNA損傷
- DNAは酸化ストレスにより生ずる活性酸素や、DNAからRNAを転写する際、あるいは放射線照射、化学物質など、さまざまな要因によって損傷を受ける。また最近では、神経細胞の活動そのものによってDNAが損傷を受けることも知られている。細胞には核DNAとミトコンドリアDNAがあり、両者の損傷修復が細胞機能と細胞寿命の上で重要と考えられる。核DNAの損傷修復機構に比べて、ミトコンドリアDNAの損傷修復のメカニズムは良く分かっていない。
- 注9) ポリグルタミン病
- 遺伝性脊髄小脳失調症の中で、原因遺伝子エキソン内のCAGリピート伸長が原因となって発症するグループを指す。エキソンのCAGはグルタミンに翻訳されるため、原因たんぱく質において、ポリグルタミン鎖の伸長につながる。SCA1、SCA2、SCA3、SCA6SCA7、SCA17、DRPLAはポリグルタミン病に属する。異常伸長したポリグルタミン鎖は2次構造としてβシートを取り易く、これが基盤となってたんぱく質の凝集を起こしやすくなるといわれている。
- 注10) リピート配列の異常伸長
- SCA1を含むポリグルタミン病は、遺伝子エキソン内部のCAGリピート配列の繰り返し数が通常20−30未満であるところが40以上に増加すること(異常伸長)によって起こる。リピート配列はDNAの複製・組み換えなどにおいて不安定なことから、配偶子特に精子発生の段階で何らかの原因で異常伸長が生じるとされている。
- 注11) PCRによるDNA損傷評価法
- polymerase chain reaction(ポリメラーゼ連鎖反応)の略称。DNAの増幅を目的とし、増幅したい鋳型DNAとDNA合成酵素(DNAポリメラーゼ)、特定の塩基配列をもつプライマーなどを混合して行う。高温によって一本鎖になったDNA(変性)は、急速な冷却によって再度二本鎖DNAになる(アニーリング)。このとき、大量のプライマーがあれば、DNA-DNA同士の結合よりもプライマーとDNAの結合がより多く起こる。そこへDNAポリメラーゼが働くとプライマーを起点とする相補的DNAが合成され、これら一連の行程を繰り返すことでDNAは増幅される。
- 今回はPCRの鋳型DNAとしてミトコンドリアDNAを用いた。ミトコンドリアDNAにDNA切断などの損傷が含まれると、DNAの複製伸長が起きにくくなる。増幅するDNAの長さが長いほど、損傷による影響を受けやすくなるので、長いDNAの増幅と短いDNAの増幅の比率を取ることによって、DNA損傷の程度を評価できる。
- 注12) CAPアッセイ
- 細胞(HeLa細胞)のDNAに損傷があると、抗生物質であるクロラムフェニコール(CAP)に対して抵抗性(耐性)を示すことを利用して、DNA損傷の程度を評価する方法。損傷したDNAを持つ細胞が形成するコロニーを観察し、形成数を評価した。
- 注13) ChIP法
- 抗体を用いてたんぱく質と核酸の複合体を免疫沈降して、両者の結合関係を調べる方法。今回はミトコンドリアDNAとHMGB1の結合関係を調べるため、ミトコンドリアDNAを抗HMGB1抗体で免疫沈降した。その後、ミトコンドリアに特異的なプライマーを使ってPCR反応でDNAを増幅させ、DNA損傷後にHMGB1がミトコンドリアDNAに結合することが分かった。
- 注14) ニックエンドラベリング法
- 放射性同位元素(ラジオアイソトープ;32Pなど)を用いて標識されたヌクレオチド ([α-32P]dCTPなど)をDNAに取り込ませ、DNAを標識する方法。今回は、損傷したDNAの修復過程で、ミトコンドリアDNAに取り込まれるRI標識ヌクレオチドを検出することで、どの程度DNAが修復したかを評価した。その際、HMGB1たんぱく質が存在すると、ヌクレオチド取り込み量が増え、抗HMGB1抗体(HMGB1に結合して働きを阻害する)がさらに混ざると取り込み量が減ったことから、HMGB1がミトコンドリアDNAへのヌクレオチド取り込みを促進することが分かった。
<論文タイトル>
“HMGB1 facilitates repair of mitochondrial DNA damage and extends the lifespan of mutant ataxin-1 knock-in mice”
(HMGB1はミトコンドリアDNAの損傷修復を促進し、変異アタキシン1ノックインマウスの寿命を延長する)
doi: 10.15252/emmm.201404392
<お問い合わせ先>
<研究に関すること>
岡澤 均(オカザワ ヒトシ)
東京医科歯科大学 難治疾患研究所 神経病理学分野 教授
〒113-8510 東京都文京区湯島1-5-45
Tel:03-5803-5847 Fax:03-5803-5847
E-mail:
<JST事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
東京医科歯科大学 広報部 広報課
〒113-8510 東京都文京区湯島1-5-45
Tel:03-5803-5833 Fax:03-5803-0272
E-mail: