ポイント
- ヒトゲノムの中で1カ所しかない塩基配列のデータベースを構築した。
- TALENおよびCRISPR注1)を用いてデュシェンヌ型筋ジストロフィー(DMD)の患者さん由来iPS細胞においてジストロフィン遺伝子を修復した。
- 遺伝子修復したiPS細胞において、意図しない致命的な遺伝子変異は見られなかった。
- 筋細胞へ分化させたところ、正常型のジストロフィンタンパク質が検出された。
<要旨>
李 紅梅 大学院生(CiRA 初期化機構研究部門)、堀田 秋津 助教(CiRA 初期化機構研究部門、JST さきがけ)らの研究グループは、デュシェンヌ型筋ジストロフィーの患者さんから作製したiPS細胞において、TALENやCRISPRといった遺伝子改変技術を用いて、病気の原因遺伝子であるジストロフィンを修復することに成功しました。
デュシェンヌ型筋ジストロフィーは、ジストロフィンという遺伝子に変異が生じ、筋肉の衰弱が進行していく疾患です。患者さんから得たiPS細胞でジストロフィン遺伝子を修復することが、デュシェンヌ型筋ジストロフィーの新たな遺伝子治療につながると期待できますが、30億塩基で構成される巨大なヒトゲノムの中で、ジストロフィン遺伝子というたった1カ所の変異だけを精密に修復するのは困難でした。
堀田助教らの研究グループは、まずゲノム上の配列の中から、予期しない場所でDNA切断が起きないように、ゲノム全体で1カ所しかない配列のデータベースを作成し、その情報を元に遺伝子の切断部位を決めました。ジストロフィンタンパク質の機能を取り戻すために、研究グループは3つの手法(Exon45 skipping、Reading frame shift、Exon44 knock-in)を患者さん由来のiPS細胞に用い、Exon44 knock-in法が最も効果的なアプローチであることを見出しました。更に核型解析、コピー数多型解析、エクソーム解析により、最も遺伝子変異の少ないクローンを選びました。最後に選び出されたiPS細胞を骨格筋細胞へと分化させたところ、正常型のジストロフィンタンパク質を発現していることを確認しました。これらの結果は、将来のiPS細胞技術による遺伝子治療に向けて重要なフレームワークとなることが期待されます。
この研究成果は2014年11月26日正午(米国東部時間)に「Stem Cell Reports」で公開されます。
<研究の背景>
デュシェンヌ型筋ジストロフィーはジストロフィン遺伝子の機能喪失(loss-of-function)によって、筋肉(筋繊維)が萎縮する疾患です。ジストロフィン遺伝子は79のエクソン注2)で構成されており、非常に大きなジストロフィンタンパク質の設計図です。ジストロフィン遺伝子の一部の塩基が欠損したり、エクソンが重複したり、欠損したりすることで、遺伝子の読み枠注3)が本来のものからずれてしまうことでジストロフィンタンパク質が正常に作られなくなり、デュシェンヌ型筋ジストロフィーになります。これまでに様々な方法で遺伝子を修復する治療法の研究が行われてきましたが、完全な形でジストロフィンタンパク質を元に戻すことは未だできていません。アンチセンスオリゴヌクレオチドを使ってエクソンを一部読まないようにすることで、正常な機能を持つジストロフィンへと修復する研究(エクソン・スキッピング)が進められていますが、この場合の効果は一時的なものであり、根本的な治療としては遺伝子そのものを修復する方法が求められています。
遺伝子そのものを修復する手法としてTALENやCRISPRシステムという技術が開発されています。これらはゲノム配列の中から遺伝子の特定の場所を認識し、そこに塩基を追加したり削除したりすることができます。健常人由来のiPS細胞に対して、CRISPRを用いてHIV感染に必要な遺伝子を破壊することでHIV耐性を獲得させた報告や、βサラセミア(地中海貧血)ではCRISPRを用いて患者由来iPS細胞で遺伝子変異を修復したという報告があります。
遺伝子修復を行う際には、ターゲット以外の遺伝子に傷をつけない方法を選択する必要があります。今回の研究では、患者さん由来のiPS細胞とTALENやCRISPRシステムを利用することで、そうしたリスクが低く、デュシェンヌ型筋ジストロフィーの遺伝子治療につながるような手法を見出しました。
<研究結果>
1.ジストロフィン遺伝子の修復戦略
ジストロフィン遺伝子の44番目のエクソンが欠損することにより、ジストロフィンタンパク質の読み枠がずれてしまっているデュシェンヌ型筋ジストロフィーの患者さんからiPS細胞を作製しました。このジストロフィン遺伝子を修復するために3つの戦略を用いました。1つ目は45番目のエクソンを一部読まないように(スキップ)して43と46を直結させて遺伝子の読み枠を戻す方法(Exon45 skipping)、2つ目は塩基を1つ挿入することで読み枠を戻す方法(Reading frame shift)、3つ目は44番目のエクソンを元の位置に挿入する方法(Exon44 knock-in)です(図1)。それぞれの戦略でTALENやCRISPRを用いて遺伝子を修復し、核型解析、コピー数多型解析、エクソーム解析により、最も遺伝子変異の少ないクローンを選びました(図2)。
2.修復したジストロフィン遺伝子から正しくタンパク質が作られた
ジストロフィンタンパク質はiPS細胞の状態では作られないため、上手く修復されたタンパク質ができているかどうかわかりません。図1の方法で遺伝子を修復したiPS細胞を、ジストロフィンタンパク質を作る骨格筋細胞へと分化させたところ、ジストロフィンタンパク質が作られていることが確認できました(図3)。Exon44 knock-inではジストロフィンが元々のサイズで作られていることも確認できました。
<まとめ>
本研究成果は、デュシェンヌ型筋ジストロフィーの患者さんから作ったiPS細胞において、3つの戦略でジストロフィン遺伝子の変異を修復したことを世界で初めて報告しました。TALENやCRISPRを使った遺伝子の修復は、特異的な配列データを使うことで、殆ど予想外の変異導入が無く、狙ったところだけを修復することができました。今後、治療に結びつけるためには、修復したiPS細胞由来の筋肉細胞をどのように移植するかなど、幾つも課題も残っていますが、今回示した手法が、今後の遺伝子治療の枠組みとなることが期待されます。
<参考図>
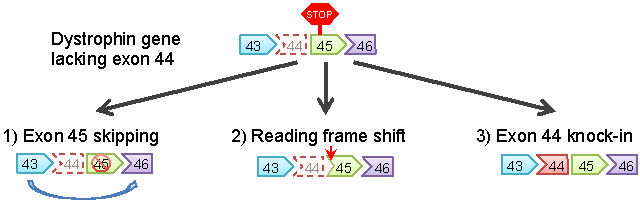
図1 ジストロフィン遺伝子を修復するための3つの戦略
44番目のエクソンが欠損すると遺伝子の読み枠が変わり、45番目のエクソンの途中でタンパク質の合成がストップしてしまい異常なタンパク質となる。そこで読み枠を戻し、タンパク質の合成が最後まで進むようにするために上記3つの戦略を立てた。
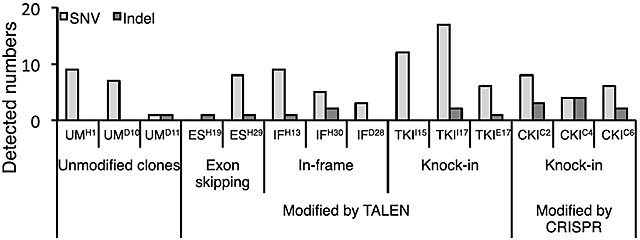
図2 エクソーム解析による遺伝子変異の判定
細胞内の全てのエクソン配列を解読し、遺伝子修復前後での変異の有無を調べた。塩基の欠失や挿入はほとんど見られず、致命的な遺伝子変異は見られなかった。
- SNV:single nucleotide variants、1塩基入れ替わっている箇所。
- Indel:塩基の挿入や欠損。

図3 患者さん由来のiPS細胞から誘導した骨格筋細胞でのジストロフィンタンパク質の発現
免疫蛍光染色でジストロフィンタンパク質の存在場所を調べた。遺伝子修復を行っていない細胞(DMD)ではジストロフィンタンパク質が全く見られないのに対して、TALENやCRISPRをつかって遺伝子修復を行った細胞(TALEN knock-in、CRISPR knock-in)ではジストロフィンタンパク質が見られた。図中のバーは50マイクロメートルを示す。
- DAPI(青):DNAに結合する色素。核の場所を示す。
- MHC(赤):ミオシン重鎖。骨格筋に分化したことを示すマーカー。
- Dystrophin(緑):ジストロフィンタンパク質を示す。
- Merge:左三枚の写真を重ね合わせたもの。
<論文名と著者>
- ○ 論文名
- “Precise Correction of the Dystrophin Gene in Duchenne Muscular Dystrophy Patient iPS Cells by TALEN and CRISPR-Cas9”
doi: 10.1016/j.stemcr.2014.10.013
- ○ ジャーナル名
- Stem Cell Reports
- ○ 著者
- Hongmei Lisa Li1, Naoko Fujimoto1,2, Noriko Sasakawa1, Saya Shirai1, Tokiko Ohkame1, 5, Tetsushi Sakuma4, Michihiro Tanaka1, Naoki Amano1, Akira Watanabe1, Hidetoshi Sakurai1, 6, Takashi Yamamoto4, Shinya Yamanaka1,2,5 and Akitsu Hotta1,2,3
- ○ 著者の所属機関
-
1.京都大学 iPS細胞研究所(CiRA)
2.京都大学 物質—細胞統合システム拠点(iCeMS)
3.科学技術振興機構(JST) さきがけ
4.広島大学 大学院理学研究科
5.グラッドストーン研究所
<本研究への支援>
本研究は、下記機関より資金的支援を受けて実施されました。
- JST 戦略的創造研究推進事業
- JST 再生医療実現拠点ネットワークプログラム
- JSPS 特別研究員制度
<用語説明>
- 注1) TALENおよびCRISPR
- TALEN:Transcription activator-like effector nucleaseの略
- DNAに結合する部分とDNAを切断する部分を持った人工DNA切断酵素。DNAに結合する部分の形を変えることで、任意の場所のDNAを切断することができる。切断されたDNAは細胞内で修復されるが、その際に任意の配列を挿入することもできる。
- CRISPR:Clustered Regularly Interspaced Short Palindromic Repeatの略
- Cas9というDNA切断酵素と切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。
- 注2) エクソン
- 遺伝子の中で最終的なmRNAになる際に残っている部分のことをエクソンと言い、それ以外の部分をイントロンという。遺伝子の中には沢山のエクソンとイントロンがあり、遺伝子の情報を写しとったRNAの段階で、エクソン同士をつなぎ合わせるスプライシングという現象がおこる。タンパク質はエクソン部分のみから形成される。
- 注3) 遺伝子の読み枠
- 遺伝子(DNAの鎖)からタンパク質(アミノ酸の鎖)を作る際に、3つのDNA塩基で1つのアミノ酸を指定している。そのため、遺伝子の途中で1つだけDNA塩基がなくなると、そこから先はアミノ酸を指定するDNAの組み合わせが全て変わってしまい、元のタンパク質とは全く異なるタンパク質となってしまう。
<お問い合わせ先>
<研究内容・CiRAに関すること>
京都大学 iPS細胞研究所(CiRA) 研究支援部門 国際広報室
和田濵 裕之(ワダハマ ヒロユキ)
〒606-8507 京都府京都市左京区聖護院川原町53
Tel:075-366-7005 Fax:075-366-7023
E-mail:
<JST 再生医療実現拠点ネットワークプログラムに関すること>
科学技術振興機構 再生医療研究推進部
坂本 祥純(サカモト ヨシズミ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-5214-8427 Fax:03-5214-7810
E-mail:
<JST 戦略的創造研究推進事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
川口 貴史(カワグチ タカフミ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: